Коронавирусное заболевание 2019 (COVID-19) - сложная респираторная и тромбогенная патология, вызываемая новым штаммом вируса SARS-CoV-2. Показано, что тяжесть ее течения коррелирует с лейко-, лимфопенией и синдромом цитокинового шторма, что указывает на нарушение иммунологической функции организма на фоне несбалансированной реакции клеток [1]. Ключевая роль в воспалительных реакциях, вызванных SARS-CoV-2, отводится клеточным факторам врожденного иммунитета, в частности, в качестве основного триггера цитокинового шторма у пациентов с COVID-19 продемонстрирована провоспалительная активность легочных макрофагов [2]. Показано, что в лейкоцитах крови повышается экспрессия энхансера легкой цепи ядерного фактора каппа активации В-клеток (NF-kB), ферментов циклооксигеназы-2 (ЦОГ-2) и индуцируемой синтазы оксида азота (iNOS) [3]. Гиперактивация этих факторов в макрофагах или дендритных клетках приводит к высвобождению провоспалительных цитокинов, таких как IL6, IL1β, TNFα, а также высвобождению активных форм кислорода [4].
Воспалительная реакция клеток врожденного иммунитета находится в тесной корреляции с митохондриальной активностью [2]. При воздействии вируса клетки-мишени в митохондриях высвобождаются молекулярные паттерны, ассоциированные с повреждением (DAMP), которые активируют рецепторы внутрицитозольных инфламмасом NLRP3 и каспазу 1, что индуцирует последующую секрецию провоспалительных цитокинов IL1β, IL18 и других [5]. Идентифицированы митохондриальные DAMP (кардиолипин, н-формил-пептиды, транскрипционные факторы А, TFAM, мтАФК, мтДНК), которые оказывают ключевое воздействие на реализацию воспалительного иммунного ответа. Накопление аномальных митохондрий способствует старению, возрастным заболеваниям, включая метаболический синдром, гипертонию, диабет, ишемическую болезнь сердца и другие [6]. Показано, что степень тяжести COVID-19 у пациентов сопряжена с дисфункцией провоспалительного профиля иммунных клеток, где митохондриальная дисфункция играет существенную роль [7]. В частности, митохондриальная дисфункция лейкоцитов оказывает влияние на снижение иммунного ответа, являясь ключевым фактором воспаления и повышенной восприимчивости к вирусным инфекциям [8]. Таким образом, наличие митохондриальной дисфункции лейкоцитов при предшествующих COVID-19 заболеваниях в конечном итоге может оказывать влияние на прогрессирование и тяжесть течения коронавирусной инфекции. Исходя из вышеизложенного, целью настоящего исследования являлось определение состояния мембранного потенциала митохондрий лейкоцитов крови при инфекции, вызванной вирусом SARS-CoV-2.
Материалы и методы исследования. Ретроспективно проанализированы показатели уровня лейкоцитов, нейтрофилов, моноцитов, тромбоцитов и С-реактивного белка (СРБ) в крови и соотнесены с соответствующими тестами ПЦР-анализа у 200 пациентов (120 женщин и 80 мужчин), находящихся на стационарном лечении в КГБУЗ «Краевая клиническая больница № 2» (г. Владивосток, Приморский край) с 20 января по 20 сентября 2021 года в качестве пациентов с подозрением на COVID-19. Пациенты были выбраны случайным образом (в алфавитном порядке) с одинаковым количеством людей в группах положительного (100 человек) и отрицательного (100 человек) ПЦР-теста. Средний возраст составил 60,5±19,2 года (59,3±21,9 и 61,2±17,3 года для женской и мужской групп соответственно). Образцы крови были собраны в день проведения ПЦР-теста. СРБ определяли иммунотурбидиметрическим методом на биохимическом анализаторе (Mindray BS-800, Китай). Лейкоциты, тромбоциты и лейкоцитарную формулу определяли на гематологическом анализаторе Sysmex XN-1000 (Sysmex Corporation, Япония). ПЦР-анализ проводили на термоциклере Roche Cobas Z480 (Roche Diagnostic, Базель, Швейцария) с использованием Tib-теста, предоставленного Roche. Пациенты подписали информированное согласие, разрешающее использование анонимно собранных данных для ретроспективных обсервационных исследований, одобрено решением Этического комитета ФГБОУ ВО «ТГМУ» Минздрава России.
Для определения мембранного потенциала митохондрий в суспензию клеток крови при концентрации 5х105 кл/мл вносили 50 мкл раствора катионного липофильного красителя JC-1 (5,5',6,6'-тетрахлор-1,1',3,3'- тетраэтилбензимидазолкарбоцанин иодид/хлорид) (Bector Dikcenson, USA). Процентное содержание флуоресцирующих клеток со сниженным потенциалом митохондриальной мембраны (Δψ) определяли с помощью проточного лазерного цитофлуориметра MACSQuant® Analyzer 10 (Miltenyi Biotech GmbH, Германия) при возбуждающем свечении длиной волны 520 и 570 нм. Обработку данных проводили, используя программу MACSQualify™ Software v/2/5 (Miltenyi Biotec GmbH, Германия).
Статистический анализ проводили с использованием программного обеспечения Statistica 13 (StatSoft, Inc., США) и Excel (Microsoft, Redmond, WA, USA). Сравнение между показателями для COVID-19 позитивных и негативных групп проводилось с использованием двустороннего t-теста с неравными дисперсиями (критерий Уэлча), различия между указанными переменными считались статистически значимыми, если р-значение было ниже 0,05.
Результаты исследования и их обсуждение. Клиническая картина коронавирусной инфекции COVID-19 у большинства больных (95%) характеризовалась наличием двусторонней вирусной пневмонии с регистрацией средней степени 48 (61,5%), тяжелой 30 (38,5%) и крайне тяжелой 2 (2,6%). У мужчин чаще, чем у женщин, отмечались симптомы интоксикации (50,6% против 28,2%) и одышка (28,2% против 10,1%), средний возраст составил 59,8 [35;88] года. У 53,8% пациентов отмечалась дыхательная недостаточность различной степени. Согласно результатам компьютерной томографии повреждение легочной ткани в момент госпитализации отмечено у 88% больных от 20 до 50%. Снижение степени повреждения легких на момент окончания периода госпитализации отмечено у большинства пациентов, но в 26% случаев отсутствовал регресс поражения легких. В крови пациентов в острой фазе заболевания (3-5-й день) количество эритроцитов составило 4,8±0,5Х1012 ед/л, ядросодержащих клеток 5,4±1,4 Х109 ед/л, лимфоцитов 1,8±0,4 Х109 ед/л, моноцитов 0,5±0,2 Х109 ед/л, нейтрофилов 4,4±2,1 Х109 ед/л, из них палочкоядерных – 0,9±0,06 Х109 ед/л (табл.). Необходимо отметить, что общее количество лейкоцитов находилось на нижней границе нормы, за ее границы выходили показатели содержания нейтрофилов, которые превышали значения для здоровых лиц в 1.5 раза, обнаруживалась небольшая лимфопения и моноцитопения. Значительно повышены содержание С-реактивного белка (96,8±15,4 мг/л при норме 0 до 5 мг/л), скорость оседания эритроцитов (26,8±5,7 мм/ч, при норме 12-20 мм/ч) и уровень Д-димера до 665,1±67,8 нг/мл (норма не выше 250 нг/мл). Причем уровень лейкоцитов у всех 80 пациентов COVID-19 достоверно различался с показателями для пациентов с другими вирусными инфекциями, не подтвержденными методом ПЦР (табл.). P-значение <0,001 указывало на существенную связь наличия вируса SARS-CoV-2 у пациентов с низким уровнем лейкоцитов. При подсчете лейкоцитарной формулы также была отмечена явная зависимость между пятью показателями (нейтрофилами, эозинофилами, базофилами, лимфоцитами и моноцитами) и пациентами с COVID-19 (табл.). В группе пациентов с COVID-19 были отмечены низкие уровни нейтрофилов и, в меньшей степени, лимфоцитов. Не отмечено связи между количеством тромбоцитов и заболеванием (p-значение: 0,072), тогда как содержание СРБ было значительно выше (табл.).
Отношение нейтрофилов к лимфоцитам (ОНЛ) является простым параметром, позволяющим легко оценить воспалительный статус пациента. Доказана прогностическая ценность этого показателя при сердечно-сосудистых заболеваниях, инфекциях, воспалительных заболеваниях и некоторых видах рака [9]. Были предложены на основе контрольных значений количественных показателей здоровых доноров пороговые значения показателя ОНЛ, которые составили от 1.65 [±1.96 SD: 0.78–3.53] (95% ДИ [0.75–0.81] до [3.40–3.66]). Нами было обнаружено, что показатель ОНЛ для пациентов с COVID-19 в среднем составил 2,4±0,7, что совпадает с установленным пороговым значением 3,5. Тогда как для пациентов без наличия вируса SARS-CoV-2 этот показатель был значимо выше 4,4±1,3. Как показано в таблице, как количество нейтрофилов, так и лимфоцитов было значимо сопряжено с результатами ОТ-ПЦР на COVID-19 (p<0,001). Пациенты с потенциально сниженным ОНЛ или низким содержанием клеток крови имели более высокую вероятность оказаться инфицированными SARS-CoV-2 (ОШ ОНЛ: 16,7 и ОШ количества лимфоцитов: 10,1, оценка с помощью непарного t-критерия).
Результаты лабораторных тестов пациентов с COVID-19 (по данным ОТ-ПЦР в реальном времени) и без наличия этого вируса
|
Показатель |
Наличие COVID-19 (n=100) |
Другое вирусное заболевание (n=100) |
Значение р |
|
Лейкоциты (абс. число Х109 кл/Л) |
5,4±1,4 |
9,8±4,8 |
<0.001 |
|
Нейтрофилы |
4,4±2,1 |
7,2±5,3 |
0.001 |
|
Лимфоциты |
1,8±0,1 |
1,5±0,9 |
0.01 |
|
Моноциты |
0,5±0,2 |
0,8±0,57 |
0.001 |
|
Эозинофилы |
0,00±0,00 |
0,09±0,2 |
0.003 |
|
Базофилы |
0,09±0,2 |
0,02±0,01 |
<0.001 |
|
Тромбоциты |
243,1±78,9 |
232,8±82,4 |
0.072 |
|
Показатель соотношения нейтрофилов к лимфоцитам, усл. ед. |
2,4±0,7 |
4,4±1,3 |
0.001 |
|
С-реактивный белок, мг/Л |
66,5±6,8 |
63,1±71,2 |
0.034 |
|
Скорость оседания эритроцитов, мм/ч |
26,8±5,7 |
20,2±1,7 |
0.001 |
Примечание: р-значение, показывающее статистически значимую разницу (<0,05) между показателями пациентов с SARS-Cov-2 и отрицательными результатами ПЦР-анализа на этот вирус, выделено жирным шрифтом.
Липофильные свойства мономеров флуоресцентного зонда JC-10 обеспечивают его проникновение через мембрану в цитоплазму клеток, тогда как катионные свойства позволяют этим молекулам накапливаться в местах с повышенным содержанием протонов, формируя «J-агрегаты». Структура агрегатов при возбуждении длиной волны 522 нм достигает максимума испускания 590 нм. В случае деполяризации митохондриальной мембраны при снижении ее потенциала (ΔΨm), JC остается в цитоплазме в виде мономерной формы и при возбуждении той же длиной волны флуоресцирует в зеленом диапазоне – 520 нм. Содержание JC-10 измеряли и представляли в виде процента положительно флуоресцирующих клеток в каналах FL-2 (520 нм, представляющих неапоптотические агрегаты) и FL-1 (590 нм, указывающих на популяцию апоптотических клеток с деполяризованными или поврежденными митохондриями). Было обнаружено, что развитие коронавирусной инфекции COVID-19 сопровождается достоверным увеличением содержания клеток с деполяризованной митохондриальной мембраной. Так, если в крови здоровых лиц количество клеток, содержащих в мономерную форму JC-10, составило 71,9 [48;89,2] %, то у больных COVID-19 – 25,7 [10,6;94,5] %, и соответственно число лейкоцитов, содержащих J-агрегаты, 28,1 [12,7;43,2] % и 72,5 [19,6;84,5] %. Эти показатели указывали на значительное снижение числа клеток, содержащих неповрежденные митохондрии (мономерная форма JC-10), на фоне увеличения количества поврежденных у больных COVID-19. Соотношение между клетками, содержащими митохондрии с неизмененным и измененным мембранным потенциалом, составило 2,6±0,3% для здоровых и 0,35±0,02% для больных. При вычислении показателя количества клеток с поврежденными митохондриями, соответственно популяциям, достоверные различия были получены между значениями для лимфоцитов и нейтрофилов (р=0,001). Они составили для здоровых 3,3 [2,5; 6,2] % и 8,2 [7,7; 10,1] % и для больных COVID-19 13,5 [5,75; 55] % и 37,1 [8,5; 52,8] % соответственно (рис.), тогда как для моноцитов эти различия были не достоверны (9,5 [6,1; 21,2] %; 14,6 [4,4;27,3] %, р>0.05).
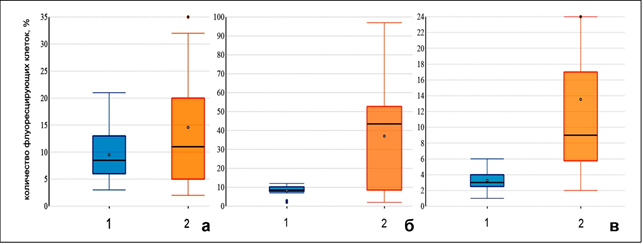 |
Решающее значение для разработки эффективных методов лечения имеет понимание фундаментальных процессов, лежащих в основе клинических проявлений и патогенеза инфекции COVID-19. Основные проблемы при изучении инфекции SARS-CoV-2 заключаются в выявлении гетерогенности вирусных штаммов и вероятных механизмов заражения тканей человека. В ранние сроки тяжелой пневмонии, вызванной SARS-CoV-2, отмечается массивная инфильтрация легких клетками врожденного иммунитета нейтрофилами и макрофагами. Нами отмечен низкий уровень ядросодержащих клеток в периферической крови и показана значимая связь (р=0.001) между пятью популяциями клеток лейкоцитарной формулы и наличием вирусной инфекции COVID-19 (табл.). Подобные данные были получены ранее другими исследователями [10-12]. Несмотря на то что содержание базофилов, эозинофилов и моноцитов значительно снижалось при относительно низких p-значениях (табл.), их количество, даже у здоровых людей, довольно небольшое и вариабельно независимо от патологической ситуации. Поэтому эти показатели могут не иметь клинического значения для диагностики COVID-19, а также не было обнаружено связи между количеством тромбоцитов и заболеванием. Значимо отличалось содержание в сыворотке крови С-реактивного белка у пациентов с обнаруженным SARS-CoV-2 и без него. Однако, несмотря на относительно высокое значение p, такое различие в лабораторных результатах анализа необходимо принимать во внимание с осторожностью, так как оно не всегда указывает на наличие вирусной инфекции COVID-19. Значительное снижение содержания нейтрофилов и моноцитов в крови пациентов демонстрирует важность этих клеток и их вероятный отток в место воспаления, где их активированное состояние может инициировать быстрый и интенсивный цитокиновый шторм, ведущий в конечном итоге к полиорганной недостаточности и смерти. Сопряженность указанных показателей со степенью тяжести течения вирусной инфекции COVID-19 была продемонстрирована с применением методов машинного обучения [1]. Таким образом, простой анализ крови может помочь в выявлении ложноположительных/отрицательных результатов ПЦР и использоваться там, где нет финансовой возможности постановки этой реакции и/или наличия специализированных лабораторий.
Показано, что вирусы при прогрессировании инфекции способны на различных уровнях изменять динамику митохондрий клеток [7]. Так, они оказывают повреждающее действие на ДНК митохондрий, на реализацию в них метаболических путей и гомеостаз кальция, изменяют потенциал мембран, влияют на количество и распределение этих органелл в клетках, что в конечном итоге нарушает антиоксидантную защиту организма. Указывается влияние митохондриальной дисфункции клеток на запуск цитокинового шторма, связанного с симптомами, приводящими к коллапсу легких и смерти пациентов с COVID-19 [13]. Также наличие дисфункциональных митохондрий связано с дефектным иммунологическим ответом на вирусные инфекции и хроническое воспаление. Нами показано, что достоверное (p<0,01) наибольшее количество с поврежденными митохондриями отмечается у пациентов с COVID-19 в отношении нейтрофилов. Возрастание наработки внутри- и внеклеточных прооксидантов и ингибирования системы регенерации восстановительного потенциала в нейтрофилах является признаком окислительного дисбаланса эффекторных клеток острого воспаления, развивающегося в дебюте вирусной пневмонии, что усугубляет течение болезни [13]. Выраженная митохондриальная дисфункция, обнаруженная у пациентов с COVID-19, приводит к накоплению активных форм кислорода и/или азота. Нарушение окислительно-восстановительного дисбаланса вследствие митохондриальной дисфункции оказывает влияние на прогрессирование инфекции COVID-19. Противовирусная терапия, которая может остановить проникновение вируса в клетки или ингибировать дальнейшее инфицирование, может быть дополнена такими стратегиями, как усиление антиоксидантной защиты и улучшение функций митохондрий, что может не только предотвратить вирусную инфекции, но и оказать влияние на негативные последствия заболевания.



