Болезнь Крона (БК) – хроническое рецидивирующее воспалительное заболевание, потенциально поражающее любую область желудочно-кишечного тракта трансмуральным путем [1]. Типичные симптомы включают боль в животе, диарею, кишечное кровотечение и потерю веса. Возможные осложнения БК включают кишечную непроходимость и перфорацию тонкого или толстого кишечника, абсцессы, свищи и кишечное кровотечение. Кроме того, от 6% до 40% пациентов испытывают внекишечные симптомы, включая артрит, кожные проявления, ириты, склерозирующий холангит [2].
Патофизиология БК еще не полностью выяснена, однако, вероятно, имеет место взаимодействие между генетическими факторами и факторами окружающей среды. Гены, связанные с БК, играют роль во врожденном иммунитете, гомеостазе и целостности эпителиального барьера, дифференцировке лимфоцитов и аутофагии [3].
БК, вероятно, представляет собой усиленный иммунный ответ от презентации антигена с повышенным ответом клеток Т-хелперов (Th1) и цитокинов, таких как интрелейкин 12 (IL-12) и фактор некроза опухоли альфа (ФНО) [4].
Патофизиология болезни Крона сложна и до конца не изучена. Однако известно, что существует генетический компонент. Также имеются доказательства сильного влияния эпигенетических факторов и факторов окружающей среды, причем употребление табака является наиболее изученным экологическим фактором, показывающим, что раннее начало употребления табака увеличивает риск развития БК.
Заболевание часто возникает после эпизода инфекционного гастроэнтерита, что позволяет предположить, что измененная микробиота кишечника может быть фактором патогенеза БК. Считается, что измененные отношения между микрофлорой кишечника и иммунной системой человека играют основную роль при БК. Одним из ключевых потенциальных механизмов, с помощью которого, как считается, эти измененные отношения опосредуют развитие БК, служит повышенная проницаемость между эпителиальными клетками, выстилающими кишечный барьер. Повышенная проницаемость позволяет увеличить приток кишечных антигенов к собственной пластинке, вызывая усиленную иммунную реакцию. Исследования in vitro и на животных связывают увеличение проницаемости для Т-клеток, фактора некроза опухоли альфа (TNF-α) и интерферона-γ.
На фоне данной информации актуальным видится применение в клинической практике тестов, позволяющих дифференцировать неспецифические воспалительные заболевания кишечника, язвенный колит и истинную БК, например иммуноглобулинов классов G и А к Saccharomyces cereviae в сыворотке крови, получающих все более широкое распространение в рутинной клинической практике под тестами ASCA.
Терапия БК включает противовоспалительные препараты салазопиридинового ряда, иммунодепрессанты небиологического и биологического классов, малые молекулы, ингибирующие янус-киназы и кортикостероиды. При этом путь современной терапии БК позволяет использовать тактике селективно-топические глюкокортикостероиды, как будесонид, что значимо уменьшает риски системных нежелательных явлений на фоне их применения.
В настоящее время имеется несколько стратегий терапии первой линии БК – кортикостероиды, азатиоприн, циклоспорин, 6-меркаптопурин и метотрексат. Если пациенты не реагируют на эти стандартные методы лечения или если они теряют ответ, назначают «биологические» препараты.
К сожалению, сегодня мы не имеем универсальных комбинаций или универсального препарата для лечения всех пациентов с БК, и нередко пациент не отвечает или теряет ответ на эти препараты первой линии, поэтому все чаще и чаще для лечения БК рассматриваются биологические методы лечения, такие как антагонисты TNF-α, включая инфликсимаб, цертолизумаб пегол и адалимумаб.
Использование адалимумаба и инфликсимаба в качестве биологических препаратов первой линии при ВЗК широко распространено. Лишь несколько процентов пациентов принимали голимумаб, ведолизумаб или устекинумаб в качестве первого биологического препарата.
Известно несколько опций при использовании биологических препаратов, однако ключевым медиатором для воздействия остается ФНО [5]. ФНО играет важную роль в каскаде цитокинов, которые приводят к миграции нейтрофилов, пролиферации Т-клеток, активации макрофагов и выживанию иммунных клеток [6]. Пациенты с БК имеют более высокие концентрации ФНО в слизистой оболочке кишечника, а также сниженный апоптоз в воспаленной ткани. Было продемонстрировано, что блокаторы ФНО, такие как адалимумаб, уменьшают количество кишечных Т-клеток и моноцитов у пациентов с БК [7, 8].
Адалимумаб – полностью человеческое моноклональное антитело, блокирующее ФНО, исследовалось в долгосрочных рандомизированных клинических исследованиях у пациентов с воспалительными заболеваниями кишечника [9]. Также сегодня мы имеем множество данных о первичной эффективности адалимумаба у пациентов, у которых ранее показали свою неэффективность другие иммуносупрессоры [10].
Для показания БК доза для взрослых составляет 160 мг для индукции ремиссии, далее через 2 недели подкожно вводится 80 мг, еще через 2 недели вводится 40 мг, введения продолжаются подкожно каждые 2 недели.
Цель: изучить влияние адалимумаба на эндоскопические, клинические и лабораторные проявления БК у пациентов, ранее не ответивших на азатиоприн.
Материалы и методы исследования
В исследование включено 19 пациентов c верифицированным диагнозом БК. Диагноз был выставлен клинически, а также подтвержден результатами эндоскопического и гистологического исследования с использованием индекса SES-CD и тестом определения иммуноглобулинов классов G и А к Saccharomyces cereviae, называемое ASCA в крови. На сегодняшний день в литературе широко представлена диагностическая значимость теста и иммуноглобулинов классов G и А к Saccharomyces cereviae при дифференциальной диагностике БК и язвенного колита. Так, по данным литературы, более 80% пациентов с болезнью Крона положительны на любой IgA или IgG. При язвенном колите менее 15% положительны на IgG и менее 2% положительны на IgA. В группе контроля не было антител IgA или IgG к S. cerevisiae [11]. Все пациенты были рандомизированы в группу адалимумаба или в группу контроля в зависимости от получаемой в рутинной клинической практике терапии. В группу адалимумаба включены 19 пациентов, в группу контроля – 26. Пациенты не отличались по демографическим и клиническим параметрам на момент включения. Все пациенты принимали месалазин (группа контроля) или месалазин и адалимумаб (группа адалимумаба). Клинико-демографические параметры пациентов приведены в таблице 1.
Таблица 1
Дизайн исследования
|
Характеристика/группа |
Группа адалимумаба (n=19) |
Группа контроля (n=26) |
|
Тяжесть заболевания (CDAI) [12] |
|
|
|
Умеренная активность |
n=6
|
n=8
|
|
Тяжелая степень активности |
n=13 |
n=18 |
|
Распространенность поражения: |
|
|
|
Илеит |
n=1 |
n=1 |
|
Илеоколит |
n=15 |
n=19 |
|
Панколит |
n=3 |
n=6 |
|
Внекишечные проявления: |
|
|
|
Артриты |
n=1 |
n=2 |
|
Артралгии |
n=11 |
n=14 |
|
Узловатая эритема |
n=3 |
n=2 |
|
Анемия |
n=17 |
n=21 |
|
Стоматит |
n=4 |
n=5 |
|
Мужчины |
n=9 |
n=11 |
|
Женщины |
n=10 |
n=15 |
|
Средний возраст, лет |
23,62±8,22 |
22,15±6,89 |
|
Длительность заболевания, лет |
2,11±0,55 |
1,82±1,12 |
|
Исходный индекс SES-CD |
12±4 |
14±3 |
Методы исследования: расчет эндоскопической шкалы SES-CD, клинического индекса CDAI и оценка фекального кальпротектина в кале и С-реактивного белка и ASCA в сыворотке крови.
Оценивали стандартное отклонение среднего и среднее. Качественные показатели оценивались в процентах с применением доверительного интервала, равного 95%. В качестве программы для обработки данных использовалась программа STATISTICA 9.0.
Результаты исследования и их обсуждение. Клиническое улучшение по индексу CDAI (менее 220) в группе адалимумаба наблюдалось уже на 2-й неделе лечения и получено у 16 (80%) больных, у 3 (20%) – после второго введения (CDAI менее 195), к концу 4-й недели лечения (менее 170) и сохранялось к 12-й неделе терапии (CDAI менее170).
Таким образом, положительный клинический ответ, характеризующийся уменьшением индекса CDAI, был получен у 100% пациентов через 4 недели от начала терапии (рис. 1). Данные изменения стали статистически значимы в группе адалимумаба к 4-й неделе и сохранялись к 12-й
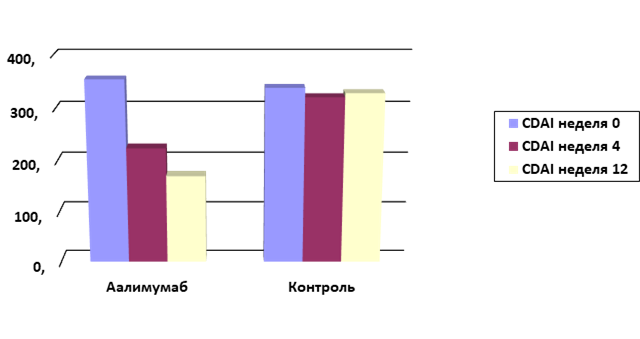
неделе терапии (p=0,002 и p=0,001 соответственно).
Рис. 1. Индекс клинической активности БК на фоне применения адалимумаба в течение 12 недель
Индекс эндоскопической активности SES-CD оценивался исходно и на 12-й неделе терапии адалимумабом. Полученные данные снижения активности индекса SES-CD имели статистически значимые различия (p=0,004). Данные отражены на рисунке 2.
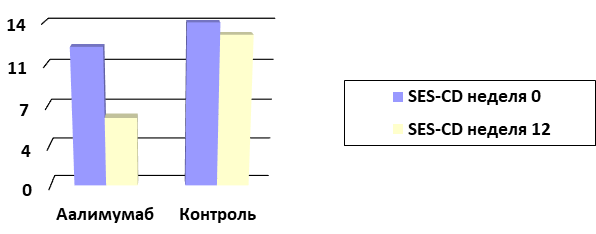
Рис. 2. Индекс эндоскопической активности БК на фоне применения адалимумаба в течение 12 недель
Кроме того, в группе адалимумаба показано статистически значимое снижение уровня фекального кальпротектина и С-реактивного белка (табл. 2). При сравнении титров иммуноглобулинов классов G и А к S. Cerevisiae различий не выявлено. Около 90% всех пациентов в данном исследовании имели положительные результаты на IgA и IgG к S. cerevisiae.
Таблица 2
Лабораторные данные в двух исследуемых группах через 12 недель терапии
|
Параметр |
Группа адалимумаба |
Группа контроля |
Статистическая разница, р |
|
Кальпротектин фекальный |
75,25±16,85 |
352,56±154,25 |
0,001 |
|
С-реактивный белок, мг/дл |
16,51±9,16 |
42,84±8,11 |
0,001 |
|
ASCA, U/ml |
25,51±9,16 |
22,11±5,00 |
0,061 |
Вывод
Таким образом, на фоне введения адалимумаба у пациентов с БК к 12-й неделе терапии наблюдается статистически значимое снижение индекса клинической активности и эндоскопической картины заболевания, лабораторных данных, снижение фекального кальпротектина и С-реактивного белка.
При этом титры ASCA не изменились в процессе наблюдения за обеими группами пациентов.
У всех пациентов клиническая ремиссия была отмечена за период наблюдения в группе адалимумаба.



