Проблема выбора средств и способов местного санационного воздействия сохраняет свою исключительную актуальность в условиях инфицированного панкреонекроза в связи со сложностью радикального оперативного контроля источника системного воспаления и высоким уровнем антибактериальной резистентности этиологически значимых микробных агентов [1, 2]. В зарубежной литературе последних лет присутствуют обнадеживающие сведения об эффективности применения антисептических растворов при выполнении малоинвазивных санационно-дренирующих вмешательств у пациентов с гнойными осложнениями острого панкреатита [3]. Вместе с тем существенным фактором, препятствующим реализации как системного антибактериального, так и локального антисептического эффекта, является высокая способность ассоциантов инфицированного панкреонекроза к формированию бактериальных сообществ – биопленок [4]. В составе последних микроорганизмы не только механически надежно защищены от внешних воздействий биополимерным матриксом, но и способны изменять уровень метаболической и пролиферативной активности, мутировать, экспрессировать гены лекарственной устойчивости, т.е. эффективно противостоять как факторам иммунной защиты макроорганизма, так и действию антимикробных средств [5].
Бактерицидный эффект медицинского озона широко применяется в комплексном лечении разных форм хирургических инфекций [6, 7]. В последнее десятилетие интерес к его использованию возрос в связи с разработкой оборудования, позволяющего использовать локально направленный поток озоно-кислородной газовой смеси (ОКГС) без опасности превышения предельно допустимых концентраций действующего вещества во внешней среде [8]. При этом принципиальными преимуществами использования ОКГС по сравнению с раствором являются отсутствие создаваемого поверхностного натяжения на полимерном матриксе микробных биопленок, большая проникающая способность вещества в газовой фазе, а также возможность использования высоких концентраций, не ограниченных пределом растворимости и скоростью распада в растворе [9, 10].
Цель исследования – оценить системные уровни продукции про- и противоспалительных цитокинов на фоне местного применения озоно-кислородной смеси в лечении экспериментального инфицированного панкреонекроза (ЭИП).
Материал и методы исследования. Проспективное экспериментальное исследование выполнено на 43 лабораторных животных – кроликах породы Советская шиншилла в условиях вивария ФГБОУ ВО КрасГМУ имени профессора В.Ф. Войно-Ясенецкого Минздрава России с соблюдением Правил надлежащей лабораторной практики Евразийского экономического союза, утвержденных Решением Совета Евразийской экономической комиссии № 81 от 03.11.2016 г. План эксперимента одобрен биоэтической комиссией при локальном этическом комитете ФГБОУ ВО КрасГМУ имени профессора В.Ф. Войно-Ясенецкого Минздрава России (протокол № 26-19 от 23.04.2019 г.).
В исследование включались самцы в возрасте от 4 до 6 месяцев с массой тела от 2800 до 4000 г после периодов карантина и адаптации. Животные содержались в отдельных клетках при постоянной температуре внешней среды 20–22°C, влажности 60–70% с естественным циклом освещения, получали стандартный корм и воду ad libitum в соответствии с требованиями ГОСТ 33216-2014 «Руководство по содержанию и уходу залабораторными животными. Правила содержания иухода залабораторными грызунами икроликами». За 12 часов до операции доступ к пище исключали.
За 30 минут до введения в наркоз всем особям вводили подкожно раствор атропина сульфата (0,1 мг/кг), внутримышечно – раствор ксилазина (4 мг/кг). Для общей анестезии использовали раствор натрия тиопентала (20 мг/кг, внутрибрюшинно) и ксилазина (10 мг/кг, внутримышечно). Все животные были распределены в четыре группы с разным объемом вмешательств.
В группе 1 (13 особей), а также группах 2 и 3 (по 12 особей) моделировали ЭИП по оригинальной методике [11]. Для этого после срединной лапаротомии осуществляли пункцию желчного пузыря с забором пузырной желчи и последующим ушиванием пункционного отверстия. Создавали гипертензию в панкреатическом протоке путем его прошивания и перевязки в брыжейке у места впадения в двенадцатиперстную кишку, после чего пункционно ретроградно интрадуктально вводили последовательно 1 мл пузырной желчи и 1 мл микробной взвеси, содержащей 108 колониеобразующих единиц панрезистентного клинического штамма A.baumannii. Операцию завершали непрерывным ушиванием брюшной стенки без оставления дренажей.
Спустя 24 часа после моделирования ЭИП всем животным под наркозом осуществляли первую санационную релапаротомию, во время которой асептически эвакуировали перитонеальный экссудат, после чего брюшную полость на 3 минуты заполняли 0,9%-ным раствором натрия хлорида в объеме 400 мл, затем раствор аспирировали. В группе 1 такую процедуру осуществляли дважды, после чего брюшную стенку ушивали непрерывным швом (рис.). У особей группы 2 после однократной санации физиологическим раствором натрия хлорида брюшную полость еще на 3 минуты заполняли 0,02%-ным водным раствором хлоргексидина биглюконата в количестве 400 мл, затем раствор аспирировали. У животных группы 3 в интервале между двумя промываниями брюшной полости физиологическим раствором выполняли локальную обработку макроскопически измененных участков поджелудочной железы ОКГС с концентрацией озона 40 мг/л, скоростью направленного потока 2 л/мин, временем воздействия 30 сек./8 см2 поверхности с помощью оригинального устройства [8].
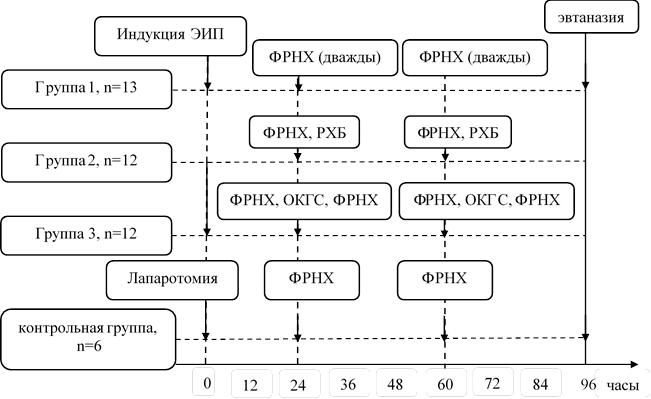
Дизайн экспериментального исследования. ЭИП – экспериментальный инфицированный панкреонекроз, ФРНХ – физиологический раствор натрия хлорида, РХБ – раствор хлоргексидина биглюконата, ОКГС – озоно-кислородная газовая смесь
Антибактериальной терапии животные не получали. С целью регидратации в интервалах между операциями всем особям вводили физиологический раствор натрия хлорида подкожно в количестве 30 мл/кг в сутки. Спустя 36 часов после первой релапаротомии (60 часов с момента моделирования ЭИП) выжившим животным выполняли вторую санационную операцию с аналогичным объемом мероприятий (рис.).
Контрольная группа включала шесть ложнооперированных особей, перенесших только лапаротомию, ревизию органов и непрерывное ушивание брюшной стенки без моделирования ЭИП. Через 24 и 60 часов после лапаротомии в этой группе осуществляли повторные вмешательства, во время каждого из которых брюшную полость двукратно заполняли физиологическим раствором в объеме и с кратностью, аналогичными использовавшимся в группе 1 (рис.).
Наблюдение за всеми животными продолжали в течение 4 суток с момента выполнения первой операции. По истечении этого периода под наркозом выполняли третью релапаторомию, трансдиафрагмальный доступ в левую плевральную полость с забором артериальной крови из полости левого желудочка и последующим выведением животных из эксперимента путем передозировки натрия тиопентала.
Лабораторно у всех особей в артериальной крови оценивали активность α-амилазы, содержание лейкоцитов, глюкозы, уровни экспрессии интерлейкинов (ИЛ)-6, -8, -10 и фактора некроза опухоли (ФНО)-α. Количество глюкозы в сыворотке крови исследовали колориметрически, активность α-амилазы – с помощью ферментативного фотометрического теста (детекция хлорнитрофенола при длине волны 405 нм) с набором реагентов α-Amylase Assay Kit (Бейджинг Лидман БиокемистриКо Лтд, Китай). Иммуноферментный анализ экспрессии цитокинов осуществляли согласно инструкциям наборов реактивов Rabbit IL-6, Rabbit IL-8, Rabbit IL-10, Rabbit TNF-α (Элабсайнс, США).
Для статистической обработки результатов исследования использовали программу SPSS-22.0 (IBM, США). Для оценки значимости различий частоты встречаемости качественных признаков, выраженной в долях процентов, использовали непараметрический критерий Пирсона χ2 с поправкой на непрерывность, при наличии хотя бы одного ожидаемого значения менее 5 – двусторонний точный критерий Фишера. Абсолютные величины представлены в виде медианы и интерквартильного диапазона (Р25; Р75). После проведения множественного сравнения с использованием непараметрического критерия Крускала–Уоллиса данные независимых групп подвергали парному сравнению по критерию Манна–Уитни, данные связанных групп оценивали с помощью рангового критерия Уилкоксона. Различия принимали статистически значимыми при р<0,05. При множественном сравнении с учетом поправки Бонферрони для трех групп критический уровень значимости принимали равным 0,017.
Результаты исследования и их обсуждение. Во время первой релапаротомии в брюшной полости всех животных с моделью ЭИП определялись серозно-геморрагический экссудат, множественные очаги стеатонекрозов, геморрагии на париетальной и висцеральной брюшине. Поджелудочная железа слабо дифференцировалась на фоне брыжейки двенадцатиперстной кишки, представляя собой протяженные сливающиеся участки некрозов серого или белесоватого цвета.
В интервале времени между двумя программными операциями (в сроки от 24 до 60 часов) погибли 3 особи группы 1 (23,1%) и 2 – группы 2 (16,7%, р=1,000). Вторая санация выполнена 20 выжившим животным групп 1 и 2, а также всем животным группы 3 и контрольной группы. До окончания запланированного периода наблюдения погибли еще 3 кролика группы 1 (23,1%), 4 – группы 2 (33,3%) и 2 – группы 3 (16,7%, р>0,05). Суммарная летальность за весь 96-часовой период составила в исследуемых группах в среднем 37,8%, в том числе 46,2% (6 особей) в группе 1, 50,0% (6 особей) – в группе 2 и 16,7% (2 особи) – в группе 3 (р>0,05). Все животные контрольной группы выведены из эксперимента в запланированные сроки – по истечении 4 суток с момента выполнения первой лапаротомии.
При лабораторном исследовании у всех животных с моделью ЭИП выявлялся лейкоцитоз. Несмотря на обязательный предоперационный период ограничения доступа животных к пище, уровень гликемии в группах 1–3 превышал аналогичное значение контрольной группы в 2,0–2,6 раза (р<0,001, табл. 1).
Таблица 1
Системное содержание лейкоцитов, глюкозы, активность α-амилазы в крови животных через 96 часов эксперимента
|
№ группы |
Лабораторный показатель, единицы измерения |
||
|
Лейкоциты ×109/л |
Глюкоза, ммоль/л |
α-амилаза, МЕ/л |
|
|
1 (n=7) |
16,3 (12,5; 19,2) 1 |
9,3 (6,5; 10,4) 1 |
4359,7 (3326,3; 4925,1) 1 |
|
2 (n=6) |
18,1 (13,6; 20,3) 1 |
7,3 (6,4; 9,2) 1 |
3971,5 (3248,7; 4992,4) 1 |
|
3 (n=10) |
15,8 (11,5; 18,7) 1 |
7,8 (5,9; 9,1) 1 |
4714,6 (3635,7; 5342,6) 1 |
|
Контрольная (n=6) |
6,9 (4,5; 9,2) |
3,6 (2,8; 4,4) |
639,6 (554,1; 714,7) |
|
Примечания: n – число животных в группе к окончанию эксперимента (96 часов с момента выполнения первой операции); МЕ – международные единицы, 1 – р<0,001 при сравнении с результатом контрольной группы согласно критерию Манна–Уитни |
|||
Активность α-амилазы через 96 часов после моделирования ЭИП в 6,2–7,4 раза превосходила аналогичное значение группы ложнооперированных особей (р<0,001, табл. 1). Вместе с тем значимых отличий вышеуказанных показателей в группах с разным объемом интраоперационной санации брюшной полости по поводу ЭИП к окончанию четвертых суток эксперимента выявлено не было. Результаты рутинного лабораторного исследования у особей групп 1–3 соответствовали объективным проявлениям синдрома системной воспалительной реакции на фоне тяжелого острого панкреатита.
Через 96 часов после индукции ЭИП у лабораторных животных отмечалась системная гиперэкспрессия провоспалительных цитокинов: ИЛ-6, 8, а также ФНО-α (табл. 2). Наибольшее увеличение продукции ИЛ-6 по отношению к значению группы контроля имело место в группе 1 (в 6,3 раза), наименьшее – в группе 3 (в 3,0 раза, р<0,005 при попарном сравнении с показателями групп 1, 2 и контрольной).
Таблица 2
Системное содержание цитокинов в крови животных через 96 часов эксперимента
|
Группа |
Цитокин, нг/л |
|||
|
ИЛ-6 |
ИЛ-8 |
ИЛ-10 |
ФНО-α |
|
|
1 (n=7) |
215,0 (172,1; 283,5) 1, 3 |
151,9 (97,1; 183,1) 1, 2 |
53,1 (42,7; 64,0) 1 |
192,4 (163,1; 283,8) 1 |
|
2 (n=6) |
191,4 (161,2; 256,9) 1, 3 |
242,0 (173,6; 302,2) 1, 3 |
64,9 (49,4; 73,9) 1 |
232,8 (174,8; 305,3) 1 |
|
3 (n=10) |
103,5 (66,0; 148,9) 1 |
138,2 (86,1; 171,5) 1 |
55,1 (41,6; 66,9) 1 |
221,4 (174,3; 273,2) 1 |
|
КГ (n=6) |
34,2 (18,6; 49,1) |
66,4 (49,2; 83,5) |
27,5 (19,9; 36,1) |
75,3 (51,4; 97,2) |
|
Примечания: n – число животных в группе к окончанию эксперимента (96 часов с момента выполнения первой операции); КГ – контрольная группа; 1, 2, 3 – р<0,005 при сравнении с результатом контрольной, групп 2 и 3 соответственно согласно критерию Манна–Уитни |
||||
Максимальный уровень продукции ИЛ-8 отмечен у особей группы 2 (242,0 (173,6; 302,2) нг/л). Этот показатель превышал значение группы ложнооперированных животных в 3,6 раза (р<0,001), групп 1 и 3 – более чем в 1,6 раза (р<0,005, табл. 2). По результатам предшествующих исследований in vitro водный раствор хлоргексидина не обладал достаточным бактерицидным эффектом в отношении клинических штаммов вирулентных микроорганизмов в составе биопленок [12]. Риски использования малоэффективных антисептических растворов или их субингибирующих концентраций связаны с созданием неблагоприятных, но не лимитирующих условий для микроорганизмов, стимуляцией к продукции факторов вирулентности и персистенции, в том числе пленкообразованию [13], что косвенно подтверждается результатами проведенного исследования.
Системное содержание ФНО-α у особей с ЭИП превышало аналогичный показатель группы контроля в 2,6–3,1 раза (р<0,001), при этом значимых межгрупповых различий продукции ФНО-α у животных с разным объемом интраоперационной санации брюшной полости не выявлено (табл. 2). Системная концентрация ИЛ-10 у животных с моделью ЭИП превышала значение группы ложнооперированных особей более чем в 1,9 раза (р<0,005, табл.2). Наибольшая продукция противовоспалительного ИЛ-10 зафиксирована в группе 2, однако различия с показателями групп 1 и 3 не достигали границ статистической значимости.
Минимальное значение интегрального провоспалительного индекса, определяемого как частное от деления суммы концентраций провоспалительных ИЛ-6, -8 и ФНО-α на концентрацию противоспалительного ИЛ-10, отмечено в группах 3 и контрольной (различия статистически значимы при попарном сравнении с показателями групп 1 и 2, р≤005).
B. Uysal и соавторы (2010) впервые представили возможности и преимущества интраперитонеального применения газообразного озона перед гипербарической оксигенацией в уменьшении тяжести экспериментального острого панкреатита, сокращении летальности и частоты инфекционных осложнений у лабораторных животных [14]. В последующем Y. Oztas и соавторы (2011) подтвердили эффективность внутрибрюшного введения газообразного озона в качестве монотерапии экспериментального асептического панкреонекроза, предупреждающего процессы бактериальной транслокации и уменьшающего степень повреждения железы, в отличие от варианта комбинированного лечения [15]. Согласно результатам D. Siniscalco и соавторов (2018), ОКГС предотвращала клеточную гибель панкреатоцитов в условиях стретозотоцин-индуцированного повреждения in vivo посредством увеличения экспрессии ядерного фактора-2, связанного с эритроидом-2 (Nrf2), повышения активности эндогенной глутатион-S-трансферазы и уменьшения продукции 4-гидроксиноненала и поли(АДФ-рибоза)-полимеразы-1 (PARP-1) [16].
Нами впервые изучены системные уровни продукции про- и противовоспалительных цитокинов на фоне местного применения ОКГС в лечении ЭИП. Согласно результатам иммуноферментного анализа артериальной крови, внутрибрюшинное применение направленного потока газообразного озона через 24 и 60 часов после индукции ЭИП позволило к исходу четвертых суток значимо уменьшить уровень системной экспрессии ИЛ-6, а также интегральный провоспалительный индекс по сравнению с использованием водных растворов натрия хлорида и хлоргексидина биглюконата.
Заключение. Локальная обработка поджелудочной железы направленным потоком ОКГС через 24 и 60 часов после индукции ЭИП позволила к исходу четвертых суток достоверно уменьшить уровень системной экспрессии ИЛ-6, а также интегральный провоспалительный индекс по сравнению с использованием водных растворов натрия хлорида (0,9%) и хлоргексидина биглюконата (0,02%).



