В настоящее время проблема ракового перерождения и борьбы с онкологическими заболеваниями остаётся актуальной. Она активно изучается в исследованиях в области медицины и фармакологии с целью поиска новых противораковых препаратов. Удобной моделью для таких исследований является культура клеток. Она позволяет проводить прижизненный анализ действия различных веществ и возможность проведения биохимических исследований [1; 2].
Астаксантин относится к классу провитаминных каротиноидов группы ксантофиллов - кислородсодержащих пигментов, обнаружен у многих морских животных. Он обладает широким спектром биологической активности, включая антиоксидантную и противоопухолевую. Впервые астаксантин был выделен в 1938 году из омаров. Он обладает высокой антиоксидантной активностью благодаря своей химической структуре. Астаксантин имеет два дополнительных атома кислорода, которые способны нейтрализовать свободные радикалы. Благодаря наличию хромофорных групп астаксантин имеет насыщенную красную окраску. Астаксантин может находиться как снаружи, так и внутри мембраны клетки, тем самым связывая наружную и внутреннюю клеточные мембраны. Он защищает мембраны клетки и внутриклеточных структур от окислительных повреждений, обладает нейропротекторным действием, что позволяет считать его эффективным средством при лечении ряда нейродегенеративных заболеваний [3-7].
РК11195 (карбоксиамид изохинолин) является синтетическим лигандом транслокаторного митохондриального белка TSPO. TSPO представляет собой митохондриальный белок, который находится на внешней стороне мембраны и отвечает за открывание митохондриальной поры (мРТР). Митохондрии, как известно, участвуют в регулировании основных клеточных функций, в том числе в пролиферации, трансформации и гибели клеток. Они играют важную роль в регуляции гибели клеток по типу апоптоза. Существует тесная корреляция между уровнем экспрессии TSPO и невропатологией. В раковых клетках уровень TSPO значительно повышен. Поэтому транслокаторный белок представляет собой мишень для лечения онкологических заболеваний. А лиганды, связывающие TSPO, обладают свойством терапевтической противоопухолевой защиты. Согласно данным литературы, РК11195 способен стимулировать митохондриальный путь апоптоза и повышать чувствительность опухолевых клеток к химиотерапевтическим препаратам за счет ингибирования активности Р-гликопротеина [8-10].
Одним из митохондриальных белков, которые контролируют пролиферацию и гибель клеток, является потенциал-зависимый анионный канала (VDAC). Из литературы известно, что во многих опухолевых клетках наблюдается высокий уровень экспрессии потенциал-зависимого анионного канала. VDAC играет важную опосредованную роль в процессах апоптоза. TSPO тесно связан с VDAC и считается его партнером [11-12].
Цель настоящей работы состояла в исследовании пролиферации и гибели клеток нейробластомы мыши N1E-115 (клон C-1300), под действием АСТ и РК11195 (лиганда TSPO), а также в изучении корреляции действия АСТ и РК11195 на изменение уровней белков, связанных с апоптозом, таких как Bcl-2, BAX и маркера ЭР (эндоплазматического ретикулума).
Материалы и методы исследования
Исследования проводили на культуре клеток нейробластомы мыши N1Е115 (клон С-1300), полученной из Российской коллекции клеточных культур (ИНЦ РАН, Санкт-Петербург). Клетки нейробластомы выращивали в среде DМЕМ (Sigma, США) в присутствии 10% эмбриональной сыворотки (Flow Laboratories, Великобритания), 40 мкг/мл гентамицина, при 37 °С, в атмосфере 5% СО2. Плотность посева во флаконах составляла 5х103 клеток /см2. В экспериментах в качестве контроля использовали среду DМЕМ без сыворотки. Исследуемые вещества добавляли в культуральную среду через сутки после посева клеток. Подсчет клеток производился методом прижизненного анализа с использованием микроскопа МБИ-13 (объектив ROW Rathenon 24/0.42, окуляр 7). Общее количество анализируемых клеток для каждого флакона составляло около одной тысячи. Анализ дифференцирующего воздействия проводился на основе изменения морфологии клеток. Критерием нейродифференцировки было появление клеток 2 типов: клетки обычных размеров (20-30 мкм) с длинными аксоноподобными отростками (вдвое больше диаметра клетки нейробластомы) или увеличенные по размерам клетки (до 50-70 мкм) с многочисленными отростками [6; 13]. Морфологический анализ клеток и микрофотографирование проводили с помощью микроскопической станции Ti-E (Nikon, Япония).
Клеточные лизаты готовили, как описано в [6; 13]. Электрофорез в денатурирующих условиях проводили в мини-камере (Hoefer) по методу Лэммли. На каждую дорожку геля наносили по 20 мкг клеточного лизата. В качестве маркеров использовали наборы фирмы Bio-Rad (США), содержащие маркерные белки от 10 до 250 кДа. Перенос белков из геля на нитроцеллюлозную мембрану (Bio-Rad, США, 0.2 мкм) осуществляли на аппарате для полусухого переноса (Bio-Rad), используя буфер для переноса (Bio-Rad) методом Вестерн-блот. Определение уровня TSPO, Bcl-2, BAX и маркера ЭР в клеточных лизатах проводили при помощи соответствующих антител.
Обработку результатов проведенных экспериментов проводили по t-критерию Стьюдента как среднее значение ± стандартное отклонение (±SD) после четырех повторов (n≥4). Статическую значимость (*) –р<0,05 определяли с использованием критерия Манна-Уитни.
Результаты исследования и их обсуждение
В наших экспериментах мы исследовали изменение пролиферации клеток нейробластомы мыши N1Е115 (клон С-1300) под влиянием астаксантина и РК11195 как в отдельности, так и при совместном действии.
 Рис. 1. Морфологический статус культуры нейробластомы мыши NIE-115 при инкубации с астаксантином (10-5М), РК11195 (10-5М) и их совместным действием через 24 и 72 часа культивирования. Буквами обозначены: П-пролиферирующие, Д-дифференцированные,
Рис. 1. Морфологический статус культуры нейробластомы мыши NIE-115 при инкубации с астаксантином (10-5М), РК11195 (10-5М) и их совместным действием через 24 и 72 часа культивирования. Буквами обозначены: П-пролиферирующие, Д-дифференцированные,
Г-гибнущие клетки
На рисунке 1 представлены фотографии изменения морфологии культивируемых клеток нейробластомы мыши при инкубации с астаксантином, РК11195 и их сочетанном действии через 24 и 72 часа культивирования. Показано, что добавление исследуемых веществ ведет к торможению пролиферации, индукции дифференцировки и частичной гибели клеток.
Мы исследовали влияние АСТ, РК11195 и их совместное действие на изменение экспрессии белков, связанных с апоптозом, таких как Bcl-2, BAX и маркер ЭР (эндоплазматический ретикулум) стресса Chop в клетках нейробластомы.
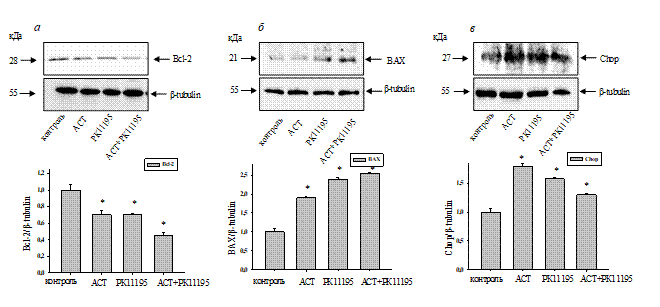
Рис. 2. Изменение уровня белков Bcl-2, BAX и Chop в лизатах клеток нейробластомы через 72 часа культивирования
На рисунке 2 (а-в, верхняя часть) показаны Вестерн-блоты, окрашенные соответствующими антителами к исследуемым белкам. β-тубулин использовали в качестве контроля белковой нагрузки. В нижней части рисунка показаны результаты иммуноокрашивания, полученные с помощью компьютерной денситометрии, представленные как отношение оптической плотности белков к оптической плотности β-тубулина. Мы наблюдали, что экспрессия Bcl-2 снижалась в клетках нейробластомы в присутствии АСТ, РК11195 и АСТ + РК11195 на ~ 30, 30 и 50% соответственно, тогда как экспрессия BAX в этих условиях увеличивалась на 100% по сравнению с контролем. Поскольку Bcl-2 считается антиапоптотическим белком, а BAX – проапоптотическим, снижение уровня первого и увеличение уровня второго говорит о вероятном запуске гибели клеток по типу апоптоза под действием исследуемых веществ. При этом совместное действие АСТ и РК11195 значительно усиливает данный процесс.
Апоптоз - это форма гибели клеток, с помощью которой организм поддерживает гомеостаз внутренней среды. Апоптоз - это инициативный процесс гибели клеток, который контролируется генами и в основном подразделяется на эндогенные пути (митохондриальный путь), экзогенные пути (путь рецептора смерти) и апоптотические пути, индуцируемые стрессом эндоплазматического ретикулума (ЭР). Дисбаланс гомеостаза в ЭР приводит к стрессу ЭР. При определенных условиях стресс ЭР может быть полезен для организма; однако, если гомеостаз белка ЭР не восстанавливается, длительная активация развернутого белкового ответа может инициировать апоптотическую гибель клеток через повышающую регуляцию гомологичного белка CHOP [14]. CHOP играет важную роль в ЭР-индуцированном стрессом апоптозе. Апоптоз, вызванный путём CHOP, становится объектом внимания всё большего числа исследователей.
Так как Chop опосредует апоптоз, мы проанализировали изменение экспрессии этого белка в наших условиях. АСТ повышал экспрессию Chop на 70%, РК11195 – на 50%, а при совместном их действии – на 30%. По-видимому, АСТ является более сильным стрессовым фактором для эндоплазматического ретикулума клеток. При совместном действии АСТ и РК11195 уровень экспрессии Chop был повышен значительно меньше. Это говорит о неоднозначной корреляции повышения уровня экспрессии Chop при одновременном действии исследуемых веществ. Роль Chop в ЭР стрессе до конца не выяснена.
Известно, что изменение путей аутофагии может повлиять на развитие раковых клеток и устойчивость к химиотерапии. АСТ способен модулировать аутофагию и проявлять защитный эффект при определенных условиях, усиливая или подавляя процесс аутофагии [15]. Мы проанализировали изменение содержания маркера аутофагии LC3a/b.
На рисунке 3 (а, б) показаны Вестерн-блоты изменения содержания маркеров аутофагии LC3a/b и количественный анализ изменения экспрессии белков BiP и PDI. GAPDH использовали в качестве контроля белковой нагрузки. Мы определили, что в присутствии АСТ, РК11195 и АСТ + РК11195 уровень LC3a/b-I повышался в 2.5 раза, на 35 и 20% соответственно по сравнению с контролем. Подобные эффекты мы наблюдали и с изменением содержания белка LC3a/b-II. Полученные результаты говорят, что АСТ является более сильным модулятором аутофагии. А в присутствии РК11195 значительно снижается уровень аутофагии, вызываемый АСТ.
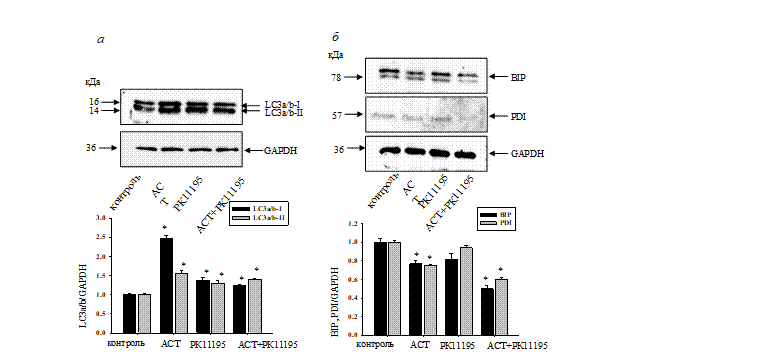
Рис. 3. а – Изменение содержания маркеров аутофагии LC3a/b-l и LC3a/b-ll; б – Изменение экспрессии белков BiP и PDI
Чтобы оценить влияние АСТ и РК11195 и их совместное действие на ЭР-стресс в клетках нейробластомы, было исследовано изменение экспрессии белков, связанных с ЭР-стрессом, таких как протеин-дисульфид-изомераза (PDI) и связывающий белок иммуноглобулина (BiP). Как видно из рисунка 3, АСТ снижал экспрессию BiP на 30%, в то время как РК11195 не оказывал влияния, однако при совместном действии АСТ и РК11195 уровень BiP снижался на 50% относительно контроля. Мы наблюдали схожие изменения и в экспрессии PDI. АСТ снижал уровень PDI на 25%, в присутствии РК11195, уровень PDI не отличался от контроля. При комбинированном действии АСТ и РК11195, экспрессия PDI снижалась на 40% относительно контроля. Присутствие РК11195 усиливало действие АСТ на изменение уровней экспрессии белков BiP и PDI, что является отражением снижения онкогенности клеток.
Так как уровень экспрессии транслокаторного белка (TSPO) тесно связан с уровнем экспрессии потенциал-зависимого анионного канала (VDAC) в опухолевых клетках, мы изучили изменение экспрессии TSPO и VDAC в присутствии АСТ и РК11195 (рис. 4).
Показано, что АСТ снижал уровень экспрессии VDAC на 20%, РК11195 не оказывал заметного влияния. При комбинированном действии АСТ и РК11195 экспрессия VDAC снижалась на 35% относительно контроля. Присутствие РК11195 значительно усиливало действие АСТ на уровень экспрессии VDAC. Уровень экспрессии TSPO под действием АСТ снижался на 50%, тогда как действие РК11195 повышало уровень экспрессии TSPO в два раза. При совместном действии АСТ и РК11195 экспрессия TSPO снижалась на 45%. Данные результаты говорят о неоднозначном действии веществ в различных комбинациях. При этом при совместном действии наблюдается общая тенденция снижения уровней экспрессии VDAC и TSPO, что отражает снижение онкогенности клеток в культуре.
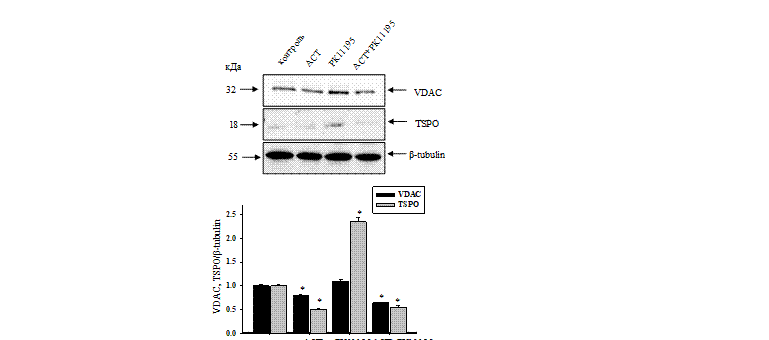
Рис. 4. Изменение уровней VDAC и TSPO в лизатах клеток нейробластеры через 72 часа культивирования
Заключение
Таким образом, АСТ и РК11115 способны подавлять пролиферацию, вызывать дифференцировку и активацию сигнального пути апоптоза. Это показано в изменении экспрессии TSPO, VDAC и белков, связанных с апоптозом (Bcl-2, BAX и Chop). Совместное действие АСТ и РК11115 значительно усиливает торможение пролиферации, с последующей индукцией дифференцировки и запуском программируемой гибели клеток нейробластомы мыши N1E-115. Полученные результаты дают возможность рекомендовать использование АСТ и РК11115 и их сочетание при разработке препаратов противоопухолевого действия.
Работа выполнена при поддержке РФФИ №№ 20-04-00131, 20-015-00072, гос. задание №№ 075-01027-22-00, 075-01512-22-00. В настоящей работе были использованы приборы ЦКП ИТЭБ РАН.



