Доля районов Севера в Российский Федерации составляет 70%, там проживают 11,7 млн человек [1]. В условиях Севера воздействие холода является мощным стрессорным фактором, он служит пусковым механизмом в развитии изменений метаболических процессов во всем организме, в том числе и в сердечной мышце [2]. В то же время активная индустриализация арктической зоны способствует активному изучению механизмов адаптации человека к холодовому фактору [3].
В основе приспособления человека к условиям внешней среды лежат физиологические, биохимические и социально-бытовые механизмы адаптации [4]. Скорость, темп и характер адаптивных реакций во многом зависят от состояния организма человека [5].
Воздействию на организм человека низких температур на современном этапе уделяется большое внимание [6], но данные исследования в большей мере посвящены изучению вопросов танатогенеза сочетанной патологии, когда выявляется действие на организм не только низкой температуры, но и действие иных физических и химических факторов (травм, отравлений) и соматическая патология.
Важнейшим методом оценки воздействия холодового фактора на организм человека является морфологический метод [7, 8]. На данный момент изученные и представленные морфофункциональные изменения, возникающие при холодовой травме, достаточно скудны, а большинство из них можно отнести к неспецифичным, встречающимся при смерти от разных причин, а, следовательно, их анализ в полной мере является весьма ограниченным. Серьезной проблемой представляется проведение дифференциальной диагностики, когда выявленные морфологические признаки не являются специфичными и могут встречаться и при других патологиях [9, 10].
Заслуживают внимания работы, посвященные структурным изменениям ядерного аппарата клеточных элементов и морфофункциональным изменениям тучноклеточной популяции при гипотермии [11]. Данные исследования доказывают отрицательное влияние низких температур на структуру ядра и тучные клетки, а морфологические параметры, полученные при исследовании, могут быть использованы как специфические и адаптивные.
В литературе имеется небольшое количество работ, посвященных морфологии миокарда при гипотермии [12, 13, 14]. Поэтому исследование морфологических изменений миокарда при гипотермии актуально.
Цель исследования: изучить особенности структурно-морфофункциональной реорганизации кардиомиоцитов экспериментальных животных после воздействия глубокой однократной водной гипотермии.
Материалы и методы исследования
Для исследования были использованы 20 половозрелых крыс линии Wistar мужского пола. Средняя масса особи составила 200–250 г. Холодовой стресс моделировался в экспериментальных условиях путем помещения животных (15 особей) в отдельных клетках в емкости с водой на глубину 5 см. Средняя температура воды составляла +5,0°С, температура окружающего воздуха была +7,0°С. Время проведения эксперимента в среднем составляло 40±8 минут. Основным признаком достижения глубокой степени гипотермии являлось понижение ректальной температуры до +20... +23°С. Контрольную группу составляли 5 животных, которых помещали в воду температурой +30оС на время нахождения в воде опытной группы.
Использование экспериментальных животных осуществлялось в соответствии с Европейской конвенцией по охране позвоночных животных, используемых в эксперименте, и директивами -86/609/EEC. В целях гуманности и устранения влияния стресса на результаты исследования умерщвление и обезболивание проводили в соответствии с «Правилами проведения работ с использованием экспериментальных животных».
Выведение животных из эксперимента происходило сразу после гипотермии, а также на 2-й, 7-й и 14-й день после эксперимента методом декапитации под действием эфирного наркоза. Извлечение внутренних органов осуществлялось единым органокомплексом. Для проведения дальнейших гистологических исследований забирались фрагменты ткани сердца размером 0,5 х 0,5 см. Фрагменты фиксировали в 10%-ном растворе нейтрального формалина в течение 24–48 часов. В дальнейшем фрагменты обрабатывали в автомате с последующей заливкой в парафин в станции парафиновой заливки. На роторном микротоме изготавливали срезы толщиной 5–7 мкм. Окраска препаратов осуществлялась гематоксилин-эозином и с целью выявления ишемического повреждения миокарда гематоксилином – основным фуксином – пикроновой кислотой (ГОФП) (по J.T. Lie et al., 1971) [15]. Препараты изучали и фотографировали при помощи медико-биологического микроскопа Nikon Eclipse E200 с камерой цифровой специализированной DS 1000 при увеличении х400. При проведении морфометрического анализа кардиомиоцитов использовалась программа «Image Tool 3.0.». Статистическая обработка полученных данных осуществлялась при помощи программы «Statistica 10.0» и программы «MS Excel 2016». Для каждой из полученных величин высчитывали среднее (M) и ошибку среднего (m). Гипотезу о нормальности распределения вероятности данных проверяли с помощью критерия Шапиро–Уилка. Достоверность данных оценивали с помощью параметрического критерия t-теста Стьюдента. Критическое значение уровня статистической значимости было равно 0,05.
Результаты исследования и их обсуждение
Контрольная группа. Миокард был представлен группами кардиомиоцитов, формирующих пучки, расположенные плотно друг к другу. Кардиомиоциты были представлены в виде клеток, где на фоне эозинофильной цитоплазмы с отчетливо выраженным рисунком миофибрилл расположены палочковидные ядра, умеренно окрашенные гематоксилином. В строме располагались умеренно полнокровные сосуды. Подавляющее количество кардиомиоцитов имели два ядра небольших размеров (рис. 1а). Площадь ядер кардиомиоцитов составила 37,2±2 мкм2, периметр ядер – 27,3±0,8 мкм, длина ядра составила 11,9±0,3 мкм, ширина ядра – 3,9±0,1 (табл. 1). При окраске на ишемические повреждения миокард имел желтоватую окраску, участков фуксинофилии обнаружено не было (рис. 1б).
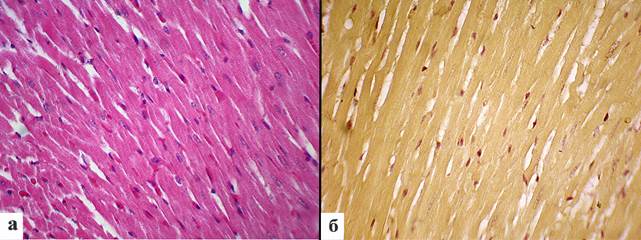
Рис. 1. Миокард крыс контрольной группы исследования: а – миокард представлен группами кардиомиоцитов, формирующих пучки, расположенные плотно друг к другу. Окраска гематоксилином и эозином. Ув. x400; б – фуксинофильные кардиомиоциты отсутствуют, клетки сердца имеют желтоватую окраску. Окраска по ГОФП. Ув. х400
Таблица 1
Морфометрические параметры кардиомиоцитов крыс после проведения однократной глубокой водной гипотермии
|
Параметры |
Контроль (I) |
День эксперимента |
|||
|
Сразу после гипотермии (II) |
2-й день (III) |
7-й день (IV) |
14-й день (V) |
||
|
Площадь ядра (мкм2) |
37,2±2 |
22,2±1,3 |
29,5±1,5 |
45,3±1,2 |
28,1±0,9 |
|
Периметр ядра (мкм) |
27,3±0,8 |
24,2±0,7 |
26,7±0,9 |
30.2±0,6 |
27,5±0,6 |
|
Длина ядра (мкм) |
11,9±0,3 |
10,8±0,3 |
11,9±0,5 |
13,1±0,3 |
12,6±0,3 |
|
Ширина ядра (мкм) |
3,9±0,1 |
2,6±0,1 |
3,1±0,09 |
4,4±0,1 |
2,8±0,1 |
|
Фуксинофильный миокард (%) |
– |
51,9±1,8 |
45,5±5,1 |
10,8±2,5 |
4,4±1,2 |
Примечание: для площади ядер PI-II, PIII-V < 0,0000001; PII-III < 0,0006. Для периметра ядер PI-III < 0,004; PIII-IV < 0,002; PIV-V < 0,005. Для длины ядра PI-II < 0,03; PII-IV < 0,07; PIV-V < 0,1. Для ширины ядра PI-II, PIII-V < 0,0000001. PII-III < 0,001. Для фуксинофильного миокарда PII-III < 0,3; PIII-IV < 0,0002; PIV-V < 0,05.
Экспериментальная группа исследования. В ткани сердца сразу после воздействия однократной глубокой иммерсионной гипотермии наблюдаются выраженный отек и признаки миолиза кардиомиоцитов, формирование оптических пустот, потеря исчерченности и нечеткость границ мышечных волокон. Ядра мышечных волокон полиморфной формы, гиперхромные, пикнотичные (рис. 2а).
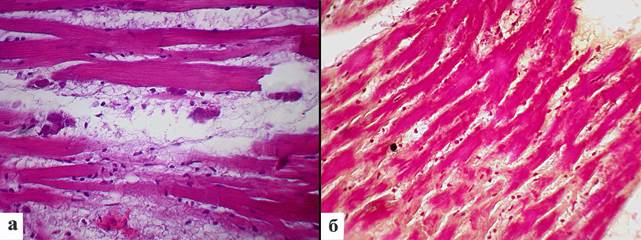
Рис. 2. Морфология миокарда крыс сразу после воздействия однократной глубокой иммерсионной гипотермии: а – выраженный отек и миолиз кардиомиоцитов, потеря исчерченности, нечеткость границ мышечных волокон, ядра пикнотичные. Окраска гематоксилином и эозином. Ув. x400; б – крупные, сливающиеся между собой поля фуксинофильного миокарда. Окраска по ГОФП. Ув. х400
Площадь ядер кардиомиоцитов составила 22,2±1,3 мкм2, периметр ядер – 24,2±0,7 мкм, длина ядра – 10,8±0,3 мкм, ширина ядра – 2,6±0,1 мкм (табл. 1). При окраске ГОФП по Lie отмечали крупные, сливающиеся между собой поля фуксинофильного миокарда. Доля кардиомиоцитов в состоянии ишемии составила 51,9%±1,8 (рис. 2б).
Строма вокруг пучков клеток имеет нечеткие границы, отмечаются признаки выраженного интерстициального отека. Выражены неравномерное кровенаполнение сосудов микроциркуляторного русла, полнокровие капилляров и венул. Стенка артерий утолщена за счет отека и набухания.
На 2-е сутки постгипотермического периода ткань сердца выглядела умеренно отечной, явления миолиза, просветление цитоплазмы, утрата исчерченности, нечеткость границ мышечных волокон сохранялись. Ядра кардиомиоцитов были с нечеткими границами, пикнотичные. Явления интестициального отека уменьшались (рис. 3а). Площадь ядер кардиомиоцитов увеличивалась до 29,5±1,5 мкм2, периметр ядер возрастал до 26,7±0,9 мкм, длина ядра составила 11,9±0,5 мкм и ширина ядра была равна 3,1±0,09 мкм (табл. 1). Окраска по ГОФП свидетельствовала об уменьшении ишемического повреждения кардиомиоцитов. Доля фуксинофильных кардиомиоцитов составила 45,5%±5,1 (рис. 3б).
На 7-е сутки постгипотермического периода ткань миокарда находилась в состоянии умеренно выраженного отека. Явления миолиза и неравномерности просветления цитоплазмы уменьшались. Ядра мышечных волокон выглядели увеличенными (рис. 4а). Площадь ядер кардиомиоцитов составила 45,3±1,2 мкм2, периметр ядер – 30,2±0,6 мкм, длина ядра – 13,1±0,3 мкм, ширина ядра – 4,4±0,1 мкм (табл. 1). Отмечалось дальнейшее уменьшение фуксинофилии кардиомиоцитов, доля фуксинофильных мышечных волокон составила 10,8%±2,5 (рис. 4б).
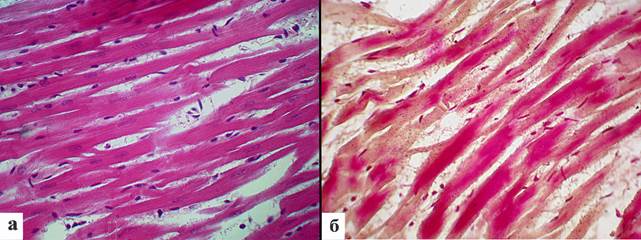
Рис. 3. Морфология миокарда крыс на 2-й день после однократной глубокой иммерсионной гипотермии: явления интерстициального отека уменьшаются.
Видна утрата исчерченности, ядра кардиомиоцитов пикнотичные. Окраска гематоксилином и эозином. Ув. x400; число фуксинофильных мышечных волокон уменьшается. Окраска по ГОФП. Ув. х400
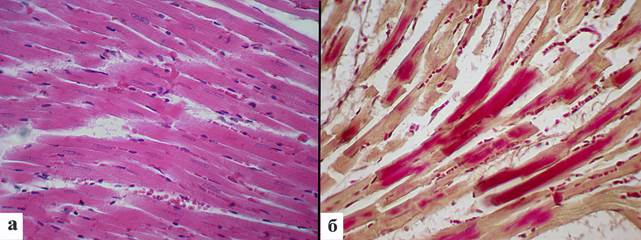
Рис. 4. Морфология миокарда крыс на 7-й день после однократной глубокой иммерсионной гипотермии: а – ткань миокарда в состоянии умеренно выраженного отека, явления миолиза и просветление цитоплазмы выражены слабо, ядра кардиомиоцитов увеличены. Окраска гематоксилином и эозином. Ув. x400; б – уменьшение фуксинофилии кардиомиоцитов. Окраска по ГОФП. Ув. х400
На 14-е сутки после однократной водной глубокой гипотермии в миокарде явления отека были выражены слабо. Размеры ядер кардиомиоцитов по сравнению с предыдущим сроком имели тенденцию к уменьшению (рис. 5а). Площадь ядер составила 28,1±0,9 мкм2, периметр ядер – 27,5±0,6 мкм, длина ядра – 12,6±0,3 мкм, ширина ядра – 2,8±0,1 мкм (табл. 1). При окрашивании по ГОФП была отмечена фуксинофилия отдельных мышечных волокон, доля фуксинофильных кардиомиоцитов составила 4,4±1,2 (рис. 5а).
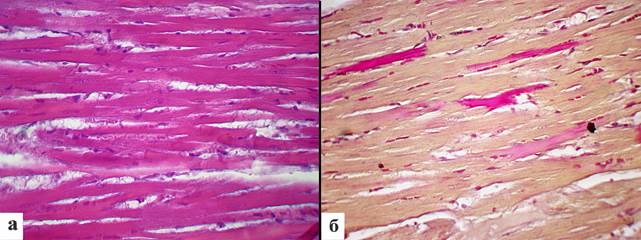
Рис. 5. Морфология миокарда крыс на 14-й день после однократной глубокой иммерсионной гипотермии: а – явления отека выражены слабо, размеры ядер карциомиоцитов уменьшены. Окраска гематоксилином и эозином. Ув. x400; б – мелкие очаги фуксинофилии мышечных волокон. Окраска по ГОФП. Ув. х400
Заключение
В исследовании был проведен сравнительный анализ морфофункциональной реорганизации миокарда крыс после однократной водной глубокой гипотермии. Результаты исследования показали, что гипотермия как неблагоприятный физический фактор окружающей срезы оказывала выраженное повреждающее действие на кардиомиоциты сердечной мышцы экспериментальных животных. При этом сразу после воздействия холодового фактора отмечали выраженные морфологические изменения стромы и ядер кардиомиоцитов крыс: сморщивание, кариопикноз, что может быть связано с повреждающим действием холода. Кариометрические измерения позволили обнаружить, что сразу после воздействия стрессового фактора площадь ядер кардиомиоцитов уменьшилась на 40%, периметр ядер кардиомиоцитов уменьшился на 12% и объемная доля кардиомиоцитов в состоянии ишемии достигала 51,9% по сравнению с контрольной группой. Выявленные изменения могут являться следствием метаболической депрессии миокарда, инактивации анаболических процессов, активации свободнорадикального окисления липидов и гипоксии. В постгипотермическом периоде ядра кардиомиоцитов увеличивались в размере, они были набухшие, светлые, число кардиомиоцитов в состоянии ишемии уменьшалось. На 7-й день постгипотермического периода морфометрические параметры ядер были наиболее высоки, что может быть объяснено адаптивной компенсаторно-приспособительной реакцией и активацией синтетических процессов в ядерном аппарате, число кардиомиоцитов в состоянии ишемии при этом уменьшалось в 4,8 раза и составило 10,8%±2,5. На 14-й день эксперимента кариометрические показатели практически приходили к норме, кардиомиоциты с ишемическими повреждениями были единичны.
Результаты проведенного исследования подтверждают важность и практикоориентированность изучения морфологических изменений, происходящих в органах и тканях при холодовом стрессе. Системное изучение морфофункциональных особенностей реорганизации ткани в условиях холодовой травмы способствует более полному пониманию особенностей развития компенсаторно-приспособительных реакций, формирующихся на фоне гипотермического повреждения, определению наиболее четких критериев (морфологических признаков), подтверждающих смерть от переохлаждения.



