Прошедшее сложное время пандемии, помимо множества человеческих потерь, позволило накопить большой клинический опыт. Теперь имеется время для подведения итогов, которые основаны на анализе особенностей клинического течения различных заболеваний в условиях пандемии COVID-19 [1].
У пациентов с COVID-19 часто наблюдается усиленный иммунный ответ с гипервоспалительным состоянием, характеризующимся «цитокиновым штормом», который может отражать изменения в составе микробиоты. Во время критического заболевания назначается множество методов лечения, включая антибиотики, седативные средства, анальгетики, лечебное положение тела (прон-позиция), инвазивную механическую вентиляцию легких, нутритивную поддержку, которые могут усилить воспалительную реакцию и изменить баланс микробиоты пациентов. Этот статус дисбактериоза способен привести к повышенной уязвимости пациентов и неадекватной реакции на критические обстоятельства, каким является экстренная хирургическая операция [2, 3].
Есть много причин, по которым COVID-19 вызывает симптомы поражения системы пищеварения. Во-первых, SARS-CoV-2 похож на SARS-CoV и может проникать в организм человека, связываясь с рецептором человеческого ангиотензинпревращающего фермента II, который вызывает повреждение ткани печени за счет усиления его экспрессии, вызванной компенсаторной пролиферацией гепатоцитов, происходящих из эпителиальных клеток желчных протоков. Во-вторых, SARS-CoV-2 прямо или косвенно повреждает пищеварительную систему посредством воспалительной реакции. Цепная реакция воспалительных факторов и виремии может повредить пищеварительную систему. Исследования показывают, что вирусная нуклеиновая кислота обнаруживается в образцах стула у 53,4% пациентов [4–8]. Энтеропатические вирусы могут напрямую повреждать слизистую оболочку кишечника и вызывать пищеварительные симптомы, но для подтверждения этой возможности необходимы дальнейшие исследования. В-третьих, кишечная флора заселена в кишечнике человека, и ее состав поразительно разнообразен. Кишечная флора играет множество важных физиологических ролей в организме, например влияет на метаболизм питательных веществ в организме, регулирует развитие и созревание иммунной системы организма и оказывает антибактериальное действие [8–10]. Сам вирус способен вызывать нарушения кишечной флоры, что может привести к расстройству пищеварения. Наконец, кишечник является крупнейшим иммунным органом в организме. Изменения в составе и функциях флоры пищеварительного тракта влияют на дыхательные пути через общую иммунную систему слизистых оболочек, а нарушения флоры дыхательных путей также воздействуют на пищеварительный тракт через иммунную регуляцию. Эффект называется «осью кишечник – легкие», что может дополнительно объяснить, почему у пациентов с пневмонией COVID-19 часто возникают симптомы нарушения пищеварения [11–13].
Цель исследования – исследование особенностей острой энтеральной недостаточности у больных COVID-19 путем изучения особенностей энтерального патобиома, биохимических, функциональных, провоспалительных и антиапоптотических маркеров при разлитом перитоните.
Материал и методы исследования. В период 2020–2021 гг. нами проведено ретроспективное рандомизированное когортное контролируемое комплексное обследование 42 больных COVID-19, у которых во время заболевания возникла острая хирургическая внутрибрюшная патология, которая осложнилась перитонитом и синдромом кишечной недостаточности, требующая экстренной операции. Группу сравнения составили 42 больных, которые были сопоставимы по полу, возрасту, а также тяжести и характеру патологии. Больные группы сравнения были оперированы в период 2017–2018 гг. – в допандемийный период. Стратификационными критериями включения в группы исследования являлись: APACHE II ≥15 баллов, индекс брюшной полости (ИБП, по В.С. Савельеву) ≥14 баллов. Критериями исключения являлись: острое тромбоэмболическое нарушение мезентериального кровообращения, злокачественные опухоли IV стадии, канцероматоз брюшной полости, а также проведение противоопухолевой химио- или лучевой терапии в анамнезе (табл. 1).
Таблица 1
Распределение больных по нозологиям и тяжести состояния (абс; М±m)
|
Нозология/ИБП; APACHE II |
Основная группа (n=42) |
Группа сравнения (n=42) |
|
Острая обтурационная толстокишечная непроходимость (опухолевая) |
11 |
10 |
|
Ущемленная вентральная грыжа |
9 |
10 |
|
Острая спаечная кишечная непроходимость |
9 |
9 |
|
Острый аппендицит |
7 |
8 |
|
Перфоративная язва желудка и двенадцатиперстной кишки |
6 |
5 |
|
ИБП |
15,8±0,8 |
15,6±1,1 |
|
APACHE II |
14,8±1,2 |
14,5±0,5 |
Изучались видовой состав и свойства энтеральной просветной микрофлоры, полученной из систем кишечного дренирования. Определяли колониеобразующие единицы (КОЕ) в 1 мл тонкокишечного содержимого. Определение чувствительности к антимикробным препаратам проводили диско-диффузионным методом EUCAST [14]. Выполнено 699 посевов, получено 3024 изолята.
Для изучения тяжести кишечной недостаточности с помощью УЗИ в динамике рассчитывали энтеральный морфофункциональный коэффициент (ЭМФК), который определяли на 1-е, 3-и и 5-е сутки лечения. Методом иммуноферментного анализа на приборе Cobas e411 (Швейцария) определяли общую щелочную фосфатазу (ЩФ) (Ед/л), ее изоформу – кишечную щелочную фосфатазу (Ед/л), а также их соотношение ЩФ/КЩФ (%) в сыворотке крови и кишечном содержимом. Исследования проводили на 1-е, 3-и и 5-е сутки.
Морфологические исследования тонкого кишечника выполнялись в случае его резекции или на аутопсии. Иммуногистохимические исследования проведены у 6 больных основной группы и у 5 пациентов группы сравнения. Контрольные данные получены при аутопсиях кишечника у больных без острой хирургической внутрибрюшной патологии (n=12). В качестве провоспалительного маркера использовали CD-3, антиапоптотического – Bcl-2. Использована система детекции UltraVision Quanto Detection System HRP Polymer (ThermoFisher, США).
Использовался метод стратификационной рандомизации. Статистические взаимосвязи между показателями оценивались с применением корреляционного модуля «Basic Statistics and Tables STATISTICA 10.0». С целью определения достоверности (Р) различий между группами применялся t-критерий Стьюдента. Статистически значимыми считались различия при р≤0,05.
Результаты исследования и их обсуждение. При исследовании энтерального микробиома в основной группе зарегистрировано снижение роста сапрофитной микрофлоры (Staphylococcus saprophyticus и Escherichia coli более чем в 2 раза). При этом констатирован экспрессивный рост Klebsiella spp., Candida, Clostridium spp. и Citrobacter (p≤0,05).
Особенную настороженность у больных COVID-19 вызвал рост представительства Staphylococcus aureus – возбудителя, нехарактерного для нормальной микрофлоры тонкой кишки. В основной группе уровень составил 1,6х102КОЕ в 1 мл, в группе сравнения – 6,6х107КОЕ в 1 мл (p≤0,05) (рис. 1).
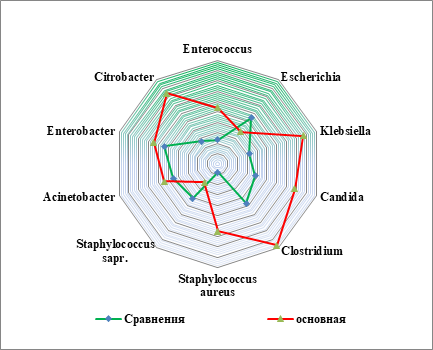
Рис. 1. Микробный энтеральный пейзаж в группах исследования (КОЕ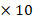 1-10 в 1 мл тонкокишечного химуса)
1-10 в 1 мл тонкокишечного химуса)
При анализе данных антибиотикограмм наибольший интерес вызвали данные, полученные в основной группе. Отмечено повышение резистентности инокулированных изолятов ко всем антибактериальным препаратам. Суммарный процент антибиотикорезистентных штаммов в группе сравнения составил 8,3%, в основной группе – 36,9% (р≤0,05). Отмечается высокая устойчивость к полусинтетическим пенициллинам. Оказалось, что почти все возбудители нечувствительны к ампициллину, и только к Enterococcus spp. отмечен эффект – 24,4%. Аминогликозиды показали эффективность только против Clostridium spp. (34,3%), Escherichia coli (45,8%) и Citrobacter (18,9%).
Наибольшая чувствительность выявлена к карбапенемам, гликопептидам и оксазолидинонам. Было показано, что золотистый стафилококк устойчив практически ко всем антибактериальным препаратам, за исключением линезолида, эффективность которого составила 98%. Возбудители MRSA отмечены в 86,4% случаев, штаммы VRSA – в 20,6% случаев.
Функциональные и биохимические маркеры кишечной недостаточности на старте в обеих группах в среднем соответствовали стадии субкомпенсации и статистически не различались. Во всех группах отмечался дефицит кишечной изоформы щелочной фосфатазы, т.е. имел место дисбаланс соотношения ЩФ/ЩФ с преобладанием ЩФ, что свидетельствовало о выраженном воспалении (табл. 2).
Таблица 2
Изменения биохимических и функциональных показателей в группах исследования (M±m; абс.)
|
Группы |
Объект исследования |
ЩФ/КЩФ (%) |
ЭМФК (баллы) |
|||
|
1-е сутки |
5-е сутки |
1-е сутки |
3-и сутки |
5-е сутки |
||
|
Сравнения (n=42) |
сыворотка |
0,71±0,21 |
0,33±0,15* |
18,3±0,8 |
5,9±0,3* |
4,5±0,3 |
|
химус |
6,23±0,16 |
2,86±0,09* |
||||
|
Основная (n=42) |
сыворотка |
0,74±0,13 |
0,65±0,11 |
19,4±0,24 |
14,8±1,1 |
10,8±0,6* |
|
химус |
7,01±0,22 |
6,21±0,12 |
||||
* – значения при р≤0,05
На 5-й день лечения в группе сравнения показатель ЭМФК был достоверно ниже (p≤0,05) по сравнению с основной группой. В основной группе достоверное снижение ЭМФК было достигнуто только к концу 5-го дня лечения. Соотношение ЩФ/КЩФ достоверно возвращалось к нормальным значениям к 5-м суткам в группе сравнения (р≤0,05). В то же время восстановления дисбаланса ЩФ/АСЛП в группе пациентов с COVID-19 не произошло.
Макроскопическая картина при операциях в основной группе характеризовалась истончением и «дряблостью» стенки тонкой кишки. Визуально перистальтика отсутствовала. На серозной оболочке имелись цианотичные участки (рис. 2).
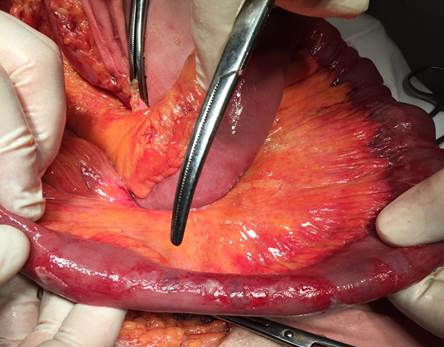
Рис. 2. Характерный внешний вид тонкой кишки с декомпенсированной кишечной недостаточностью и предперфорационными изменениями ее стенки у больного COVID-19
У 4 больных основной группы в послеоперационном периоде возникли перфорации острых язв, которые локализовались в подвздошной кишке и потребовали повторных операций. В группе сравнения перфораций тонкой кишки не было. Морфологическая картина при прижизненных исследованиях и вскрытиях в основной группе характеризовалась истончением слизистой оболочки, лизисом клеток верхней части ворсин, при этом основание ворсин было расширено за счет обилия лимфоидных клеток. Клетки Панета отсутствовали. Отмечалась массивная десквамация эпителиоцитов в области верхушек и боковых стенок с обнажением соединительнотканной основы.
Иммуногистохимическое исследование показало значительное увеличение экспрессии CD3+ и практически полное отсутствие клеток Bcl-2+ (p≥0,05) (рис. 3, 4).
Рис. 3. Динамика оптической плотности Bcl-2+ и CD-3+ в группах (*– ≤0,05)
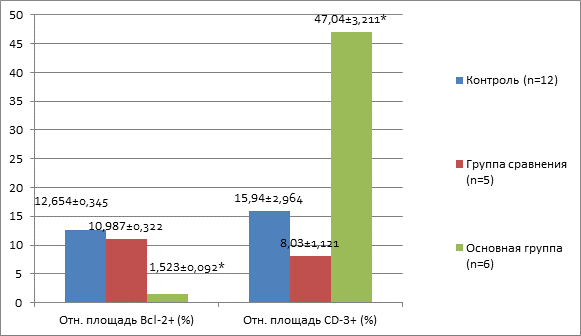
Рис. 4. Динамика относительной площади экспрессии Bcl-2+ и CD-3+ в группах (*– ≤0,05)
Летальность в основной группе составила 9 (21,4%), в группе сравнения – 5 (11,9%) (р≤0,05).
В формировании вышеуказанного энтерального патобиома, на наш взгляд, решающее значение имели нерациональная длительная системная антибиотикопрофилактика и антибактериальная терапия, проводимые до поступления в хирургический стационар, и лекарственная полипрагмазия. Морфологические изменения кишечной стенки указывали на высокий риск перфорации тонкой кишки. Рациональная антибактериальная терапия при COVID-19 служит профилактической мерой в формировании энтерального патобиома. Восстановление микроциркуляции кишечника является одним из основных патогенетических методов лечебного воздействия. Высокий риск острой перфорации тонкой кишки требует проявления особой бдительности.
Выводы. Сформированный специфический антибиотикорезистентный энтеральный патобиом, выраженные воспалительные и апоптотические изменения кишечной стенки, предрасположенность к перфорациям кишечника являются особенностями острой кишечной недостаточности при разлитом перитоните у больных COVID-19, что следует учитывать при ведении этих пациентов.



