Новый ингаляционный анестетик севофлуран был открыт в 1971 г. Клиническое использование севофлурана началось только в 1990 г. в Японии. В США и странах Европы данный ингаляционный анестетик стал применяться в 1995 г. В настоящее время севофлуран является одним из самых популярных ингаляционных анестетиков в мире, в первую очередь – за счет низкого коэффициента распределения кровь/газ и отсутствия раздражающего эффекта на дыхательные пути [1]. Севофлуран представляется идеальным анестетиком для введения в наркоз и поддержания анестезии у детей за счет быстрого действия и отсутствия неприятного запаха [2]. Именно техника VIMA (Volatile Induction and Maintenance Anesthesia – ингаляционная индукция и поддержание анестезии) является наиболее распространенной в детской анестезиологии [3].
В мире за последние годы регистрируется повышение частоты использования общей анестезии в детской стоматологии, и анестетиком выбора здесь является севофлуран [4]. Главным преимуществам использования севофлурана в амбулаторной анестезиологии представляется быстрое восстановление пациента после наркоза. Среднее время восстановления при мононаркозе севофлураном составляет около 1,5–2 часов. К показаниям для лечения зубов у детей в условиях общей анестезии относятся множественный кариес, когда продолжительность лечения может составлять более 1 часа, выраженные фобии, а также различные психические отклонения у ребенка, делающие невозможным контакт с ним.
Но для севофлурановой анестезии у детей характерны и побочные эффекты, а именно возникновение возбуждения при введении в наркоз и высокая частота постнаркозной ажитации при пробуждении ребенка [5].
Возбуждение при индукции в анестезию проявляется некоординированными движениями, что требует фиксации ребенка и регистрируется у 65–85% детей [6]. Во время стадии возбуждения вследствие повышенного тонуса мышц грудной клетки возникают проблемы с вспомогательной искусственной вентиляцией легких. Развитие данной ситуации приводит к снижению минутной вентиляции легких и, как следствие, к дыхательному ацидозу. В ряде исследований было убедительно показано, что причиной стадии возбуждения является повышенная эпилептиформная активность головного мозга при индукции в анестезию севофлураном [7].
Постнаркозная ажитация – это особый клинический феномен, встречающийся у детей младшей возрастной группы (от 2 до 7 лет), клиническими проявлениями которого являются некоординированные движения, плач на фоне полного отсутствия контакта с ребенком. Продолжительность ажитации может составлять от 5 до 70 минут и требует удерживания ребенка, что приводит к удлинению времени его пробуждения, а также к стрессу у родителей. Частота развития ажитации варьирует от 20% до 67% [8] и может достигать 80%. Следует отметить, что феномен ажитации одинаково часто встречается как при наркозе севофлураном, так и при десфлурановой анестезии. Для профилактики вышеописанных побочных эффектов севофлурановой анестезии в клинике широко применяются такие препараты, как мидазолам, фентанил и пропофол [9, 10]. Следует отметить, что использование данных препаратов приведет к более длительному восстановлению после наркоза, что является неприемлемым для амбулаторной анестезиологии.
В последние годы исследователями активно изучается кардиопротективный и нейропротективный эффекты севофлурана, которые возникают при использовании феномена прекондиционирования [11].
Прекондиционирование представляет собой феномен специфической адаптации организма на уровне его клеточного метаболизма, включая такие органы, как головной мозг и сердце, к потенциально вредному фактору. При этом первое кратковременное воздействие данного фактора стимулирует в дальнейшем устойчивость органов к следующему более длительному воздействию. Можно сказать, что прекондиционирование – это специфическая подготовка организма, повышающая его устойчивость к потенциально вредному фактору [12]. В экспериментальном исследовании (Riess et al., 2004) было убедительно показано, что кратковременное двойное прекондиционирование севофлураном достоверно лучше защищало миокард морских свинок от ишемии [13].
Мы предположили, что использование прекондиционирования севофлураном при введении в наркоз позволит обеспечить нейропротекцию, что даст возможность минимизировать такие негативные эффекты севофлурановой анестезии, как возбуждение и постнаркозная ажитация. Наша идея заключалась в том, что использование двух болюсов севофлурана для погружения в анестезию позволит обеспечить эффект прекондиционирования.
Первоначальный кратковременный болюс 6% севофлурана должен вызывать не только засыпание ребенка, но и эффект прекондиционирования. Повторная подача севофлурана обеспечивает необходимый уровень глубины наркоза, достаточный для введения ларингеальной маски и проведения искусственной вентиляции легких (ИВЛ).
Цель исследования
Изучить влияние двух техник анестезии севофлураном на частоту развития возбуждения и постнаркозной ажитации в детской стоматологии.
Материал и методы исследования
Исследование проведено на базе стоматологической поликлиники Тверского государственного медицинского университета за период с мая 2017 г. по май 2022 г. Стоматологическое лечение (лечение множественного кариеса и удаление зубов) выполнено у 340 детей. Возраст детей составлял от 3 до 6 лет. 1-я группа включала в себя 210 детей (ретроспективное исследование), которым проведено лечение/удаление зубов при использовании стандартной методики VIMA. 2-я группа включала в себя 130 детей (проспективное исследование), которым проводились стоматологические вмешательства с использованием нового способа ингаляционной анестезии, в основе которой были два болюса севофлурана при введении в наркоз. По соматическому статусу группы не различались (I–II по Американской Ассоциации Анестезиологов). По гендерному составу, среднему возрасту и массе тела детей группы также не отличались друг от друга. Вес детей в группах колебался от 12 до 26 кг. Наркоз у детей выполнялся утром, натощак. Питье прозрачных жидкостей прекращалось за 2 часа до анестезии. Премедикация у детей не использовалась. Индукция в анестезию проводилась в присутствии одного из родителей, при этом ребенок сидел у родителя на коленях. После засыпания ребенок брался на руки, родитель в это время освобождал стоматологическое кресло. Кресло приводилось в горизонтальное положение, и ребенок укладывался на него. При стоматологическом лечении у всех детей использовалась местная анестезия.
Стандартная методика VIMA заключалась в подаче через лицевую маску 6% севофлурана в потоке 40% О2 (2 л/мин) и 60% N2O (3 л/мин). После засыпания (закрытия глаз) подача севофлурана уменьшалась с 6% до 3%. Препаратом с данной концентрацией ребенок дышал в среднем 5 минут, пока не был достигнут уровень наркоза, необходимый для установки ларингеальной маски и перевода на ИВЛ.
Мы разработали и запатентовали новый метод ингаляционной анестезии севофлураном (VIMA) у детей, в основе которого лежит двойная индукция [14].
В отличие от стандартной методики VIMA, при новой технике после первоначального болюса (6% севофлурана + 40% О2 и 60% N2O), приводящего к утрате сознания, что определялось по моменту закрытия глаз, подача севофлурана прекращалась, при этом подача кислорода и закиси азота оставалась прежней. Контур наркозного аппарата продувался 100%-ным кислородом, при этом дыхательный мешок активно опорожнялся от 3 до 5 раз. В это время (3–4 минуты) пациент дышал смесью кислорода и закиси азота при прежних потоках. При снижении вентиляции применялась вспомогательная вентиляция через лицевую маску. В течение этого времени происходило выведение севофлурана из организма, что контролировалось по данным газоанализатора. Повторная подача севофлурана при открытом полностью испарителе начиналась в момент перехода урежения ЧСС на его повышение на 1–2 удара в минуту. Данная динамика ЧСС регистрируется при достижении 0,3% севофлурана в выдыхаемом воздухе. Второй болюс продолжался в среднем 2,0–2,5 минуты. За это время достигалось необходимая глубина наркоза, после чего устанавливалась ларингеальная маска и начиналась ИВЛ.
В исследуемых группах анестезия поддерживалась одинаково и проводилась по полузакрытому контуру (3% севофлурана + О2 0,6 л/мин, N2O 0,7 л/мин). Средняя продолжительность ингаляционной анестезии в группах была одинаковой составляла от 70 до 110 минут (95±10 минут). У всех детей использовалась искусственная вентиляция легких (ИВЛ) по объему с поддержанием углекислого газа на выдохе в пределах 35–40 мм рт. ст.
За «возбуждение» при индукции в анестезию принимались движения конечностей, туловища, шеи, требующие удержания ребенка. Для диагностики ажитации использовались максимальные значения по шкале возникновения постнаркозного делирия у детей (Pediatric Anesthesia Emergence Delirium scales), т.е. признаками ажитации являлись отсутствие зрительного контакта, крик, плач ребенка и необходимость его физического удержания.
Для проведения ингаляционной анестезии использовался наркозный аппарат Fabius Plus (Dräger) с газоанализатором Scio Four Oxi plus и монитором Infinity Vista XL. Мониторинг во время наркоза включал в себя определение: ЭКГ, ЧСС, АД, SpO2, etCO2, концентрации O2, N2O, севофлурана на вдохе и выдохе, Vt, температуры тела.
Статистический анализ выполнялся на основе программы IBM SPSS Statistics v. 21. Доверительный интервал (ДИ) составлял 95%. Для оценки нормального распределения групп использовался критерий Колмогорова–Смирнова. Достоверность различий между группами определялась по критерию Стьюдента при статистической значимости р<0,05.
Результаты исследования и их обсуждение
Во время индукции в анестезию возбуждение регистрировалось в 3,5 раза чаще в 1-й группе (95% ДИ 0,18–0,41), чем во 2-й группе. Разные виды мышечной двигательной активности в 1-й группе зафиксированы у 163 детей (77,6%), в то время как во 2-й группе – у 19 (20,7%) детей (р<0,001). Разность встречаемости стадии возбуждения в исследуемых группах представлена на рисунке 1.
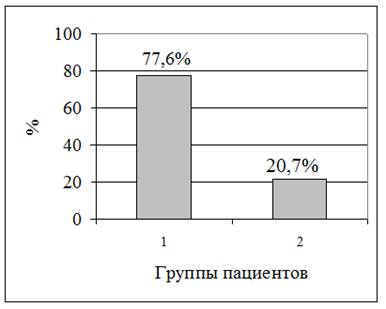
Рис. 1. Частота возбуждения в группах
Феномен ажитации в 1-й группе регистрировался в 6,5 раз чаще, чем во 2-й группе (95% ДИ 0,06–0,52). Постнаркозная ажитация в 1-й группе выявлена у 52 детей (24,7%), в то время как во 2-й группе – у 5 (3,8%) пациентов (р<0,006).
Разность встречаемости постнаркозной ажитации в группах представлена на рисунке2.
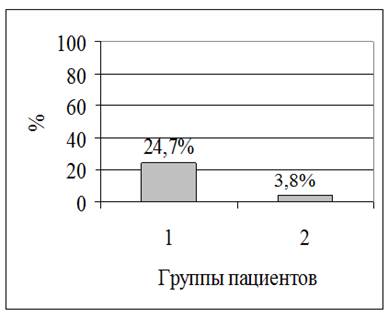
Рис. 2. Частота ажитации в группах
Данные научных работ за последние годы, в которых изучалось севофлурановое прекондиционирование, убедительно показали, что с помощью прекондиционирования обеспечиваются кардиопротективный и нейропротективный эффекты. Способ индукции в анестезию с двумя болюсами, предложенный нами, позволяет сделать предположение, что использование первоначального болюса севофлурана во время индукции в наркоз дает возможность осуществить феномен прекондиционирования и тем самым может минимизировать такие побочные эффекты данного вида анестезии, как возбуждение и ажитация.
Исследования, изучающие электрическую активность головного мозга при севофлурановой анестезии, выявили тесную взаимосвязь между возникновением эпилептиформной активности по данным электроэнцефалограммы (ЭЭГ), возникающей при индукции в наркоз, и развитием стадии возбуждения [15]. В своей работе Kreuzer Ines et al. (2014) показали, что эпилептиформная активность на ЭЭГ возникает в среднем через 70 секунд от начала анестезии. Авторы зафиксировали, что в это время концентрация севофлурана достигает 3,5% на выдохе. В нашем исследовании первоначальный болюс севофлурана был достаточно коротким и продолжался не более 30–40 секунд, и за это время концентрация севофлурана, по данным газоанализатора, не выходила за пределы 3,5%. Исходя из этого можно сделать заключение, что у детей 2-й группы уровень севофлурана в головном мозге не достигал тех значений, при которых развивается эпилептиформная активность. Скорее всего, именно с этим связана достоверно более низкая встречаемость возбуждения при индукции в анестезию во 2-й группе.
В патогенезе постнаркозной ажитации, по данным ряда авторов, тоже лежит развитие эпилептиформной активности головного мозга. Минимальная встречаемость ажитации во 2-й группе может быть объяснена нейропротекцией, вызванной эффектом прекондиционирования при введении в анестезию.
Разработанный нами способ ингаляционной анестезии севофлураном, в основе которого лежит двойная болюсная индукция, имеет преимущества и с экономической стороны, так как позволяет уменьшить расход анестетика на этапе индукции в анестезию, поскольку подача анестетика до установления ларингеальной маски продолжается не более 3 минут по сравнению с традиционной методикой VIMA, где это время составляет 5–6 минут.
Заключение
Новый способ ингаляционной анестезии севофлураном, в основе которого лежит двойная болюсная индукция при введении в наркоз, благодаря феномену прекондиционирования обеспечивает минимальную частоту таких побочных эффектов, как возбуждение и постнаркозная ажитация.
Мы считаем, что данный метод севофлурановой анестезии может быть перспективным, для подтверждения этого необходимы дальнейшие исследования.



