За последнее десятилетие интерстициальная лазерная фотокоагуляция (ИЛФ) под контролем УЗИ, как метод лечения доброкачественных узлов и кист щитовидной железы (ЩЖ), привлекла широкое внимание специалистов [1; 2]. Многочисленные исследования [3; 4] говорят о том, что щадящая методика хирургического лечения обеспечивает клинически значимое длительное уменьшение объема доброкачественных узлов при сохранении функции ЩЖ [5]. В 2020 году немецкая многопрофильная группа специалистов [6] одобрила методы термоабляции, в том числе и ИЛФ, в качестве альтернативы первой линии хирургической операции при доброкачественных узлах ЩЖ. Стремление к удалению патологической ткани ЩЖ при максимальном сохранении функционирующей ткани вполне оправданно и является альтернативой агрессивной тактике [7]. Помимо сохранения эутиреоза, применение ИЛФ позволяет при удалении патологического очага в ЩЖ избежать серьезных осложнений традиционных оперативных технологий, таких как гипопаратиреоз, кровотечение и повреждение нервов [8], и улучшить качество жизни пациентов [9]. При оценке эффекта лечения используют параметры УЗИ, в частности оценку регресса размеров и объема узлов ЩЖ. Оценка структурных изменений в узлах ЩЖ в отдаленные сроки (более 5 лет) показывает, что направленность изменений может быть различной [10]. С позиции прогнозирования результатов и технического усовершенствования ИЛФ представляет интерес изучение морфологических изменений в узлах ЩЖ как в ранние, так и в отдаленные сроки. Работы подобной тематики единичны и касаются в основном ближайших сроков [11], что объясняется тем, что ИЛФ используется относительно недавно и отсутствует возможность провести достоверный ретроспективный морфологический анализ.
Целью настоящего исследования была оценка изменений в узлах ЩЖ в отдаленные сроки после выполнения ИЛФ.
Материалы и методы исследования
В 2005-2010 годах в лечении пациентов с цитологически верифицированным узловым эутиреоидным зобом в клинике широко использовали ИЛФ. Лечение проводили согласно разрешению этического комитета, каждый пациент подписывал информированное согласие на лечение. ИЛФ выполняли под УЗИ-контролем (аппарат Medison Pico, линейный датчик 5-9 МГц) диодным лазером «Ламеда» (GaAlAs) [12]. Для этого световод диаметром 0,4 мм с плоским торцом проводили в узел ЩЖ через стандартную иглу 19G. При лечении использовали эмпирически подобранный импульсный режим ИЛФ: мощность от 3,5-4,0 Вт, длина импульса 200 мсек, пауза 10 мсек, длина волны 970-1064 нм. Длительность одной процедуры ИЛФ (от 6 до 15 минут) зависела от размеров и эхоструктуры узла ЩЖ, от четкости и возможности УЗИ-контроля, а также состояния пациента во время лечения (болевые ощущения, эмоциональный настрой). За первые 5 минут ИЛФ происходил нагрев тканей узла ЩЖ до температуры 50-55°C, что приводило к их необратимому термическому повреждению. При увеличении времени ИЛФ происходил разогрев тканей до 100-110°C, что приводило к их сгоранию и обугливанию (карбонизации). Количество сеансов ИЛФ у одного пациента было от 1 до 6 (в среднем 1,7 ± 1,2 на один узел). Информация о пациентах была внесена в базу данных ИЛФ (БДИЛФ). После ИЛФ в течение первого года пациентам периодически выполняли контрольные УЗИ ЩЖ, в ходе которых проводилась оценка изменений в узлах ЩЖ, в первую очередь проводились замеры их размеров и объема. В последующем пациенты наблюдались эндокринологами поликлиник. В 2020-2021 годах было запланировано и выполнено многоплановое изучение (клиника, УЗИ, гормональный статус) отдаленных результатов ИЛФ (от 8 до 15 лет), в том числе морфологических изменений, происходящих в узлах ЩЖ. При выполнении данного раздела работы имелись проблемы этического плана, так как для получения препарата у пациента должна быть удалена ЩЖ, а создать экспериментальную модель узлового коллоидного зоба у животных и провести его ИЛФ технически достаточно сложно. Морфологический материал был получен у 12 пациентов, которым спустя несколько лет после ИЛФ были проведены хирургические операции на ЩЖ по различным показаниям. Перед операцией каждый пациент подписывал информированное согласие на лечение. Время между ИЛФ и операцией на ЩЖ варьировалось от 7 до 15 лет (в среднем 12 лет). Протоколы хирургических операций заносились в операционный журнал и базу данных о выполненных операциях (БДВО). При отборе материала анализировали обе базы данных (БДИЛФ и БДВО). Критериями включения в исследование было наличие пациента в обеих базах, то есть факт первичного проведения у пациентов ИЛФ узлов ЩЖ и в последующем выполнение спустя несколько лет (8-15 лет) операции на ЩЖ по различным показаниям. Согласно критериям отбора в исследование были включены 12 человек (все женщины в среднем возрасте 46,2±7,4 года (41÷63)). Показаниями к выполнению хирургических операций у них были аденома ЩЖ (3 человека), рак ЩЖ (3 человека), многоузловой токсический зоб (4 человека) и зоб с компрессионным синдромом (2 человека). Заключительные морфологические диагнозы были следующими: папиллярный рак ЩЖ (3 больных), фолликулярная аденома (3 больных) и пролиферирующий коллоидный зоб (6 больных). После сопоставления баз данных БДИЛФ и БДВО и выявления пациентов, находящихся в обеих базах, в патологоанатомическом отделении были затребованы блоки и стекла послеоперационных препаратов. Послеоперационные препараты готовились к патоморфологическому исследованию согласно Приказам Министерства здравоохранения РФ «О Правилах проведения патологоанатомических исследований»: удаленный в ходе операции препарат фиксировали в 10%-ном буферном растворе нейтрального формалина. Контейнер с операционным материалом доставлялся в патологоанатомическое отделение вместе с направлением, в котором указывались данные пациента, маркировка узлов, в том числе и тех, при лечении которых использовалась ИЛФ. Из макропрепаратов готовили парафиновые блоки. Исследование выполняли на парафиновых срезах толщиной 5-7 мкм. Срезы окрашивали гематоксилином-эозином. Морфологическое изучение препаратов (стекол) проводилось с помощью светового микроскопа МББ 1А с увеличением х100 и х400. В протокол патоморфологического исследования вносили описание макропрепарата с указанием размеров удаленной ЩЖ и имеющихся в ней узлов, а также описание микроскопической картины.
Хотя наиболее наглядными признаками эффективности ИЛФ являются изменения (размеров и объема) узлов ЩЖ, в данном исследовании они не учитывались, поскольку это не являлось задачей исследования. Проводилась оценка структурно-морфологических изменений, для этого из общего числа отбирали блоки и стекла, маркировка которых соответствовала изучаемым узлам. В основном оценивалась зона узлового образования ЩЖ после воздействия ИЛФ, проводили описательную оценку, поскольку фактически анализировались единичные клинические наблюдения. Морфометрию структур в узлах ЩЖ после ИЛФ не проводили ввиду различной морфологии узловых образований (пролиферирующий токсический и нетоксический зоб, а также аденома ЩЖ и рак ЩЖ) и малого количества наблюдений (по 3-6 наблюдений в каждой морфологической группе), что не позволило получить статистически достоверных данных, описывающих динамику изменений в узловых образованиях ЩЖ во всей группе больных после ИЛФ.
Результаты исследования и их обсуждение
Большинство исследователей [13] считают главными показателями эффективности ИЛФ уменьшение размера и объема узлов ЩЖ в сроки до 12 месяцев. Положительным эффектом лечения с помощью ИЛФ считается полная регрессия узла с замещением его рубцовой тканью и частичная регрессия (уменьшение объема - ΔV) узла ЩЖ более чем на 50% от исходного размера [14]. Кроме того, возможными вариантами ИЛФ могут быть отсутствие динамики (нет ΔV или ΔV узла ЩЖ менее чем на половину от первоначального объема) и увеличение размеров узла.
У всех 12 пациентов в течение первого года после ИЛФ был достигнут положительный эффект. Спустя 5 лет у 2 пациентов был отмечен повторный рост узлов с развитием компрессионного синдрома (одна пациентка была оперирована через 8 лет после ИЛФ, вторая – через 11 лет). У 10 пациенток положительный эффект был стабильным и долговременным, а основанием для вмешательств послужило образование опухолей и функциональная автономия в этой же или контрлатеральной доле ЩЖ.
Исследование установило изменения, происходящие в ткани ЩЖ в отдаленные сроки (спустя 7-15 лет) после ИЛФ. Во всех препаратах были отмечены признаки повреждения тканей, вызванного лазером, в виде ограниченной области (VF–зона фиброза), содержащей различное количество воспалительных клеток и окруженной фиброзной капсулой. На местах непосредственного воздействия лазерного излучения (описанных ранее, как зоны «коагуляционного некроза» и карбонизации [15]) определялись участки аморфных масс (рис. 1), между ними и живой тканью имелась выраженная граница.
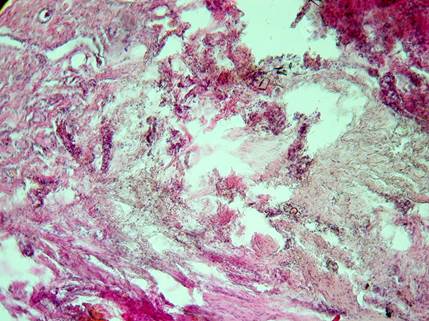
Рис. 1. Пациентка С. Отдаленные результаты применения ИЛФ (через 7 лет) узла щитовидной железы. Аморфные массы и соединительнотканные элементы в зоне воздействия. Окраска: гематоксилин-эозин. Об. 10. Ок. 10
Исходя из клеточного состава данных зон (лимфоциты и макрофаги с признаками фагоцитоза), можно сказать, что воспаление носило хронический характер. Распределение лимфоцитов было неоднородным, что могло быть проявлением локальной аутоиммунной реакции. Характерным было наличие на отдельных участках «разрушенных» узлов ЩЖ слабо васкуляризированной соединительнотканной ткани, которая замещала все остальные клетки. В зонах фиброза клетки фолликулярного эпителия были единичными, что указывало на отсутствие возможности регенерации ткани ЩЖ. Соединительная ткань характеризовалась мозаичным строением, участки имели различия. В ряде из них преобладал стромальный компонент в виде сливных участков гиалиноза (рис. 2), в других имелась ориентированная направленность коллагеновых волокон, как правило, от зоны первичного некроза к капсуле узла. Полученные данные согласуются с мнением [11], что уменьшение объема узлов ЩЖ после ИЛФ происходит за счет прогрессирующей реабсорбции некротизированной ткани и замещения в последующем зоны воспаления фиброзным рубцом. К числу специфических признаков ИЛФ были отнесено присутствие в препаратах фрагментов карбонизации, которые не полностью рассосались. Они располагались среди элементов фиброзной ткани и не имели признаков инкапсуляции.
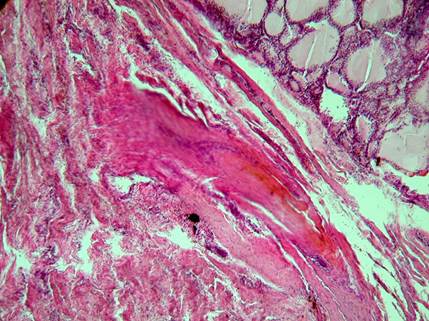
Рис. 2. Пациентка С. Отдаленные результаты применения ИЛФ (через 7 лет) узла щитовидной железы. Развитие фиброза и гиалиноза в зоне ИЛФ. В центре видны зоны карбонизации (черного цвета). Окраска: гематоксилин-эозин. Об. 10. Ок. 10
Также к числу специфических находок было отнесено наличие в узлах ЩЖ фрагментов волоконно-оптических световодов, с помощью которых проводилась ИЛФ. При ИЛФ используют тонкие кварцевые оптические световоды диаметром 0,4 мм. Сердцевиной является кварцевое стекло с прочностью 10 ГПа. При нагреве световода и контакте с жесткими тканями прочность снижается. Для увеличения прочности на кварцевое волокно наносят полимерное покрытие. При ИЛФ происходит нагрев не только ткани узла ЩЖ, но и самого световода с частичным обгоранием полимерного покрытия, а оптоволокно, лишенное его, становится хрупким и крошится при движении световода. В качестве подтверждения этого могут служить случаи, когда среди аморфных и соединительнотканных элементов были обнаружены фрагменты обугленного полимерного покрытия и частицы кварцевого стекла (рис. 3, 4).
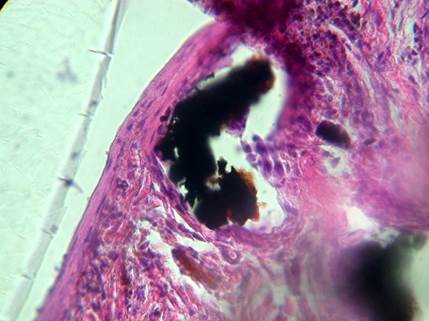
Рис. 3. Пациентка Л. Отдаленные результаты применения ИЛФ (через 10 лет) узла щитовидной железы. Карбонизированный фрагмент полимерного покрытия световода (черного цвета). Окраска: гематоксилин-эозин. Об. 10. Ок. 40
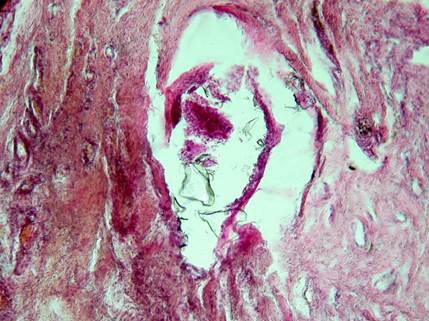
Рис. 4. Пациентка Л. Отдаленные результаты применения ИЛФ (через10 лет) узла щитовидной железы. Фрагменты кварцевого стекла световода в участке гиалиноза. Окраска: гематоксилин-эозин. Об. 10. Ок. 40
Сопоставление имевшихся в протоколах ИЛФ показателей (количество энергии, время и др.) с выраженностью фиброза не установило прямой зависимости. Вероятно, это связано с различной способностью поглощения энергии тканями, которая зависит в значительной степени от спектрального поглощения ткани (поглощение составляющих её хромофоров: гемоглобина, коллагена, коллоида) и особенностей васкуляризации узлов [16]. Вместе с тем между сливными зонами полного замещения железистого эпителия соединительной тканью выявлялись группы жизнеспособных тиреоцитов, которые представляли собой «островки» тиреоидной ткани в фиброзе (по УЗИ - зона VL).
Их сохранение можно было объяснить тем, что невозможно провести прямой контроль за проведением ИЛФ. При контроле за выполнением ИЛФ применяется субъективная оценка специалистом изменений изображения узла на мониторе аппарата УЗИ. Поскольку прямой корреляции между УЗИ-изображением и реальными изменениями в узле ЩЖ нет, то закономерным является возможность сохранения на отдельных участках узлов ЩЖ живой ткани. Также жизнеспособная ткань сохранялась на участках узлов ЩЖ, примыкающих к трахее, сосудам и пищеводу.
Таким образом, узлы ЩЖ после ИЛФ условно состоят из двух частей (рис. 5). Первая - разрушенная ткань (специалисты УЗИ маркируют её как VF), которая затем частично рассасывается, а частично замещается рубцовой тканью, за счет нее идет уменьшение объема узла ЩЖ (ΔV). При отслеживании динамики размеров и структуры узла ЩЖ после ИЛФ зона VF при УЗИ описывается как гипоэхогенная зона [17], имеющая на ранних сроках тенденцию к ΔV, а в последующем сохраняющая стабильные параметры. Параметры VF, как правило, можно измерить. Зона VL сложна для оценки. Связано это с тем, что после ИЛФ живые тиреоциты чаще всего располагаются по периферии узла ЩЖ, но при недостаточном количестве приложенной энергии могут быть и в центральной зоне узла ЩЖ.
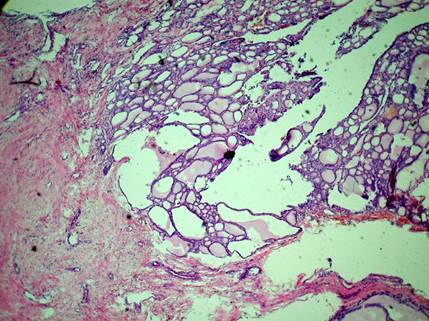
Рис. 5. Пациентка Ф. Отдаленные результаты применения ИЛФ (через 12 лет) узла щитовидной железы. Слева: зона аморфных масс и фиброза с карбонизацией (VF), справа - зона живых тироцитов (VL). Окраска: гематоксилин-эозин. Об. 10. Ок. 10
По данным R. Negro с соавторами [18], у 37,5% пациентов в отдаленные сроки происходит повторный рост узлов. Он происходит за счет VL. На ранних сроках VL, как правило, невелик и не влияет на VN, поскольку параллельно происходит ΔV за счет VF. При контроле в отдаленные сроки прирост VN обеспечивает VL. Темпы его прироста могут служить основанием для выполнения повторной ИЛФ. Именно неопределенность в отношении клинических долгосрочных результатов, опасения по поводу побочных эффектов и боязнь пропустить рак ЩЖ являются причинами сдержанного отношения специалистов к широкому использованию ИЛФ в клинической практике [19].
Заключение
Проведенное исследование показало, что в отдаленные сроки (8-15 лет) после ИЛФ в большинстве случаев отмечается стойкий эффект лечения в виде уменьшения объема узлов ЩЖ, обусловленный замещением тироцитов соединительнотканными структурами с большим количеством коллагена. Также факторами, стимулирующими процессы локального фиброза, являются аморфные массы и фрагменты стекла и обмотки световодов. Наряду с этим обнаруживаются зоны живых жизнеспособных тиреоцитов, что может быть причиной повторного роста узлов ЩЖ. Гарантией долгосрочного положительного лечебного эффекта метода может быть лишь строгое следование показаниям и режимам выполнения ИЛФ.



