Первичная культура клеток представляет собой клеточную линию, выделенную из интересующей родительской ткани. Главным преимуществом использования ПКК при проведении доклинических исследований (ДКИ) является большая схожесть с родительской тканью по сравнению с паспортизированными клеточными линиями, которые в результате многочисленных процедур субкультурирования приобретают отличные от родительской ткани молекулярно-генетические характеристики [1-3]. В ряде работ продемонстрированы различия в результатах in vitro исследований цитотоксических эффектов известных препаратов в отношении стандартных культур опухолевых клеток различного происхождения [4-6]. Получение первичных клеточных линий для использования в ДКИ как на этапе in vitro, так и на этапе in vivo может рассматриваться в качестве стратегии повышения достоверности получаемых результатов.
В настоящее время известны две основные стратегии получения первичных клеточных линий. Главные отличия в протоколах относятся к методам дезинфекции фрагментов свежерезецированной опухолевой ткани и использованию различных питательных сред, оптимальных как для получения клеточной линии, так и для последующей культивации [7]. Использование метода прямой эксплантации активно применяется в экспериментах по получению клеточных линий рака слизистой оболочки щек и десен, однако трудности, связанные с обработкой многослойного образца, приводят к контаминации вирусными и бактериальными агентами и невозможности последующего использования при перевивке лабораторным животным [8]. Эффективность использования метода ферментативной сегрегации при получении первичной клеточной линии рака слизистой оболочки органов ротовой полости (РСООРП) была продемонстрирована Klingbeil M. и коллегами в 2009 году. В качестве критериев сравнительной оценки описанных методов авторами были использованы: формирование колоний, продолжительность жизни культивируемых клеток и время образования монослоя при культивации в сходных условиях. Было продемонстрировано, что ферментативный метод обеспечивает наилучшие результаты для первичной культуры кератиноцитов полости рта человека по сравнению с методом прямого эксплантата [9].
В условиях повышения роста заболеваемости и смертности РСООРП особое значение приобретает необходимость проведения ДКИ средств, потенциально обладающих противоопухолевым эффектом [10]. Резистентность к цисплатину, являющемуся препаратом первой линии химиотерапии, долгое время остается серьезной проблемой, препятствующей лечению больных РСООРП. Альтернативные методы медикаментозного лечения препаратами платины демонстрируют меньшую эффективность по сравнению с цисплатином в той же дозировке [11]. В связи с этим целью настоящего исследования явилось получение и характеристика чувствительности первичных клеточных линий РСООРП и характеристика их чувствительности в отношении цисплатина.
Материалы и методы исследования
Характеристика доноров опухолевого материала
Для получения первичных клеточных линий проводили интраоперационный забор опухолевого материала от трех пациентов с поражением нижней челюсти в результате продолженного роста РСООРП. От каждого пациента было получено письменное согласие на передачу биологического материала. Критериями исключения пациентов являлись начальная стадия без поражения подлежащих костных структур, наличие сопутствующих заболеваний вирусной этиологии, ВПЧ отрицательный статус.
Общая характеристика доноров представлена в таблице.
Характеристика доноров опухолевого материала
|
Номер пациента |
Пол |
Возраст |
Курение |
Стадия |
Точка взятия материала |
|
|
№ 1 |
Муж |
72 |
Нет |
Т3N0M0 |
Распространение опухолевой инфильтрации по слизистой оболочке дна полости рта. Близость края опухоли к нижней челюсти |
Граница пораженных костной и мягкой тканей. Альвеолярный отросток |
|
№ 2 |
Муж |
69 |
Нет |
Т3N1bM0 |
Распространение опухоли на альвеолярный отросток нижней челюсти с костной деструкцией |
Мягкие ткани, окружающие альвеолярный отросток |
|
№ 3 |
Муж |
64 |
Да |
Т3N2bM1 |
Распространение опухоли на кость нижней челюсти с деструкцией |
Мягкие ткани, окружающие тело нижней челюсти |
Точкой сбора образцов для всех пациентов являлись мягкие ткани, окружающие пораженные участки кости. Объем донорского образца составлял 7*7*7 мм3. Свежерезецированный опухолевый материал помещали в 5 мл среды DMEM (Thermo Fisher Scientific, GibcoTM), после чего приступали к процедуре выделения клеточных линий.
Получение первичных клеточных линий
Получение первичных клеточных линий проводили согласно стандартному протоколу.
Для удаления сгустков крови и некротизированных тканей опухолевые фрагменты отмывали в среде DMEM (Thermo Fisher Scientific, GibcoTM), после чего проводили обработку донорского материла путем инкубации в растворе стрептомицина (ОАО «Биохимик», Россия) в концентрации 100 мкг/ мл. Среду удаляли и проводили измельчение ткани скальпелем до получения однородной массы. Процедуру ферментативной сегрегации проводили путем инкубации в присутствии трипсина при 37°C в течение 1 часа при постоянном перемешивании. Для разделения образовавшихся скоплений клеток использовали 0,25% трипсин-ЭДТА (Thermo Fisher Scientific, GibcoTM). Для нейтрализации ферментативной активности использовали среду для культивации. Полученные клеточные суспензии культивировали в DMEM с 10% эмбриональной бычьей сывороткой (Thermo Fisher Scientific, GibcoTM) и 1% клатримицином («ДАЛЬХИМФАРМ», Россия). Инкубацию клеток осуществляли при 37°C с содержанием CO2 5% (Thermo scientific, США). Смену среды для культивации осуществляли каждые 24 часа. Визуализацию полученных клеточных суспензий осуществляли с помощью инвертированного микроскопа (Leica, Германия). Подсчет клеток осуществляли в камере Горяева согласно стандартному протоколу и окраске с помощью 0,4% трипанового синего (CORNONG, USA).
Оценка чувствительности к цисплатину
Оценку ответа полученных клеточных линий на стандартные химиопрепараты проводили с помощью анализа метаболической активности клеток с помощью модифицированного метода Мосмана (МТТ-тест) [12]. В качестве тестового цитотоксического препарата использовали цисплатин (Pharmachemie, Нидерланды). Выбор препарата проводили в соответствии с «клиническими рекомендациями по лечению злокачественных образований полости рта от 2020 года» [13].
Полученные первичные клеточные линии РСООРП высевали в 96-луночные планшеты плотностью 5×103 клеток/лунка и культивировали в клеточном инкубаторе в течение 24 часов при 37°C с содержанием CO2 5%. К клеткам добавляли цисплатин и проводили дальнейшую инкубацию (5% CO2, при 37°C) в течение 24 часов. После чего в лунки добавляли 50 мкл раствора МТТ (2 мг/мл), и планшеты дополнительно инкубировали в течение 2 ч при 37°C. Измерение поглощения проводили с помощью анализатора (Thermo Scientific Varioskan Flash, USA) при 540 нм.
Процент ингибирования клеточного роста рассчитывали по следующей формуле:
% клеточного ингибирования = 100 - [(At - Ab) / (Aс - Ab)] × 100,
где At = значение абсорбции тестируемого соединения, Ab = значение абсорбции холостого опыта (в качестве значения холостой пробы рассматривали оптическую плотность среды) и Ac = значение абсорбции контроля (в качестве значения контрольного образца рассматривали оптическую в лунках с клетками, не обработанными препаратом).
Начальное состояние живых клеток определяли оптической плотностью контрольных скважин. Кривые пролиферации клеток, зависящие от времени и плотности, были построены с использованием пакета Excel Microsoft (2019). Для определения показателя IC50 – полулетальной ингибирующей концентрации – использовали онлайн-калькулятор «Биоквест ААТ» (aatbio.com). Для оценки статистической значимости различий сравниваемых групп использовали тест ANOVA с применением критерия Тьюки для равных выборок. Различия считали достоверными при р <0,05.
Результаты исследования и их обсуждение
В настоящей работе с помощью метода ферментативной сегрегации были выделены первичные клеточные линии, полученные от трех больных раком слизистой оболочки дна полости рта с поражением подлежащих структур лицевого отдела черепа, в частности нижней челюсти. Полученные клеточные суспензии культивировали, регистрируя количество адгезированных и делящихся клеток. Результаты культивации на 24 и 48 часов после посева выделенных клеточных суспензий из свежерезецированных опухолевых фрагментов представлены на рисунке 1.

Рис. 1. Рост полученных клеток рака слизистой оболочки дна полости рта на 24 и 48 час
Примечание: КК1 – клеточная линий, полученная от донора № 1; КК2 – клеточная линия, полученная от донора № 2; КК3 – клеточная линия, полученная от донора № 3.
При определении темпов роста и формирования клеточного монослоя на этапе первого пересева культуры клеток отмечали тенденцию к снижению темпов роста после 48 часов культивации. Для оптимизации роста клеточных линий проводили процедуру 3-кратного пересева. Результаты четвертой процедуры пересева полученных клеточных линий РСООРП на 48 и 72 часа представлены на рисунке 2.

Рис. 2. Рост полученных клеточных линий рака слизистой оболочки дна полости рта на 48 и 72 час. 4-я процедура
При проведении оценки темпов роста полученных клеточных линий было выявлено, что КК3 характеризуется наиболее быстрым ростом и формированием монослоя. Как показано на рисунке 2, как на 48 часов, так и на 72 часа после процедуры пересева КК3 отличается большим процентом зарастания поля зрения по сравнению с КК1 и КК2. Причем темпы роста КК1 и КК2 были соизмеримы. Так, при проведении подсчета клеток в камере Горяева на 96-е сутки после пересева концентрация клеток КК3 составила 48 млн/1,5 мл против 29 млн/1,5 мл КК1 и 33 млн/1,5 мл КК2.
При изучении чувствительности КК1 к цисплатину в концентрациях от 1 до 30 мкг/мл наблюдался выраженный дозозависимый цитотоксический эффект, с наибольшим процентом клеточного ингибирования 77%. Однако в концентрациях от 35 до 45 мкг/мл наблюдалось статистически значимое повышение процента жизнеспособных клеток. Причем в наибольшей концентрации препарата процент клеточного ингибирования составил 61,5%. При определении показателя IC50 для цисплатина в отношении КК1 было выявлено, что в концентрации 20 мкг/мл процент жизнеспособных клеток составил 49,8%. В связи с этим был проведен анализ с помощью онлайн-калькулятора Quest Graph с использованием четырехпараметрической модели логистической регрессии. Полученный показатель IC50 составил 19,89 мкг/мл. Для визуализации характера наблюдаемых изменений показателя жизнеспособности КК1 в зависимости от концентрации цисплатина была построена кривая, представленная на рисунке 3.
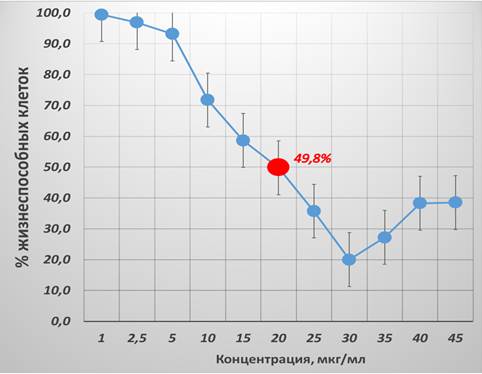
Рис. 3. Процент жизнеспособности опухолевых клеток линии КК1 после 24-часовой инкубации с цисплатином
При изучении чувствительности КК2 к цисплатину было выявлено дозозависимое снижение показателя жизнеспособности клеток в концентрации от 10 до 45 мкг/мл, причем наибольший процент клеточного ингибирования наблюдался в концентрации 45 мкг/мл, что составило 84,8%. В концентрациях менее 10 мкг/мл статистически значимого угнетения жизнеспособности КК2 обнаружено не было. При определении показателя IC50 для цисплатина в отношении КК2 было выявлено, что наиболее близкой точкой (44,7% жизнеспособности клеток) является концентрация 20 мкг/мл. В связи с этим также был проведен анализ с помощью онлайн-калькулятора Quest Graph. Полученный показатель IC50 составил 19,29 мкг/мл. Для визуализации характера наблюдаемых изменений показателя жизнеспособности КК2 в зависимости от концентрации цисплатина была построена кривая, представленная на рисунке 4.
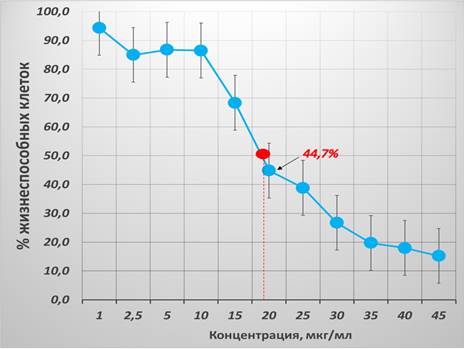
Рис. 4. Процент жизнеспособности опухолевых клеток линии КК2 после 24-часовой инкубации с цисплатином
При изучении чувствительности КК3 к цисплатину во всех изучаемых концентрациях наблюдался наиболее выраженный дозозависимый цитотоксический эффект, с наибольшим процентом клеточного ингибирования 82,9% при 45 мкг/мл. При определении показателя IC50 для цисплатина в отношении КК3 было выявлено, что наиболее близкой точкой (48,6% жизнеспособности клеток) является концентрация 25 мкг/мл. Полученный показатель IC50 для цисплатина в отношении КК3 составил 24,72 мкг/мл. Для визуализации характера наблюдаемых изменений показателя жизнеспособности КК3 в зависимости от концентрации цисплатина была построена кривая, представленная на рисунке 5.
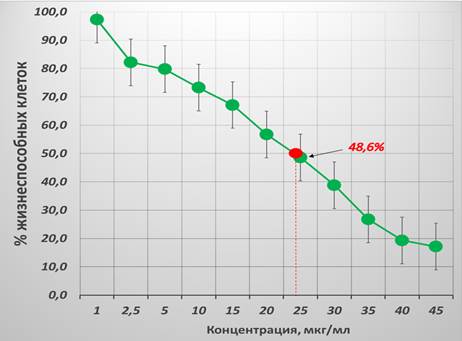
Рис. 5. Процент жизнеспособности опухолевых клеток линии КК3 после 24-часовой инкубации с цисплатином
Использование первичных клеточных линий для моделирования злокачественного процесса представляется оптимальным в связи с более точной имитацией особенностей клинического течения заболевания у человека. Схожесть первичной клеточной линии с родительской тканью позволяет создавать модели, подходящие для проведения оценки цитотоксических эффектов как стандартных препаратов, так и новых субстанций, потенциально обладающих противоопухолевым действием [14]. Вариабельность темпов и характера роста первичных клеточных линий рака при субкультивации in vitro является серьезной проблемой использования для проведения ДКИ. В настоящей работе было проведено выделение трех клеточных линий РСООРП от пациентов с поражением нижней челюсти. При культивации в стандартных условиях для трех клеточных линий были показаны статистически значимые отличия темпов роста. Так, клеточная линия КК3, полученная от донора со стадией Т3N2bM1, характеризовалась агрессивным ростом in vitro по сравнению с линиями, выделенными из опухолевого материла пациентов со стадиями Т3N0M0 и Т3N1bM0.
Стандартной методикой описания чувствительности клеток и их метаболических особенностей является МТТ-тест. Первичные линии способны отражать резистентность к химиопрепаратам, встречающуюся при проведении медикаментозной терапии и не наблюдаемую при проведении исследований на паспортизованных культурах in vitro. Так, для цисплатина, являющегося широко используемым химиотерапевтическим средством, показан рост резистентности. Однако механизм устойчивости к цисплатину, проявляющейся в ряде случаев РСООРП, остается неясным [15]. Нами было показано, что выделенные клеточные линии характеризуются чувствительностью к цисплатину, но степень чувствительности была различной. Наибольшей чувствительностью к цисплатину в концентрации 45 мкг/мл обладала КК2. В то же время для КК1 был показан наибольший процент клеточного ингибирования при воздействии 30 мкг/мл цисплатина в течение 24 часов, что составило 77%. Дозозависимый цитотоксический эффект цисплатина был характерен только для КК3. При этом при определении показателя IC50 наиболее чувствительной являлась КК2, что составило 19,29 мкг/мл.
В работах Nakamura M. и коллег, напротив, были созданы две первичные клеточные линии плоскоклеточной карциномы слизистой полости рта, одна из которых обладала резистентностью к цисплатину [16]. Клеточная линия, характеризовавшаяся чувствительностью к препарату, демонстрировала процент клеточного ингибирования, отличный от значения, полученного в проведенном нами исследовании. Так, было выявлено, что значение IC50 для чувствительной линии составило ≈ 1 мкг/мл. Полученное Nakamura M. значение в 19,3 раза меньше значения IC50, найденного для наиболее чувствительной из выделенных нами линий – КК2. Причем для резистентной линии, полученной авторами, полулетальная ингибирующая концентрация составила ≈ 6,5 мкг/мл, что статистически значимо отличается от значений, полученных в настоящем исследовании. Таким образом, выделенные нами клеточные линии характеризуются меньшей чувствительностью к цисплатину по сравнению с резистентной линией РСООРП, выделенной Nakamura M. и коллегами.
В работе тех же авторов также был проведён аналогичный эксперимент по получению первичной клеточной линии РСООРП, однако материалом для получения клеточных культур являлись образцы умеренно дифференцированной плоскоклеточной карциномы нижней десны [17]. Авторами также были созданы две клеточные линии, одна из которых обладала меньшей чувствительностью к цисплатину. Так, значение IC50 для чувствительной линии составило 0,58 мкг/мл против 4,4 мкг/мл для резистентной линии, устойчивость которой к цисплатину была в 7,5 раз выше. Данные, полученные в результате проведённого нами исследования, также отличаются от полученных Nakatani K. и коллегами. Чувствительность выделенной в настоящей работе КК2 отличается от резистентной линии Nakatani K. в 4,4 раза.
Однако цитотоксическое действие цисплатина, оказываемое в отношении выделенных первичных клеточных линий, было сходно с паспортизованными линиями злокачественных образований других нозологий. Так, в работе Mirmalek S.A. и соавторов был изучен эффект цисплатина на клеточную линию рака молочной железы MCF-7 и показаны результаты, сходные с полученными в настоящем исследовании [18]. При определения цитотоксического действия цисплатина на жизнеспособность MCF-7 авторами было выявлено, что LD50 для цисплатина при воздействии в течение 24 часов составило 20 мкг/мл, что статистически значимо не отличается от полученных нами результатов. Наблюдаемое сходство значений может быть связано с тем, что для клеточных линий КК1, КК2 и КК3 и MCF-7 родительской тканью являлись опухоли, характеризующиеся продолженным ростом в окружающие ткани и метастазированием в лимфатические узлы. Происхождение данных линий и агрессивность течения заболевания у доноров опухолевого материала являются причиной меньшей чувствительности клеточных линий к цисплатину по сравнению с линиями, полученными в работах Nakamura M. и Nakatani K., для которых донорами являлись больные РСООРП с локализованным злокачественным процессом.
Заключение
В результате настоящего исследования были получены три первичные клеточные линии рака слизистой оболочки органов ротовой полости от трех пациентов с III стадией заболевания и различной степенью поражения подлежащих структур. При определении чувствительности клеточных линий была выявлена различная степень чувствительности к цисплатину. Причем для клеточной линии, выделенной от пациента с наиболее распространённым процессом (Т3N2bM1), была характерна большая устойчивость к препарату при IC50, равной 24,72 мкг/мл.



