Пролапс тазовых органов и стрессовое недержание мочи регистрируют у 40–50% женщин в постменопаузе, это затрагивает 200 млн человек во всем мире. Ургентная инконтиненция составляет 22–36%, смешанная – 29%, на долю других типов приходится от 5% до 10%. Стандартные методы лечения часто обеспечивают симптоматическое облегчение, но не нацелены на основную этиологию и демонстрируют огромную вариабельность результатов от пациента к пациенту, ограниченный успех и осложнения, связанные с процедурами [1, 2].
Операциями выбора при стрессовой инконтиненции считаются различные варианты петлевых пластик или слинговых (петлевых) операций. Суть всех слинговых операций заключается в создании надежного «механизма закрытия», который не предусматривает восстановления поврежденного сфинктерного аппарата, а ведет к так называемому удержанию мочи путем компрессии мочеиспускательного канала [3]. Формирование слинга (петли) вокруг шейки мочевого пузыря и проксимальной уретры также восстанавливает нормальное анатомическое положение последних. В настоящее время для изготовления петель все шире применяются синтетические материалы. Этот метод дает хорошие результаты более чем в 80% случаев, основанные как на субъективных, так и на объективных оценках [4]. Среди недостатков синтетических петель следует отметить возможность отторжения и частые инфекционные осложнения [5].
Клеточные технологии позволяют предложить решения на будущее как при первичной установки слингов, так и для лечения осложнений этой процедуры. Использование аутологичных клеток для покрытия поверхностей имплантатов представляет собой многообещающее средство и для ослабления реакции инородного тела, и для снижения остроты воспаления [6]. Адсорбированные мультипотентные стромальные клетки (МСК) жировой ткани на волокна полигликолевой кислоты образуют каркас с формой, имитирующей комплекс слингов. С увеличением времени культивирования сконструированная ткань показывает значительное улучшение биомеханических свойств, также были найдены зрелые структуры тканевого коллагена [5]. Кроме того, плохая васкуляризация является ключевым ограничением для долгосрочного приживления больших искусственных конструкций в регенеративной медицине, а значительный ангиогенез может быть индуцирован адгезией МСК на инородном продукте [7, 8].
В связи с вышеизложенным была поставлена цель исследования – изучить возможность применения in vivo МСК, адсорбированных на полимерных материалах, применяемых в урологии.
Материал и методы исследования
Эксперименты проведены на крысах инбредной линии Wag весом 180–200 г возрастом 6 месяцев, животные были получены и содержались в виварии Института цитологии и генетики СО РАН (г. Новосибирск), соответствующем категории SPF. Крыс содержали при естественном освещении и неограниченном доступе к корму и воде. Все манипуляции не были связаны с причинением боли животным и проведены с соблюдением ГОСТ 33215-2014 (Руководство по содержанию и уходу за лабораторными животными).
Крысы получали ингаляционное эфирное обезболивание. Дыхание животных во всех случаях было спонтанным. Хирургические вмешательства по имплантации исследуемых материалов, связанные с повреждением тканей, были выполнены в условиях чистой операционной с соблюдением правил асептики и антисептики, имплантируемые материалы были приобретены в аптечной сети и были стерильны.
Получение, культивирование и характеристики аутологичных мезенхимальных МСК костномозгового происхождения (ММСК)
Методы выделения, культивирования, определения физических, морфологических, фенотипических признаков и дифференцировочного потенциала ММСК соответствовали литературным рекомендациям [9, 10]. Клеточные мембраны ММСК были окрашены раствором Vybrant® CM-Dil (Thermo Fisher Scientific, USA) [9, 10] согласно инструкции производителя. Непосредственно перед операцией стерильный фрагмент имплантируемого изделия погружали в суспензию ММСК на 2 часа для пассивной адсорбции в связи с тем, что живые клетки, как и клетки перевиваемых клеточных культур, из взвеси прикрепляются практически к любому твердому субстрату [11]. Такой срок адсорбции является достаточным для формирования монослоя на большинстве материалов.
Ход хирургического вмешательства, группы животных, характеристика имплантируемых изделий и сроки забора материала при изучении влияния ММСК на имплантацию полимеров
Так как очень многие имплантируемые в организм урологических пациентов материалы созданы на основе полипропилена, было проведено исследование тканей вокруг имплантированных под кожу в правом лопаточном регионе фрагмента проленовой лигатуры или сетки Parietene™ ProGrip™ без и с адсорбированными на поверхности ММСК.
Имплантировали стерильный Пролен (W8844 12 ПРОЛЕН 3/0, 90 см, синий, диаметр 0,2 мм с атравматической иглой СС-25 26 мм ½ с) и фрагменты сетки Parietene™ ProGrip™ (стерильный сетчатый имплантат для внутреннего протезирования 15х9 см (6"х3,5"), Tyco Healthcare Group LP, France). Для подкожной имплантации полимеров производили разрез кожи по средней линии спины в области шеи от основания черепа до лопаток длиной 1–2 см. Тупым способом формировали слепой канал длиной 1,5–2 см в сторону правой лопатки. В данный карман помещали имплантат с или без адсорбированных ММСК [12, 13]. Послеоперационные раны ушивали непрерывными швами, кожу и кожные швы обрабатывали спиртовым раствором йода. Крыс декапитировали через 1 неделю; 1; 6 и 12 месяцев после операции. Методами световой микроскопии с применением флюоресценции изучали ткани рядом с полимерами. В каждой группе с имплантацией проленовой нити было по 11 животных, сетки Parietene™ ProGrip™ – по 16. Всего в экспериментах было использовано 216 крыс.
Образцы тканей для последующего изучения фиксировали в 4%-ном растворе забуференного нейтрального параформальдегида (рН 7,4) не менее 1 суток, обезвоживали и просветляли в реактиве «Изопреп» (БиоВитрум, Россия), заключали в гистопласт. Неокрашенные гистологические срезы толщиной 5–7 мкм после удаления гистопласта исследовали в режиме люминесценции микроскопа Axioimager M1 (Carl Zeiss, Germany) при увеличении до 1200 раз с фильтрами Alexa Fluor 488 (диапазон возбуждения 450–490 нм, диапазон регистрации 515-∞ нм) или для родамина (Rhod – диапазон возбуждения 540–552 нм, диапазон регистрации 575–640 нм). При получении микрофотографий использовали автоматическую экспозицию. В процессе совмещения изображений с применением фильтров Alexa 488 и для родамина можно получить зеленый и красный (или оранжевый и желтый) цвет в зависимости от преобладания интенсивности свечения при том или ином фильтре. Зеленый цвет дает более яркая флюоресценция при использовании фильтра Alexa 488, красный цвет – на фоне применения родаминового фильтра, желтый и его оттенки получаются в результате смешения зеленого и красного цветов в той или иной пропорции [9, 10].
Результаты исследования и их обсуждение
У животных с имплантацией полимеров без предварительной адсорбции ММСК в месте хирургического вмешательства отсутствовали объекты с преимущественной флюоресценцией (красной) при установке родаминового фильтра.
При изучении результатов имплантации проленовой мононити с адсорбированными ММСК, мембраны которых были окрашены Vybrant® CM-DiI, с использованием методов люминесцентной микроскопии через 1 неделю в крупных клетках тканей рядом с инородным телом были обнаружены многочисленные включения разных размеров и форм с очень интенсивной флюоресценцией на фоне применения фильтра для родамина. Иногда в крупном клеточном элементе присутствовал один достаточной большой овальный фрагмент с красной люминесценцией. В других случаях в цитоплазме содержались многочисленные мелкие объекты с таким же ярким свечением (рис. 1а).
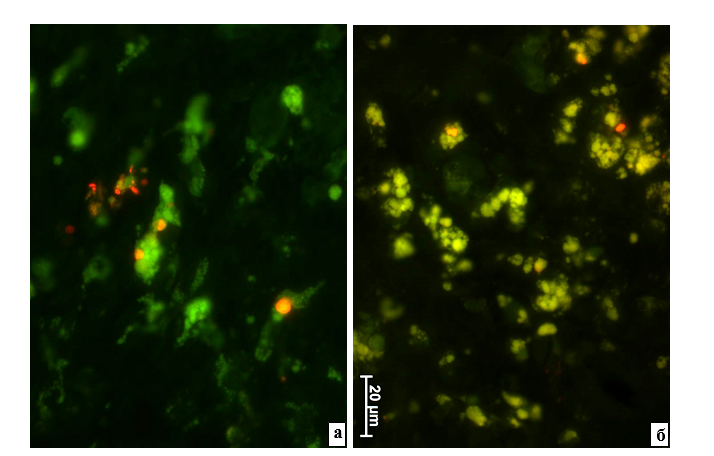
Рис. 1. Ткани рядом с проленовой мононитью на 1-й неделе (а) и через 1 месяц (б) после имплантации с адсорбированными на поверхности ММСК. Результат компьютерного совмещения изображений, полученных при изучении неокрашенных срезов в люминесцентном режиме микроскопа с применением фильтров Alexa 488 и для родамина. а – Отдельные клеточные элементы содержат множество включений разных размеров и форм, с четкими краями и очень ярким свечением при установке родаминового фильтра. б – Только в небольшом числе клеток содержатся единичные включения разных форм и размеров, с четкими краями и очень интенсивной флюоресценцией при использовании родаминового фильтра
Наиболее вероятно, что крупные клеточные элементы, содержащие флюоресцирующие включения, являются макрофагами, а объекты с люминесценцией при использовании родаминового фильтра – детрит введенных ММСК с меченными Vybrant® CM-DiI мембранами. Большинство введенных ММСК очень быстро погибает при введении в ткани, особенно сразу после хирургического вмешательства [9, 10, 14, 15]. Во-первых, резко меняются условия окружающей среды этих клеточных элементов. Во-вторых, на них действуют агрессивные факторы раневого отделяемого [14], даже в условиях асептического воспаления. Следовательно, большая часть введенных ММСК очень быстро погибает и разрушается, детрит поглощается фагоцитами и, не исключено, оказывает на них определенное влияние.
Спустя 1 месяц после внедрения проленовой лигатуры с адсорбированными ММСК были найдены только редко встречающиеся единичные объекты с более яркой люминесценцией при использовании фильтра для родамина (рис. 1б). К этому сроку все внесенные в организм на поверхности пролена ММСК, по-видимому, уже были разрушены и элиминированы. Также, скорее всего, к этой дате исчезло и влияние ММСК, оказываемое на иммунокомпетентные клетки реципиента и воспалительный процесс. Следует отметить, что другие исследователи также отмечают гибель и практически полную элиминацию введенных извне ММСК из организма крыс, в том числе и замещение этих клеточных элементов из структур, созданных при их участии и в результате дифференцирования, к 4–5-й неделям, то есть через 1 месяц [9, 10].
При исследовании методом флюоресцентной микроскопии тканей рядом с сеткой Parietene™ ProGrip™ на 1-й неделе после имплантации с адсорбированными ММСК, меченными Vybrant® CM-DiI, в некоторых клеточных элементах были найдены включения с более интенсивным свечением при установке фильтра для родамина. Эти включения были мелкими и содержались только по несколько штук в отдельных крупных клетках, по-видимому, фагоцитах (рис. 2а). Вероятность макрофагального происхождения таких клеточных элементов была подробно рассмотрена выше.
К 1-му месяцу после введения сетчатого материала с ММСК только в единичных клетках было найдено небольшое число мелких включений со слабым преимущественным свечением на фоне применения родаминового фильтра (рис. 2б). Следовательно, к этому сроку не только все введенные ММСК уже разрушены, но и из места имплантации сетки с адсорбированными ММСК практически элиминирован и детрит этих ММСК, что совпадает с литературными данными о быстрой деструкции введенных извне ММСК [9, 10, 14, 15] и исчезновении их дебриса к 4–5-й неделям после трансплантации [9, 10]. Элиминация ММСК осуществляется посредством макрофагального фагоцитоза; если ММСК были окрашены флюоресцентным красителем, то макрофаги накапливают эту метку в своих лизосомах в большой концентрации и за счет этого приобретают способность к собственной соответствующей люминесценции [9, 10].
Через 6 и 12 месяцев после внедрения МСК структуры с более интенсивным свечением в условиях использования фильтра для родамина не были найдены ни мононити, ни сетки с адсорбированными ММСК, меченными люминесцентным красителем Vybrant® CM-DiI.
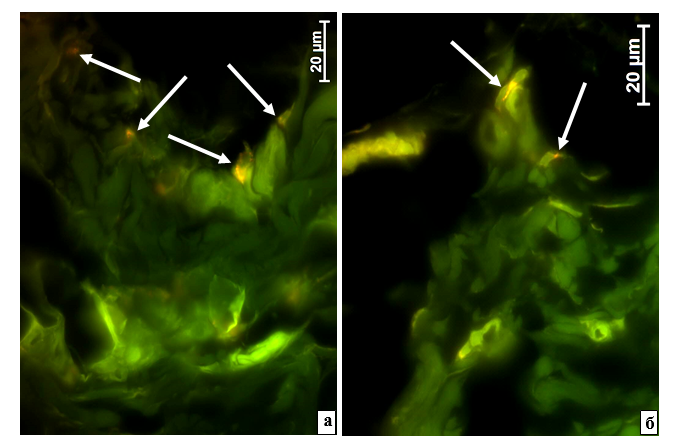
Рис. 2. Ткани возле полимерной сетки спустя 1 неделю (а) и 1 месяц (б) после внедрения с адсорбированными на поверхности ММСК. Результат компьютерного совмещения изображений, полученных при изучении неокрашенных срезов в люминесцентном режиме микроскопа с применением фильтров Alexa 488 и для родамина. а – Отдельные клеточные элементы содержат включения с более ярким свечением при установке родаминового фильтра. б – В некоторых клетках содержатся небольшие единичные включения с более интенсивной флюоресценцией при использовании родаминового фильтра
Заключение
Возможна пассивная адсорбция МСК на полипропиленовых материалах, применяемых в урологической практике, а также при имплантации этих полимеров вместе с МСК in vivo для влияния на процессы приживления внедряемых инородных тел. Однако практически все адсорбированные МСК подвергаются деструкции в тканях места имплантации спустя 1 неделю после операции, а к 1 месяцу из тканей полностью элиминируется и детрит этих МСК. Таким образом, все эффекты адсорбции МСК на поверхности полимерных материалов должны быть транзиторными и ограничиваться только 1 неделей, далее влияние клеточных технологий на воспаление, васкуляризацию и структурную организацию тканей, окружающих инородное тело, скорее всего, будет незаметным.



