Известно, что липиды включают жирные кислоты, кетоновые тела, триацилглицерины, фосфолипиды и сфинголипиды, эйкозаноиды, холестерин, соли желчных кислот, стероидные гормоны и жирорастворимые витамины, которые играют самые разные роли в биологии человека. Основным стероидом является холестерин, входящий в состав бислойных мембран клеток, а также используется в биосинтезе стероидных гормонов, витамина D, желчных кислот и солей. При окислении холестерина образуются оксистерины, являющиеся регуляторными факторами обмена холестерина [1].
Процесс внутри- и внеклеточного транспорта холестерина, оксистеринов и фосфолипидов обеспечивается белками-переносчиками. Так, внутри клетки этот процесс реализуется при помощи оксистерин-связывающих белков (oxysterol-binding proteins, OSBP) и OSBP-связанных белков (OSBP-related proteins, ORP), тогда как внеклеточный транспорт обеспечивается процессом ферментативного сульфатирования члена 1 семейства 2B сульфотрансфераз (sulfotransferase Family 2B member 1, SULT2B1) или активной экскрецией белками-транспортерами АТФ-связывающих кассет (ATP-binding cassette, ABC) [2; 3].
Другим регулятором окисления жирных кислот в печени является a-рецептор, активируемый пролифератором пероксисом (peroxisome proliferator-activated receptor a, PPAR- a).
До настоящего времени вопрос о группе генов, которые регулируют PPAR- a, а также активируются этим рецептором, до конца не изучен. Среди этих генов ACACA, FAS, SREBP1, FADS1, DGAT1, ABCA1, PLTP, ABCB4, UGT2B4, SULT2A1, Pnpla2, Acsl1, Slc27a4, многие гены Acot и другие [4; 5].
Установлено, что в геноме человека имеются около 50 генов, которые кодируют суперсемейство АТФ-связывающих молекул (ATP-binding cassette, ABC), включая 7 подсемейств от ABCA до ABCG. В 1-ю группу включены семь генов в шести хромосомах, ABCA1 (9q22-q31), ABCA2 (9q34), ABCA3 (16p13,3), ABCA4 (1p22), ABCA7 (19p13,3), ABCA11 (4p16), ABCA12 (2q35), а во 2-ю – пять генов (ABCA5, ABCA6, ABCA8, ABCA9 и ABCA10) в кластере на хромосоме 17q24 [6].
Имеются данные о том, что мутации в генах, кодирующих АВС-транспортеры, определяют развитие ряда болезней человека. Так, выявлено, что одни мутации в гене ABCA1 связаны с болезнью Танжера, другие – увеличивают риск инфаркта миокарда, развития атеросклероза, семейной гиперхолестеринемии, а также увеличивают частоту системных и местных воспалительных реакций [7; 8]. Мутации в генах ABCG, ABCG5 и ABCG8 вызывают ситостеролемию. Также было установлено, что на уровень липидов в плазме крови оказывают влияние 5 полиморфизмов в генах ABCG5 и ABCG8 [9; 10].
Известно, что патогенез акне многофакторный и включает повышенную активацию сально-волосяных фолликулов (СВФ) под воздействием гиперандрогении, гиперсекрецию себума и патологическую фолликулярную кератинизацию, а также формирование воспалительной реакции. Установлено, что избыточная продукция кожного сала сопровождается изменением его липидного состава, в частности уменьшением количества незаменимых жирных кислот, включая линоленовую кислоту, и дисбалансом антиоксидантных свойств [11].
С учетом участия липидов в патогенезе акне актуальным является изучение механизмов внутри- и внеклеточного метаболизма липидов и их транспорта для обеспечения кислородного метаболизма клетки, включая определение патогенетической роли регуляторных генетических факторов.
Целью настоящего исследования было определение и анализ вариантов нуклеотидной последовательности генов АТФ-связывающих белков кислородного метаболизма ABCA1, ABCB7, ABCC8, ABCG5, ABCG8 у пациентов с тяжелой формой акне.
Материалы и методы исследования
Для достижения поставленной цели в 2017-2020 гг. проведено проспективное открытое нерандомизированное одноцентровое исследование.
Участники исследования. Под нашим наблюдением в клинических условиях на кафедре кожных болезней и косметологии ФДПО ФГАОУ ВО «РНИМУ им. Н.И.Пирогова» МЗ РФ находились 50 пациентов основной группы и 20 участников группы сравнения (всего 70 человек) в возрасте от 15 до 46 лет (медиана – 22,1 года). Размер выборки предварительно не рассчитывался. Исследование выполнено с информированного согласия всех пациентов, включенных в исследование, и одобрено этическим комитетом ФГАОУ ВО «РНИМУ» МЗ РФ в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации «Этические принципы проведения научных медицинский исследований с участием человека» с поправками 2008 г., протоколом Конвенции Совета Европы о правах человека и биомедицине 1999 г., и в соответствии со статьями 20, 22, 23 Федерального закона «Об основах охраны здоровья граждан в Российской Федерации» от 21 ноября 2011 г. № 323-ФЗ (ред. от 21.07.2014).
В основную группу были включены 50 пациентов (29 мужчин и 21 женщина) с тяжелой формой акне. Возраст на момент исследования варьировал от 15 до 46 лет (медиана – 23,2 года). Группу сравнения составили 20 условно здоровых лиц (13 мужчин и 7 женщин) от 16 до 40 лет (медиана – 19,4 года). Таким образом, основная группа и группа сравнения были сопоставимы по половозрастным характеристикам (p>0,05).
Молекулярно-генетическая диагностика. Молекулярно-генетическая диагностика была проведена всем 50 пациентам основной и 20 условно здоровым лицам группы сравнения методом высокопроизводительного секвенирования ДНК – секвенирование «нового поколения» (next-generation sequencing, NGS) в лаборатории молекулярной биологии ФГБУ «НМИЦ ДГОИ им. Дм. Рогачева» МЗ РФ. Геномная ДНК была выделена из образцов цельной крови обследованных больных с использованием набора CellSep Advanced Kit. (DiaSorin Ireland Ltd., Ирландия) согласно инструкции производителя.
Для оценки популяционных частот выявленных вариантов использованы данные международного проекта gnomAD Exomes (ExAC) для экзонных вариантов и базы gnomAD Genomes для интронных вариантов. Для компьютерной оценки патогенности найденных миссенс-вариантов применяли программы предсказания патогенности замен аминокислот (SIFT, PolyPhen-2, PROVEAN, UMD Predictor). Для компьютерного предсказания эффекта изменений в сайтах сплайсинга или прилежащих к сайту сплайсинга участках использованы программы MutationTaster, Human Splicing Finder и NNSplice.
Результаты обработаны методами вариационной статистики и корреляционного анализа с использованием программного обеспечения XLSTAT2019. Соответствие распределения количественных показателей нормальному закону оценивали с помощью критерия Шапиро–Уилка. В случае распределения показателя, отличного от нормального, он описывался медианой (Ме) и верхним и нижним квартилями [Q1; Q3]. Значимость различия в независимых выборках оценивали посредством критерия Манна–Уитни. Для оценки связи качественных и порядковых признаков строили таблицы сопряженности и на их основе рассчитывали критерий χ2 Пирсона.
Для оценки факторов риска рассчитывали отношение шансов (odds ratio, OR). OR – критерий отношения шансов, отражающий относительный риск развития заболевания при определенном генотипе по сравнению с группой контроля. Полученные данные интерпретировали: если OR=1, то шанс для основной группы равен шансу для контрольной группы; если OR>1, то шанс для основной группы больше шанса для контрольной группы; если OR<1, то шанс для основной группы меньше шанса для контрольной группы. Предполагаемый фактор риска является значимым (т.е. с большой вероятностью вызовет наступление события, например болезнь), если OR больше единицы.
Исследование функционального значения генов АТФ-связывающих белков кислородного метаболизма в биологических путях организма выполнено с помощью онлайн-программы [12] с использованием базы данных STRING [13] известных и прогнозируемых взаимодействий, включающих прямые и функциональные ассоциации. Программа осуществляет математическое прогнозирование на основании баз данных Genomic Context Predictions, High-throughput Lab Experiments, (Conserved) Co-Expression, Automated Textmining. База данных STRING в настоящее время охватывает 24 584 628 белков от 5 090 организмов [12; 13]. Статистически значимыми различия считали при р<0,05.
Результаты исследования и их обсуждение
Все пациенты основной группы страдали тяжелой формой акне, которая клинически характеризовалась множественными открытыми и закрытыми комедонами, воспалительными глубокими папулами, пустулами, узлами, сливающимися в конгломераты, атрофическими рубцами, поствоспалительными застойно-синюшными пятнами с преимущественной локализацией на коже лица, спины и груди. Кожа в очагах поражения имела сальный вид, субъективные ощущения характеризовались от незначительной до умеренной болезненности, усиливающейся при движении и пальпации.
В исследуемой группе нами была проведена стратификация изученных однонуклеотидных полиморфизмов (single nucleotide polymorphism, SNP) в экзонах (несинонимичные замены), в интронах, в 5’UTR и upstream-регионе по их регуляторной значимости на кодируемые генами АТФ-связывающих белков кислородного метаболизма.
Характеристика полиморфных локусов генов ABCA1, ABCB7, ABCG5, ABCG8 в экзонах (несинонимичные замены) у больных акне представлена в таблице 1. В гене ABCC8 SNPs в экзонах (несинонимичные замены) нами выявлены не были.
Таблица 1
Характеристика полиморфных локусов генов ABCA1, ABCB7, ABCG5, ABCG8 в экзонах у больных акне
|
Ген |
Позиция (hg19) |
Полиморфный локус (SNP) |
Вид и позиция замены ДНК |
p-value (z-тест для пропорций) |
OR (95% доверительный интервал), уровень значимости |
|
ABCA1 |
9:107556776 |
rs146292819 |
exon40:c.A5398C:p.N1800H |
0,113 |
0,13 (0,005-3,284), p=0,216 |
|
ABCA1 |
9:107562804 |
rs2230808 |
exon35:c.A4760G:p.K1587R |
0,157 |
1,72 (0,807-3,683), p=0,159 |
|
ABCA1 |
9:107589238 |
rs138880920 |
exon16:c.G2328C:p.K776N |
0,112 |
0,13 (0,005-3,285), p=0,216 |
|
ABCA1 |
9:107602667 |
-(.) |
exon9:c.G947A:p.G316E |
0,526 |
1,22 (0,049-30,606), p=0,903 |
|
ABCA1 |
9:107620867 |
rs2230806 |
exon7:c.G656A:p.R219K |
1,392 |
0,18 (0,083-0,409), p=0,00003 |
|
ABCB7 |
X:74293709 |
rs147584361 |
exon6:c.G818A:p.R273Q, |
0,367 |
2,06 (0,097-43,775), p=0,644 |
|
ABCG5 |
2:44065090 |
rs6756629 |
exon2:c.C148T:p.R50C |
0,119 |
0,37 (0,101-1,350), p=0,131 |
|
ABCG8 |
2:44066247 |
rs11887534 |
exon1:c.G55C:p.D19H |
0,119 |
0,37 (0,101-1,350), p=0,131 |
|
ABCG8 |
2:44104925 |
rs6544718 |
exon13:c.T1895C:p.V632A |
0,571 |
1,34 (0,512-3,364), p=0,571 |
Как представлено в таблице 1, по результатам расчета OR выявлено, что 2 SNPs из 5 SNPS гена ABCA1 в экзонах: rs2230808, OR=1,72; -(.), OR=1,22; 1 SNPS гена ABCB7 в экзоне (rs147584361, OR=2,06); 1 SNPS гена ABCG8 (rs6544718, OR=1,34), вероятно, ассоциированы с тяжелым течение акне; тогда как 2 SNPs гена ABCA1, 1 SNPS гена ABCG5 и 1 SNPS гена ABCG8 в экзонах, вероятно, имеют протективный эффект в отношении развития акне (OR<1). При этом достоверное протективное действие в развитии тяжелой формы акне определяет SNPs гена АВСА1 (rs2230806, OR=0,18, ДИ 0,083-0,409; p=0,00003). Все выявленные SNPS генов ABCA1 в экзонах впервые описаны нами при акне, включая 1 SNPs гена ABCA1, ранее не описанный ни при одном заболевании.
Характеристика полиморфных локусов генов ABCA1, ABCB7, ABCC8, ABCG5, ABCG8 в интронах у больных акне представлена в таблице 2.
Таблица 2
Характеристика полиморфных локусов генов ABCA1, ABCB7, ABCC8, ABCG5, ABCG8 в интронах у больных акне
|
Ген |
Полиморфный локус (SNP) |
Позиция (hg19) |
Вид и позиция замены (при наличии) ДНК |
p-value (z-тест для пропорций) |
OR (95% доверительный интервал), уровень значимости |
|
ABCA1 |
-(.) |
9:107546898 |
T>C |
0,113 |
0,13 (0,005-3,285), p=0,216 |
|
ABCA1 |
rs1331924 |
9:107547622 |
C >G |
0,072 |
0,40 (0,141-1,113), p=0,079 |
|
ABCA1 |
-(.) |
9:107550398 |
- >CATGTCCT ACACATA |
0,499 |
0,40 (0,024-6,456), p=0,514 |
|
ABCA1 |
-(.) |
9:107558538 |
G> A |
0,526 |
1,22 (0,049-30,606), p=0,903 |
|
ABCA1 |
-(.) |
9:107564572 |
GA>- |
0,259 |
1,53 (0,731-3,189), p=0,261 |
|
ABCA1 |
-(.) |
9:107565371 |
T> C |
0,526 |
1,22 (0,049-30,606),p=0,903 |
|
ABCA1 |
rs2777801 |
9:107566877 |
C> A |
0,039 |
2,53 (1,026- 6,283), p=0,043 |
|
ABCA1 |
-(.) |
9:107579829 |
C> T |
0,368 |
2,06 (0,097-43,775),p=0,644 |
|
ABCA1 |
rs10820737 |
9:107591082 |
G> T |
0,234 |
0,38 (0,074-1,975), p=0,251 |
|
ABCA1 |
rs4743763 |
9:107593182 |
A> T |
0,131 |
0,55 (0,257-1,199), p=0,134 |
|
ABCA1 |
-(.) |
9:107594772 |
T>- |
0,036 |
0,38 (0,143-0,959), p=0,041 |
|
ABCA1 |
-(.) |
9:107599417 |
GGA>- |
0,801 |
0,83 (0,280-2,671), p=0,801 |
|
ABCA1 |
rs2243313 |
9:107621140 |
A> C |
1,392 |
0,18 (0,083-0,409), p =0,0003 |
|
ABCA1 |
rs2249891 |
9:107624242 |
A> G |
0,116 |
0,47 (0,181-1,222), p=0,121 |
|
ABCA1 |
rs12003906 |
9:107645477 |
G> T |
0,499 |
0,40 (0,024-6,456), p=0,514 |
|
ABCB7 |
-(.) |
X:74282360 |
T> C |
0,368 |
2,06 (0,097-43,775), p=0,644 |
|
ABCB7 |
rs41305387 |
X:74334522 |
T> C |
0,113 |
0,13 (0.005-3,284), p=0,216 |
|
ABCB7 |
rs4148837 |
X:74334687 |
T> C |
0,775 |
1,22 (0,313-4,759), p=0,775 |
|
ABCB7 |
rs1039123 |
X:74375871 |
G> C |
0,048 |
2,48 (0,048-17,204), p=0,651 |
|
ABCC8 |
rs77960379 |
11:17457456 |
T>C |
0,527 |
1,29 (0,578-2,917), p=0,527 |
|
ABCC8 |
-(.) |
11:17457487 |
CC> TT |
0,336 |
1,48 (0,62-3,318), p=0,338 |
|
ABCC8 |
rs74684488 |
11:17457495 |
C> T |
0,298 |
1,50 (0,695-3,254), p=0,299 |
|
ABCC8 |
-(.) |
11:17457575 |
TGGGACAG> AAAACAC |
0,275 |
1,63 (0,673-3,967), p= 0,278 |
|
ABCC8 |
rs80205120 |
11:17457590 |
T> C |
0,079 |
2,11 (0,907-4,914), p= 0,083 |
|
ABCG8 |
rs75365565 |
2:44071760 |
C> T |
0,024 |
0,08 (0,004-1,633), p=0,099 |
|
ABCG8 |
rs4148214 |
2:44079004 |
T> C |
0,117 |
0,54 (0,251-1,171), p=0,119 |
|
ABCG8 |
rs56260466 |
2:44079401 |
G> A |
0,149 |
4,66 (0,252-86,351), p=0,301 |
|
ABCG8 |
-(.) |
2:44101297 |
G> A |
0,368 |
2,06 (0,097-43,775), p=0,644 |
|
ABCG8 |
rs55924588 |
2:44102197 |
T> C |
0,086 |
0,37 (0,109-1,198), p=0,096 |
|
ABCG8 |
-(.) |
2:44102660 |
G> T |
0,526 |
1,22 (0,048-30,606), p=0,903 |
|
ABCG8 |
-(.) |
2:44104612 |
TC>- |
0,099 |
1,96 (0,868-4,714), p=0,103 |
Данные таблицы 2, как оказалось, свидетельствуют о том, что 14 SNPs генов ABCA1, ABCB7, ABCC8, ABCG5, ABCG8 в интронах идентифицированы нами впервые и не были описаны ранее ни при одном заболевании. При расчете OR было установлено, что 4 из 15 SNPs гена ABCA1 (-(.), OR=1,22; -(.), OR=1,53; -(.), OR=1,22; -(.), OR=2,06), 3 из 4 SNPs гена ABCB7 ( -(.), OR=2,06; rs4148837, OR=1,22; rs1039123, OR= 2,48), все 5 SNPs гена ABCC8 8 (rs77960379, OR=1,29; -(.), OR=1,48; rs74684488, OR=1,50;-(.), OR=1,63; rs80205120, OR=2,11), 4 из 7 SNPs ABCG8 (rs56260466, OR=4,66; -(.), OR=2,06; -(.), OR=1,22; -(.), OR=1,96), вероятно, ассоциированы с тяжелым течением акне (OR>1).
При этом 1 SNPs гена ABCA1 в интронах (rs2777801, OR=2,53, p=0,043) достоверно ассоциирован с тяжелым акне, тогда как при 1 SNPs гена ABCB7 в интронах (rs1039123) частота альтеративного аллеля достоверно отличается в группе больных тяжелым акне по отношению к группе контроля (p=0,048), однако риск развития акне лишь вероятен, но не достоверен (OR=2,48, p=0,651).
При этом 2 SNPs гена ABCA1 в интронах (-(.), OR=0,38, p=0,041; rs2243313, OR=0,18, p=0,0003) статистически значимо оказывают протективное действие в развитии тяжелого акне, а один из этих SNPs описан нами впервые и ранее не был описан ни при одном заболевании. Также при 1 SNPs гена ABCG8 в интронах (rs75365565) частота альтеративного аллеля достоверно отличается в группе больных тяжелым акне по отношению к группе контроля (p=0,024), однако риск развития акне лишь вероятен, но не достоверен (OR=0,08, p=0,099).
Характеристика полиморфных локусов генов ABCA1, ABCB7, ABCG5, ABCG8 в 5’UTR и upstream-регионе у больных акне представлена в таблице 3. В гене ABCC8 в 5’UTR и upstream-регионе SNPs нами выявлено не было.
Таблица 3
Характеристика полиморфных локусов генов ABCA1, ABCB7, ABCG5, ABCG8 в 5’UTR и upstream-регионе у больных акне
|
Ген |
Полиморфный локус (SNP) |
Позиция (hg19) |
5’UTR/ upstream |
Вид и позиция замены (при наличии) ДНК |
p-value (z-тест для пропорций) |
OR (95% доверительный интервал), уровень значимости |
|
ABCA1 |
-(.) |
9:107666037 |
5’UTR |
c.-78_-77insG |
0,391 |
0,63 (0,233-1,772), p=0,393 |
|
ABCA1 |
rs2740483 |
9:107690535 |
upstream |
dist=8 |
0,139 |
1,8 (0,821-3,942), p=0,41 |
|
ABCA1 |
-(.) |
9:107690552 |
upstream |
dist=25 |
0,113 |
0,13 (0.05-3,284), p=0,216 |
|
ABCB7 |
rs376533117 |
X:74376144 |
5’UTR |
c.-37T>C; |
0,526 |
1,22 (0,049-30,6060, p= ,903 |
|
ABCG5 |
rs775971505 |
2:44065862 |
5’UTR |
c.-44G>T |
0,113 |
0,13 (0,005-3,285), p=0,216 |
|
ABCG5 |
rs55853083 |
2:44065936 |
5’UTR |
c.-118A>C |
0,818 |
1,21 (0,234-6,278), p=0,818 |
Как видно из данных, представленных в таблице 3, 1 SNPs в upstream-регионе гена ABCA1 (rs2740483, OR=1,8), 1 SNPs в 5’UTR гена ABCB7 (rs376533117, OR=1,22) и 1 SNPs в 5’UTR гена ABCG5 (rs55853083, OR=1,06) ассоциированы с тяжелой формой акне. Остальные (OR<1), вероятно, имеют протективное значение в развитии акне.
Полученные результаты проведенного нами исследования позволили дать характеристику дефектов генов АТФ-связывающих белков кислородного метаболизма ABCA1, ABCB7, ABCC8, ABCG5, ABCG8 у пациентов с тяжелым течением акне. Все SNPs генов АТФ-связывающих белков кислородного метаболизма впервые выявлены нами у больных тяжелой формой акне; при этом статистически значимое протективное действие в развитии тяжелой формы акне определяет SNPs гена АВСА1 в экзонах (rs2230806, OR=0,18, ДИ 0,083-0,409; p= 0,00003). Кроме того, один SNPs гена ABCA1 в интронах (rs2777801, OR=2,53, p=0,043) достоверно ассоциирован с тяжелым акне. В то же время при 1 SNPs гена ABCB7 в интронах (rs1039123) частота альтеративного аллеля статистически значимо отличается в группе больных тяжелым акне по отношению к группе контроля (p=0,048), однако риск развития акне лишь вероятен, но не достоверен (OR=2,48, p=0,651). Два SNPs гена ABCA1 в интронах (-(.), OR=0,38, p=0,041; rs2243313, OR=0,18, p=0,0003) достоверно оказывают протективное действие в развитии тяжелого акне, а один их этих SNPs описан нами впервые и ранее не был описан ни при одном заболевании. Также при 1 SNPs гена ABCG8 в интронах (rs75365565) частота альтеративного аллеля достоверно отличается в группе больных тяжелым акне по отношению к группе контроля (p=0,024), однако риск развития акне лишь вероятен, но не достоверен (OR=0,08, p=0,099).
Описано, что одним из возможных механизмов транспорта липидов является взаимодействие аполипопротеинов с белком ABCA1 или сходным белком, что вызывает транслокацию внутриклеточного холестерина и фосфолипидов из комплекса Гольджи к плазматической мембране. Другим механизмом может быть перемещение ABCA1-содержащих везикул во внутриклеточные липидные депозиты с последующим перемещением липидов в просвет пузырьков, которые транспортируют липиды обратно в плазматическую мембрану.
Сообщается, что регулирование уровней мРНК ABCA2, ABCA3 и ABCA7 обеспечивается постоянным притоком холестерина, опосредованным ЛПНП. Белок ABCA3 может сыграть важную роль в образовании легочного сурфактанта, который состоит в основном из фосфолипидов и специфических сурфактантных белков, тогда как ABCA7 может участвовать в транспорте гема из митохондрий в цитозоль, а также играть центральную роль в созревании цитозольных белков, содержащих кластер железа и серы. Также установлено, что активация ABCA12 является важным фактором для восстановления барьерной функции кожи [14; 15].
Показано, что синтез и состав себума регулируется внутренними (например, PPAR, LXR, RAR, RXR, эндоканнабиноиды) и внешними (например, андрогены, IGF1, инсулин, лептин) факторами. Липиды себума обеспечивают формирование липидного барьера кожи и проникают через эпидермис в дерму, также предполагают прямую диффузию из сальной железы. Кроме того, показано, что липиды кожного сала являются модуляторами работы как кератиноцитов, так и макрофагов, изменяя уровни экспрессии их генов и белков, поддерживая физиологическую иммунную систему кожи.
PPAR является ядерным рецептором II типа и образует гетеродимеры с другим ядерным рецептором II типа – рецептором ретиноида X (retinoid X receptor, RXR). Гены-мишени PPAR участвуют в транспорте жирных кислот, окислении жирных кислот, клиренсе триглицеридов, производстве липопротеинов и гомеостазе холестерина.
Мембранное распределение внутриклеточных липидов важно для клеточной функции и передачи сигналов. Транспортеры ABC, такие как ABCA1, ABCB4, ABCB11, ABCD1, ABCG1 и ABCG5 / 8, играют решающую роль в поддержании этой организации.
Полученные данные по анализу ген-генных взаимодействий представлены на рисунке.
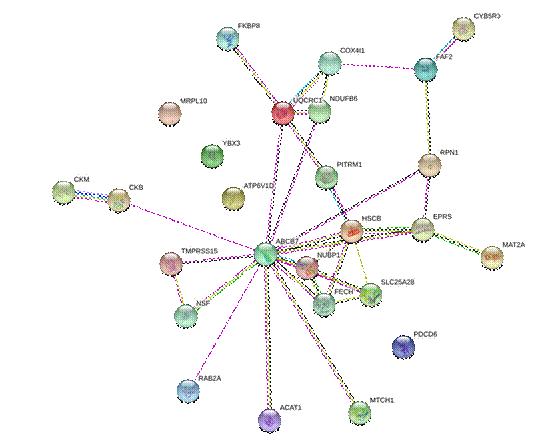
Ген-генные взаимодействия генов АТФ-связывающих белков кислородного метаболизма.
Цвет линий отражает характер взаимодействий: бирюзовый - из известных баз данных, фиолетовый - экспериментальные данные, зеленый - сродство генов, красный - слияние генов, синий - совпадение генов, желтый - текстовый майнинг, черный - коэкспрессия, голубой - гомология белков (https://www.genecards.org/cgi-bin/carddisp.pl?gene)
Заключение
Полученные варианты нуклеотидной последовательности генов АТФ-связывающих белков кислородного метаболизма ABCA1, ABCB7, ABCC8, ABCG5, ABCG8, по-видимому, ассоциированы с тяжелой формой акне. В результате это может являться причиной нарушения транспортировки липидов в и из клетки, приводя к дисбалансу работы митохондрий и, как следствие, формированию анаэробных условий для размножения C.acnes. Кроме того, нарушение кислородного метаболизма ведет к дисбалансу антиоксидантной системы и активации провоспалительных факторов, включая цитокины, хемокины и факторы роста.
Таким образом, проведенные исследования позволили впервые выявить полиморфные локусы генов АТФ-связывающих белков кислородного метаболизма ABCA1, ABCB7, ABCC8, ABCG5, ABCG8, дисбаланс между которыми, вероятно, является патофизиологическим механизмом развития акне.



