Сахарный диабет является значимой медико-социальной проблемой современного общества, затрагивая все возрастные группы, в том числе и женщин фертильного возраста. Распространенность гипергликемии у беременных в мире составляет в среднем 16,7%, при этом около 80,3% случаев связаны с гестационным сахарным диабетом (ГСД). [1]. Гипергликемия матери отрицательно влияет на плод, приводя к развитию симптомокомплекса диабетической фетопатии. При этом в литературных источниках встречаются противоречивые данные, характеризующие частоту встречаемости тех или иных клинических симптомов. Так, результаты исследования З.И. Эсмурзиевой и соавт. [2] показали, что у трети детей от матерей с ГСД была зарегистрирована низкая оценка по шкале Апгар по сравнению с группой контроля. А K.P. Yeagle и соавт. [3] не выявили статистически значимой разницы между оценкой по шкале Апгар у детей, рожденных от матерей с СД, и детей, чьи матери не страдают нарушением углеводного обмена. Частота выявления гипогликемии у новорожденных от матерей с СД также отличается в разных исследованиях. Е.В. Мирошник и соавт. [4] провели анализ медицинской документации новорожденных с диагнозом «диабетическая фетопатия», гипогликемия не зарегистрирована ни у одного из обследованных. Это противоречит результатам И.Л. Никитиной и соавт. [5], согласно которым гипогликемию с уровнем глюкозы крови менее 3 ммоль/л имели 43% новорожденных с диабетической фетопатией.
Нарушение углеводного обмена в перинатальном периоде в более старшем возрасте приводит к повышенному риску формирования задержки психомоторного развития и расстройств аутистического спектра вследствие поражения ЦНС, к развитию кардиопатий и задержке закрытия внутриутробных коммуникаций в результате прямого влияния гипергликемии на закладку и развитие сердечно-сосудистой системы, а также более выраженным функциональным расстройствам желудочно-кишечного тракта из-за морфофункциональной незрелости к моменту рождения. Также у таких детей чаще наблюдаются метаболические нарушения и сниженная резистентность к инфекционным агентам [6, 7].
Наличие СД у матери не только отрицательно воздействует на развитие ребенка, но и ухудшает течение беременности, увеличивая риск развития акушерских осложнений, среди которых наиболее часто встречаются гестоз, анемия беременных, отеки, многоводие и угроза прерывания беременности [8]. В случае макросомии плода при физиологических родах существует большой риск повреждения или разрыва ткани влагалища и мышц промежности [9].
Цель исследования: определить некоторые факторы риска развития ГСД, оценить его влияние на течение и исходы беременности, а также выявить особенности состояния здоровья новорожденных детей, рожденных от матерей с данным заболеванием.
Материал и методы исследования. Были проанализированы 200 медицинских историй новорожденных детей и их матерей, находившихся в ГБУЗ РМ «Мордовский республиканский клинический перинатальный центр». На этапе I были выделены исследуемая группа, куда вошли 100 детей от матерей с ГСД, и группа контроля – 100 детей, чьи матери не страдали нарушением углеводного обмена. Проведено ретроспективное исследование по типу «случай – контроль», куда включены 200 пар «мать – новорожденный». На этапе II с целью сравнения состояния здоровья новорожденных от матерей с ГСД с гипо- и нормогликемией исследуемая группа была разделена на 2 подгруппы (10 и 90 детей соответственно). Факторными признаками для разделения стал уровень сахара крови ребенка в 1-е сутки жизни. На III этапе исследуемая группа была разделена на 3 подгруппы: новорожденные с нормальной массой тела, с макросомией и с недостаточной массой тела к сроку гестации (78, 12 и 10 детей соответственно). Статистический анализ полученных результатов проведен с помощью пакета программ Statistica 10, для сравнения показателей использовались t-критерий для независимых выборок, критерий Фишера.
Результаты исследования и их обсуждение
В ходе анализа полученных данных было выяснено, что у 27 пациенток из исследуемой группы акушерско-гинекологический анамнез был отягощен медицинскими абортами или выкидышами, 13 женщин забеременели с помощью ЭКО. В группе контроля таких случаев было меньше – отягощенный акушерско-гинекологический анамнез у 7 женщин, беременности с помощью ЭКО у 3 женщин. При изучении особенностей течения данной беременности выявлено, что осложнения регистрировались у 41 женщины с сахарным диабетом. Из них у 36% женщин выявлены отеки, вызванные беременностью, у 31% – плацентарные нарушения, у 27% – преждевременный разрыв плодных оболочек, у 7% – многоводие и у 3% – угроза прерывания беременности.
Средний возраст беременных с СД составил 32,3 года, что превышает возраст беременных из группы контроля, который в среднем равен 28,3 года (р=0,0001). Экстрагенитальный анамнез женщин с ГСД чаще был отягощен ожирением (50%), анемией (28%) и вегетативной дистонией (25%). В группе контроля у женщин на первом месте по частоте встречаемости были анемия (33%) и миопия (34%). У 14% пациенток выявлен пиелонефрит. Родоразрешение путем операции кесарева сечения у женщин, страдающих ГСД, имело место у половины женщин. Этот показатель более чем в 2 раза превышает частоту встречаемости кесарева сечения в группе контроля, где оперативное родоразрешение было проведено у 23 женщин.
Состояние новорожденных от матерей с ГСД по шкале Апгар на первой минуте не отличалось у детей исследуемой и контрольной групп, однако на 5-й минуте жизни показатели были достоверно ниже (8 и 6 соответственно, р=0,0014). Средний рост и вес у детей от матерей с СД не отличались аналогичных параметров представителей контрольной группы, однако у детей с гипогликемией вес при рождении был достоверно выше, чем у новорожденных исследуемой группы без гипогликемии (3995 г и 3288 г соответственно, р=0,02). Макросомия не была ведущей фенотипической особенностью новорожденных от матерей с ГСД и была диагностирована лишь у 12 детей. В группе контроля этот показатель был ниже и составил 5 человек. Также у 10 новорожденных от матерей с СД была зарегистрирована внутриутробная задержка роста плода. Средний уровень гликемии не различался у детей исследуемой и контрольной групп (3,53 и 3,75 соответственно, р=0,288), однако у 6 детей с макросомией зарегистрирована гипогликемия (от 1,2 до 2,5 ммоль/л)
Клиническими проявлениями патологии в раннем неонатальном периоде у детей от матерей с СД чаще были нарушения со стороны сердечно-сосудистой системы. В исследуемой группе были выявлены постгипоксическая кардиопатия у 21 ребенка, мышечный трабекулярный ДМЖП у 4, гипертрофия стенки левого желудочка у 4. Переходящий WPW-синдром был диагностирован исключительно в контрольной группе у 2 детей (рис. 1).
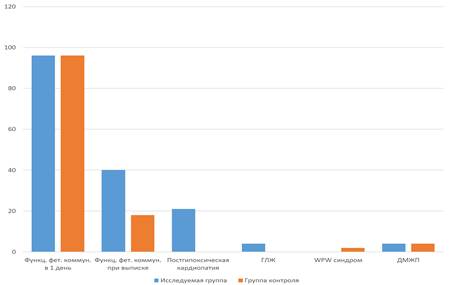
Рис. 1. Структура патологии сердечно-сосудистой системы у исследуемой и контрольной групп, %
При анализе данных ЭХО КГ выявлено, что у детей с гипогликемией толщина стенки левого желудочка в среднем была равна 3,2 мм, в то время как у детей с нормогликемией этот показатель был достоверно ниже и составил 2,6 мм (р=0,017).
Функционирующие фетальные коммуникации в 1-е сутки жизни встречались одинаково часто независимо от веса и уровня глюкозы в крови детей. Сохранение фетальных коммуникаций к моменту выписки значительно чаще встречалось у маловесных к сроку гестации детей (80%) (p≤0,05). В группе новорожденных с макросомией этот показатель составил 25%, с нормальным весом – 32%. ДМЖП диагностирован у 17% детей с макросомией и у 3% – с нормальным весом (p≤0,05). Постгипоксическая кардиопатия выявлена только у детей с нормальным весом, а гипертрофия левого желудочка – исключительно у детей с макросомией (рис. 2).
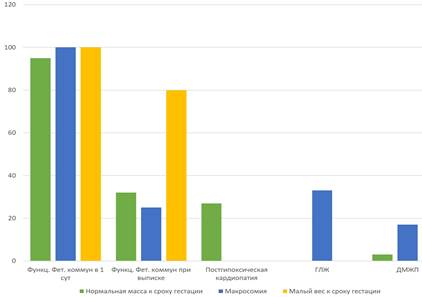
Рис. 2. Структура патологии сердечно-сосудистой системы в зависимости от веса ребенка, %
В группе детей с гипогликемией были выявлены функционирующие фетальные коммуникации у 100% детей в 1-е сутки и у 30% – к моменту выписки. Гипертрофия левого желудочка в данной группе встречалась чаще (20%), чем у детей с нормогликемией (2%) (p≤0,05).
Патологии нервной системы в исследуемой группе были представлены церебральной возбудимостью у 16 новорожденных, церебральной ишемией у 8, церебральной депрессией у 8, гипоксически-ишемической энцефалопатией у 3, врожденной церебральной кистой у 3. Судорожный синдром был выявлен только в группе контроля у 2 детей (рис. 3).
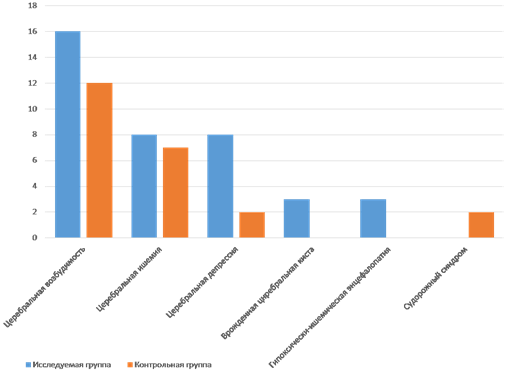
Рис. 3. Структура патологии нервной системы у детей исследуемой и контрольной групп, %
В группе детей с гипогликемией выявлены церебральная ишемия у 20% и церебральная депрессия также у 20% новорожденных. У детей с нормогликемией данные показатели составили 7% в обоих случаях, что свидетельствует о тенденции к увеличению вероятности развитий данных состояний у новорожденных с гипогликемией.
Церебральная возбудимость чаще встречалась у маловесных к сроку гестации детей и была выявлена в 40% случаев (p≤0,05). Церебральная ишемия была более характерна для группы детей с макросомией – диагностирована у 42% детей (p≤0,05). Церебральная депрессия, гипоксически-ишемическая энцефалопатия и врожденная церебральная киста диагностированы исключительно у новорожденных с нормальным весом (рис. 4).
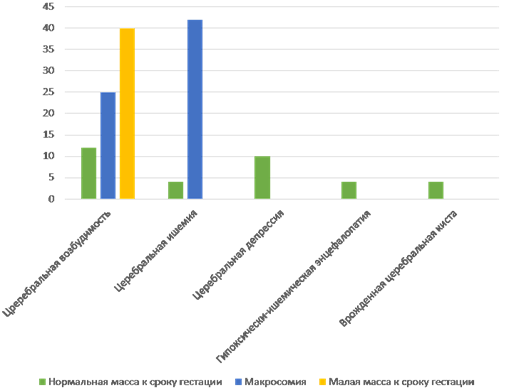
Рис. 4. Структура патологии нервной системы в зависимости от веса ребенка, %
Патология дыхательной системы в исследуемой группе была представлена респираторным дистресс-синдромом у 6 детей, напряженным пневмотораксом у 2, бронхолегочной дисплазией у 2, интерстициальной эмфиземой легких у 1, неонатальной легочной гипертензией у 1 ребенка.
В группе детей с гипогликемией пневмоторакс был выявлен у 10% детей, а в группе с нормогликемией – у 2%, что свидетельствует о тенденции к увеличению вероятности возникновения данного заболевания у детей с ранней неонатальной гипогликемией.
Респираторный дистресс-синдром значительно чаще выявлялся у маловесных новорожденных (40%), у детей с нормальным весом к сроку гестации данное состояние было выявлено лишь у 3% (p≤0,05). Выявлена тенденция к увеличению риска развития пневмоторакса в группе детей с макросомией, где он был диагностирован у 8%, в то время как в группе детей с нормальным весом этот показатель равен 1%. Бронхолегочная дисплазия обнаружена у 10% детей с малым весом и у 1% с нормальным весом, что говорит о тенденции к увеличению вероятности развития данной патологии у маловесных к сроку гестации новорожденных. Эмфизема выявлена исключительно в группе маловесных детей (10%), а легочная гипертензия – у новорожденных с нормальным весом (1%).
Инфекционные заболевания в исследуемой группе были зарегистрированы у 13 новорожденных, в группе контроля – у 3. У детей, рожденных от матерей с СД, зарегистрированы врожденные пневмонии у 6, неонатальная инфекция мочевыводящих путей у 2, омфалит у 2, кандидоз кожных покровов у 3. Ни одно из вышеперечисленных заболеваний не было выявлено в группе контроля, где инфекционная патология представлена дакриоциститом у 2 и менингоэнцефалитом у 1 новорожденного (рис. 5).
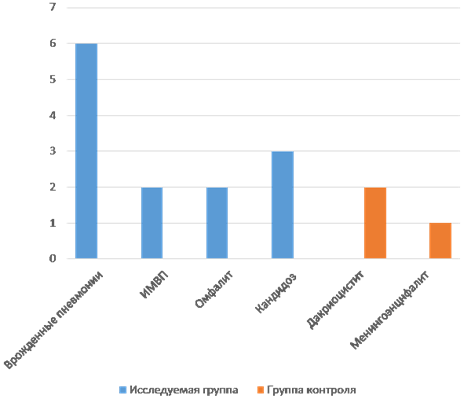
Рис. 5. Структура инфекционной патологии у исследуемой и контрольной групп, %
В группе детей с гипогликемией был выявлен кандидоз кожных покровов у 20% детей, что в несколько раз превышает показатель у детей с нормогликемией – 1% (p≤0,05).
Омфалит и ИМВП диагностировались только у детей с нормальным весом – 3% детей по отношению к обоим заболеваниям. Кандидоз чаще регистрировался в группе маловесных детей, где был выявлен у 20% новорожденных (p≤0,05). Пневмонии выявлялись у детей с макросомией и у маловесных к сроку гестации новорожденных, статистически значимой разницы частоты встречаемости в этих группах не выявлено.
Выявлена тенденция к увеличению частоты встречаемости неонатальной желтухи в исследуемой группе, где она была диагностирована у 12 детей. В группе контроля данное состояние выявлено у 7 новорожденных. Чаще желтуха встречалась в группе детей с гипогликемией (50%) и макросомией (42%) (p≤0,05). В группе детей с нормогликемией данное состояние встречалось у 8%. Среди маловесных к сроку гестации неонатальная желтуха диагностирована у 20% детей, среди детей с нормальным весом – у 6%.
Таким образом, нарушения углеводного обмена чаще регистрировались у женщин более старшего возраста с осложненным акушерским анамнезом и ожирением, что обусловливает необходимость проведения родоразрешения путем плановой операции кесарева сечения. Данный вид родоразрешения вызывает нарушение здоровья как матерей, так и новорожденных. У детей, рожденных путем кесарева сечения, повышен риск нарушения формирования иммунной системы, развития аллергических заболеваний, в том числе бронхиальной астмы, снижения числа и разнообразия кишечной микробиоты [10]. Метаболические нарушения в организме беременной женщины оказывают крайне неблагоприятное воздействие на плод, что приводит к формированию различных пороков развития и снижению адаптационных резервов [11]. При оценке состояния новорожденных по шкале Апгар на 1-й минуте достоверных отличий в значении показателя у детей исследуемой группы выявлено не было, однако на 5-й минуте различия были статистически значимыми (6 у новорожденных от матерей с ГСД против 8 группы контроля, р=0,0014). У детей исследуемой группы по сравнению с детьми из группы контроля выявлены тенденция к увеличению частоты заболеваний и пороков развития (70% против 38%, p≤0,05) и увеличение размеров левой доли печени по данным ультразвукового скрининга (58,8 мм против 38,17 мм, p=0,00), при этом размеры правой доли достоверно значимо не различались. При оценке характера изменений у детей от матерей с ГСД в зависимости от уровня гликемии после рождения отмечено, что дети с низким уровнем сахара крови, в отличие от детей с нормогликемией, чаще демонстрировали макросомию (40% против 9%, p≤0,05), удельный вес нарушений состояния здоровья также имеет тенденцию к увеличению у данной когорты пациентов (50% против 37%). Одним из грозных проявлений диабетической фетопатии является поражение сердца, чаще всего проявляющееся гипертрофической кардиомиопатией [12]. У детей от матерей с ГСД и гипогликемией выявлено достоверное увеличение толщины стенки левого желудочка по сравнению с детьми без гипогликемии (3,2 мм против 2,5 мм, р=0,017), другие показатели размеров сердца и внутрисердечной гемодинамики не отличались. У маловесных к сроку гестации детей выявлено замедление закрытия функционирующих фетальных коммуникаций по сравнению с новорожденными других групп (p≤0,05). У детей с макросомией чаще диагностировалась патология нервной систем, а заболевания дыхательной системы и инфекционная патология были более характерны для маловесных к сроку гестации новорожденных (p≤0,05).
В 2013 г. в клиническую практику были внедрены клинические рекомендации по диагностике и лечению гестационного сахарного диабета, определившие тактику ведения беременных женщин с различными нарушениями углеводного обмена. При анализе состояния здоровья новорожденных детей от матерей с ГСД до и после введения клинических рекомендаций было выявлено, что частота встречаемости и степень выраженности диабетической фетопатии значительно снизились, а также реже выявлялись другие изменения внутренних органов. Так, согласно исследованию, проведенному в 1979 г. [13], толщина стенки левого желудочка у детей, рожденных от матерей с СД, в среднем составила 3,6 мм. В нашем исследовании этот показатель ниже и составляет 2,6 мм. По данным исследования 2004 г. [14], у новорожденных от матерей с СД открытое овальное окно встречается в 70% случаев, открытый аортальный проток – в 68% случаев, что в 2,5 раза превышает данные, полученные в результате нашего исследования. Также в исследовании 2004 г. у детей выявляли серьезные пороки сердца, а в нашем исследовании диагностированы только малые аномалии развития. По данным отечественной литературы за 2009 г. [15], перинатальная смертность больных ГСД доходила до 4,8%, а макросомия встречалась у 23% детей. В нашем исследовании не было выявлено ни одного случая перинатальной смертности, а макросомия регистрировалась в 2 раза реже. Это подтверждает эффективность методов ранней диагностики и своевременной коррекции нарушений углеводного обмена при ГСД, предложенных в данных рекомендациях.
Заключение
Распространенность сахарного диабета в мире, несмотря на проводимые мероприятия, не только не снижается, но и демонстрирует постоянный рост, что позволяет предположить увеличение пациенток с нарушением углеводного обмена во время беременности. В проведенном исследовании установлено, что факторами риска развития ГСД являются возраст матери, ожирение и осложненный акушерский анамнез. У женщин с ГСД выявлено более частое развитие осложнений течения беременности: отеков, плацентарных нарушений, преждевременного разрыва плодных оболочек и многоводия. Также гипергликемия матери приводила к снижению адаптационных возможностей новорожденного, что проявлялось в снижении суммы баллов по шкале Апгар на 5-й минуте жизни. У новорожденных от матерей с ГСД отмечалось увеличение частоты заболеваний и пороков развития. Представленность патологии была неоднородной. У детей c ранней неонатальной гипогликемией чаще регистрировалась макросомия (40% против 9%, p≤0,05), а также выявлена тенденция к увеличению общего удельного веса заболеваний (50% против 37%). У маловесных к сроку гестации детей выявлено замедление закрытия функционирующих фетальных коммуникаций по сравнению с новорожденными других групп (p≤0,05).
У детей с макросомией чаще выявлялась патология нервной систем, а заболевания дыхательной системы и инфекционная патология были более характерны для маловесных к сроку гестации новорожденных (p≤0,05). Внедрение протоколов ведения беременных с гестационным сахарным диабетом существенно улучшило состояние здоровья новорожденных, однако сохраняющийся высокий удельный вес патологии неонатального периода у новорожденных от матерей с нарушением углеводного обмена требует проведения дальнейших исследований для адаптации клинических рекомендаций к современным условиям.



