На сегодняшний день наблюдается безусловная тенденция возрастания заболеваемости первичными злокачественными глиальными опухолями головного мозга. Основную группу представляют анапластические глиомы Grade III и глиобластомы Grade IV, которые составляют 15,6% от общего числа первичных опухолей головного мозга и занимают четвертое место по смертности в онкологической заболеваемости [1]. Несмотря на наличие современных подходов в лечении, прогноз для этих пациентов остается неблагоприятным. Средняя продолжительность жизни составляет примерно 10–12 месяцев [2]. Первичные глиомы головного мозга являются высокоагрессивными новообразованиями, которые характеризуются инфильтрирующим ростом и обладают способностью к быстрому прогрессированию за счет интенсивного клеточного деления и патологического сосудистого ангиогенеза. За счет повышенной клеточной пролиферации, нарушения венозного и ликворного оттока формируется порочный круг, который способствует усилению отека тканей головного мозга и особенно усиливается в период проведения лучевой терапии. Ранний продолженный рост связан с патологическим ангиогенезом и зависит от баланса между про- и антиангиогенными факторами. Возникающая гипоксия в клетке дает сигнал к высвобождению проангиогенных факторов роста, таких как фактор роста эндотелия сосудов (VEGF), трансформирующий фактор роста-β (TGF-β) [3,4]. Антиангиогенные факторы образуют связи со своими рецепторами на мембране эндотелиальных клеток, это приводит к разрушению клеточной стенки сосуда и деградации базальной мембраны эндотелиальных клеток и внеклеточного матрикса. В результате этих процессов образуются новые патологические сосуды. На сегодняшний день для лечения патологического ангиогенеза используются препараты группы моноклональных антител, одним из которых является бевацизумаб.
Расширение доступности использования высокотехнологической объемной визуализации открыло возможность определения и отслеживания целевых и критических структур головного мозга с высоким разрешением до и во время курса лучевой терапии. Усовершенствованные методы доставки дозы посредством нового поколения линейных ускорителей электронов (ЛУЭ) обеспечивают высокоселективное распределение дозы для заранее определенных структур. Известно, что в процессе проведения лучевой терапии изменяется конфигурация целевых объемов облучения вследствие реакции опухоли и перитуморальной зоны на воздействие ионизирующего излучения. Стандартные подходы лечения не подразумевают адаптацию плана лучевой терапии [5, 6]. В связи с этими особенностями может возникнуть необходимость в корректировке плана лечения на этапах лучевой терапии.
Цель исследования – представить результаты клинического наблюдения за пациентом, которому проводилась адаптивная стереотаксическая лучевая терапия в модификации бевацизумабом с целью повышения локального контроля и снижения суммарной дозной нагрузки на органы риска и здоровые ткани головного мозга за проведенный курс лучевой терапии (Патент РФ на изобретение № 2759405).
Клинический случай
Больная Б. 69 лет поступила в августе 2021 г. в «НМИЦ онкологии» МЗ РФ после того, как по месту жительства из-за головных болей выполнила МРТ головного мозга от 12.07.2021 г. и на нем была выявлена опухоль правой теменной доли головного мозга с перифокальным отеком, накапливающая контраст по периферии. При предоперационном дообследовании при выполнении МРТ головного мозга от 14.07.2021 г. – МР-картина солидно-кистозной узловой опухоли с геморрагическим пропитыванием, структурно соответствует глиобластоме grade IV, правых височной, теменной и затылочной долей, подкорковых ядер; справа сливные зоны опухолевой инфильтрации с распространением на постцентральную извилину область заднего и нижнего рога правого бокового желудочка (с интравентрикулярным ростом), вовлекает ствол мозолистого тела.
Далее пациентке 05.08.2021 г. выполнены костнопластическая краниотомия в затылочной области, удаление глиальной опухоли височно-теменно-затылочной области в пределах видимых здоровых тканей с применением интраоперационной навигации и нейрофизиологического мониторинга. Гистологические препараты отправлены на исследование патологоанатомом. По результатам гистологического заключения: морфологическая картина характерна для глиобластомы, NOS, G4. Рекомендовано выполнение иммуногистохимического исследования. На ИГХ: морфологическая картина и иммунофенотип опухолевых клеток в ткани головного мозга (GFAP+, S100+) соответствуют глибластоме NOS, G4. Далее рекомендовано выполнить молекулярно-генетическое исследование. Анализ на наличие молекулярно-генетических мутаций в генах IDH1 и IDH2 – мутаций не обнаружено. Анализ на определение метилирования гена MGMT методом пиросеквенирования – не метилирован.
Затем 06.09.2021 г. проведен консилиум в составе нейрохирурга, химиотерапевта, радиотерапевта по определению дальнейшей тактики лечения пациентки. Рекомендовано выполнение МРТ головного мозга с внутривенным контрастным усилением. На МРТ головного мозга от 31.08.2021 г. – состояние после костнопластическаой краниотомии в теменно-затылочной области, удаления глиальной опухоли височно-теменно-затылочной области. МР-картина остаточной солидно-кистозной узловой опухоли с геморрагическим пропитыванием с интравентрикулярным ростом. С учетом оставшейся опухолевой ткани и стандартов лечения больной показано проведение адъювантной химиотерапии в модификации бевацизумабом.
09.09.2021 г. проведена предварительная топометрическая подготовка: изготовлено индивидуальное фиксирующее устройство – трехслойная термопластическая маска для стереотаксической лучевой терапии, установлены рентгенконтрастные метки и определен изоцентр с помощью системы лазерной навигации LAP Laser, выполнена топометрическая томография на компьютерном томографе Siemens Somatom, эффективная доза за исследование составила 3,7 мЗв. Выполнена обработка предварительной топометрии на станции виртуальной симуляции Singo Via. С помощью программного обеспечения Elements (BrainLab) произведено сегментирование.
С 13.09.2021 г. по 22.10.2021 г. проведен курс адаптивной стереотаксической лучевой терапии на постоперационную область опухоли головного мозга РОД 2Гр СОД 60 Гр № 30 фракций с модификацией бевацизумабом.
Контуры GTV определялись на основании данных МРТ головного мозга с контрастным усилением в трехмерном режиме по данным T1 контрастных и FLAIR режимов. Отступ от GTV для CTV составлял 2 см, от CTV для PTV – 0,1 см. Адаптация плана лечения проводилась на 10-й и 20-й фракции лечения посредством процедуры совмещения полученных мультимодальных изображений и выделения целевых структур облучения. 14.09.2021 г., 28.09.2021 г., 12.10.2021 г. проводилось введение бевацизумаба 400 мг в/в капельно в течение 60 минут в расчете 5 мг/кг (вес 80 кг). МРТ головного мозга выполнялась с в/в к/у в режиме 3D BRAVO 13.09.2021 г., 24.09.2021 г., 08.10.2021 г., 22.10.2021 г. и через 1 месяц после реализации лучевого эффекта 22.11.2021 г.
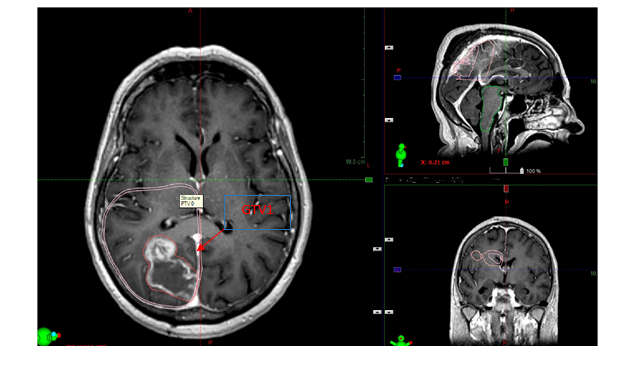
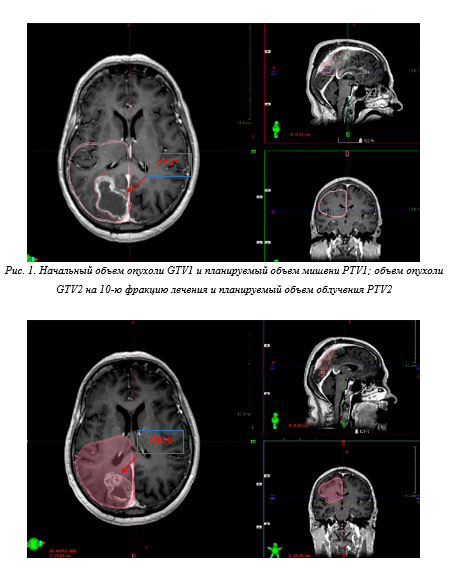
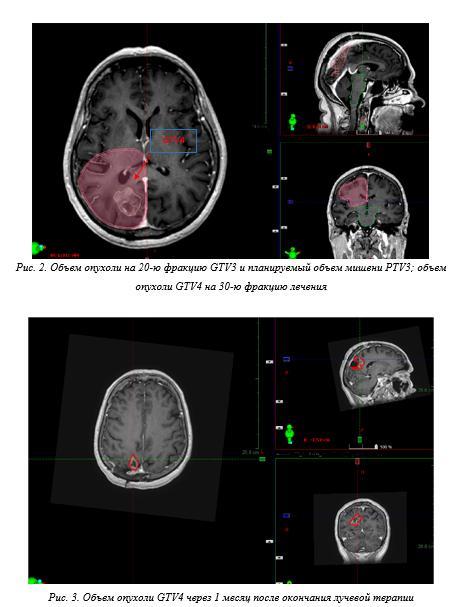
Первоначальный объем остаточной опухоли GTV составлял 37,9 см3, объем облучаемой ткани головного мозга CTV составил 238,2 см3. На 10-ю фракцию лучевой терапии при пересмотре объемов облучения остаточной опухоли GTV составлял 34,5 см3, а объем облучаемой ткани головного мозга CTV – 221,2 см3 (рис. 1). При проведении пересмотра плана лечения на 20-ю фракцию лечения объем остаточной опухоли GTV составил 15,1 см3, а объем облучаемой ткани головного мозга CTV – 210,2 см3 (рис. 2). На 30-ю фракцию при проведении МРТ головного мозга объем остаточной опухоли GTV составлял 12,3 см3 (рис. 3). Далее при проведении МРТ головного мозга с в/в к/у в режиме 3D BRAVO объем остаточной ткани составил 8,6 см3.
Больная находится под динамическим наблюдением. Проводятся курсы противоопухолевой лекарственной терапии по месту жительства по схеме темозоломид 150–200 мг/м2 внутрь каждые 28 дней (5/23). Данных за прогрессирование заболевания на данный момент не выявлено.
Выводы
Применение адаптивной стереотаксической лучевой терапии в лечении злокачественных глиом головного мозга на фоне модификации антиангиогенным препаратом «Бевацизумаб» может способствовать способствует повышению локального контроля опухоли, снижению потребности в применении глюкокортикостероидов, улучшению когнитивных функций, повышению эффективности и переносимости адъювантной лучевой терапии благодаря снижению нагрузки на здоровые ткани головного мозга и органы риска.



