Использование раневых покрытий оказывается базисным компонентом лечения пациентов c обширными длительно незаживающими дефектами мягких тканей [1, 2]. В настоящее время внимание многих исследователей концентрируется на разработке универсальных перевязочных материалов и покрытий, применение которых способствует ускорению эпителизации раневых дефектов разной природы и анатомической локализации [2, 3].
Формирование дефектов мягких тканей, как правило, сопряжено с необходимостью борьбы с клиническими проявлениями хирургической инфекции, что в комплексе с применением топических противомикробных средств без должного бактериологического контроля может обусловливать развитие антибиотикорезистентности [4]. Поэтому в качестве перспективного пути улучшения результатов лечения больных в случаях длительно незаживающих дефектов мягких тканей может рассматриваться применение биологически активных компонентов природного происхождения, обладающих неспецифическими антибактериальными свойствами, не индуцирующих устойчивость микроорганизмов и не оказывающих местного токсического воздействия на аутологичные ткани [5]. Частным примером таких форм местного оздоровления тканей могут считаться органические лечебно-профилактические пластины «ЦМ» (ЛПП «ЦМ») на основе природного биополимера – желатина в комплексе с раствором гентамицина. Этот биопродукт также содержит экстракты лекарственных трав (зверобоя, шалфея, тысячелистника), минеральные вещества, витамины. Уже установлено, что использование ЛПП «ЦМ» в качестве раневых покрытий после дентальной имплантации способствовало ускорению процесса заживления операционных ран с нормализацией состава микрофлоры полости рта. Создана модификация мембраны «ЦМ», потенциально перспективная для применения в хирургической практике в случаях оказания медицинской помощи больным с длительно незаживающими дефектами мягких тканей. Необходимость апробации ЛПП «ЦМ» в клинической практике способствовала целенаправленному проведению изысканий в эксперименте.
Цель исследования: оценить в эксперименте возможности применения органических биоразлагаемых мембран в случаях инфицированных дефектов мягких тканей.
Материал и методы исследования. В качестве экспериментальных животных избраны самцы белых крыс линии Wistar (n=30, возраст – 6 месяцев, средняя масса тела 250±17,5 г). Операции и манипуляции с животными проводили, руководствуясь Европейской конвенцией по защите позвоночных животных, используемых в экспериментальных и других исследованиях (European Convention for the Protection of Vertebrate Animals used for Experimental and Other Scientific Purposes, 1986).
Анальгезию животных осуществляли внутрибрюшинным введением комбинации препаратов (230 мкл препарата «Золетил 100», Virbac, Франция и 20 мкл «Рометар 20 мг/мл», Bioveta, Чехия). В зоне предполагаемого вмешательства в межлопаточной области осуществляли депиляцию. Кожу трижды обрабатывали раствором антисептика. После инфильтрации тканей 1,0 мл 0,5%-ным раствора лидокаина гидрохлорида скальпелем до мышц иссекали лоскут тканей площадью 1,8 см2, состоящий из кожи, подкожной клетчатки и поверхностной фасции. Сформированную раневую поверхность инфицировали введением в нее 5%-ного раствора фекалий крыс из расчета 0,5 мл на 100 г массы тела животного. С целью профилактики дополнительной контаминации раны микроорганизмами с кожного покрова на нее накладывали плотную многослойную повязку. Через 2 суток после операции среди животных были выделены три группы численностью по 10 особей каждая: группа контроля – ГК (заживление раны должно было происходить без использования лекарственных средств); группа № 1 (при заживлении применялась органическая биоразлагаемая мембрана «ЦМ» № 1); группа № 2 (при заживлении использовалась органическая биоразлагаемая мембрана «ЦМ» № 2). Лекарственные мембраны применяли однократно. Их размеры сопоставимы с площадью созданных раневых дефектов. На 3-и сутки эксперимента мембраны удаляли из ран при обработке изотоническим раствором хлорида натрия. Дальнейшее заживление ран происходило в одинаковых условиях, без применения лекарственных препаратов. Результаты эксперимента во всех группах учитывали от момента разделения общей когорты животных на группы.
Для оценки скорости заживления ран выполняли фотофиксацию на 0-е, 3-и, 7-е, 11-е, 15-е, 19-е, 21-е сутки. Камеру устанавливали на одинаковом расстоянии от поверхности кожи перпендикулярно раневой поверхности. В качестве эталона рядом располагали метрическую шкалу. Параметры площади раневых дефектов на изображениях рассчитывали, используя программное обеспечение ImageJ (U.S. National Institutes of Health, Bethesda, MD, USA). Показатель изменения площади раневой поверхности вычисляли по формуле:
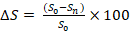 ,
,
где S0 – исходная площадь раны, Sn – площадь раны на n-е сутки.
Морфологическое исследование выполняли на 1-е и 7-е сутки от начала эксперимента. Животных выводили из эксперимента путем передозировки раствора «Золетил» (100 мг/кг, Virbac, Франция), после чего вырезали комплекс тканей с областью экспериментальной раны и фрагментами имплантированных лекарственных пластин. Полученный биологический материал фиксировали в 10%-ном забуференном растворе формалина в течение суток. Гистологическую проводку, заливку и микротомию тканей (при толщине срезов 4 мкм) выполняли по принятому стандарту. Окраску препаратов осуществляли гематоксилином и эозином. Количественную оценку маркеров воспалительной инфильтрации тканей проводили посредством морфометрического изучения цифровых гистотопограмм (изображения с высоким разрешением) продольных срезов полученных образцов. Всю площадь срезов документировали, используя высокопроизводительный сканер для работы с гистологическими препаратами в автоматическом режиме Aperio AT2 (Leica Biosystems, Германия) при увеличении ×20. На каждой гистотопограмме случайным образом выбирали 30 полей зрения (ПЗр) площадью 1 мм2, из которых: 10 ПЗр располагались над мышечным слоем, 10 ПЗр – на уровне мышц и 10 ПЗр – под мышцами соответственно. В выбранных ПЗр количественно оценивали инфильтрацию сегментоядерными лейкоцитами.
Микробиологическое исследование поверхности экспериментальной раны производили через 0, 48, 96 и 168 часов от начала эксперимента. Стерильным инструментом на поверхность ран помещали стерильную марлевую салфетку размером 1,0×1,0 см, слегка прижимая ее ко дну ран. Салфетку, пропитанную раневым отделяемым, помещали в пробирку со стерильным физиологическим раствором (1,0 мл). Смывы с тампона в разведениях 1:100 и 1:1000 (по 0,1 мл) помещали на питательную среду Brain Heart Infusion Agar (Himedia, Индия) без добавок. Посевы выдерживали в термостате (t=37°С) в течение 48 часов, после чего калькулировали численность колоний микроорганизмов. Cтепень бактериальной контаминации количественно оценивали числом колониеобразующих единиц в 1,0 мл смыва – КОЕ/мл. Колонии разных морфологических типов исследовали с помощью световой микроскопии мазков, окрашенных по Граму.
Результаты исследования подвергали статистической обработке с применением компьютерных программ: Microsoft Excel 2019, Jamovi 1.0.1.9, IBM SPSS Statistics 26. Количественные параметры сравнивали посредством комплексного многофакторного анализа ANOVA с повторяющимися измерениями. При попарном сравнении применяли процедуру Post Hoc Tests с поправкой Bonferroni. Отличия в группах исследования считали статистически значимыми при р<0,05.
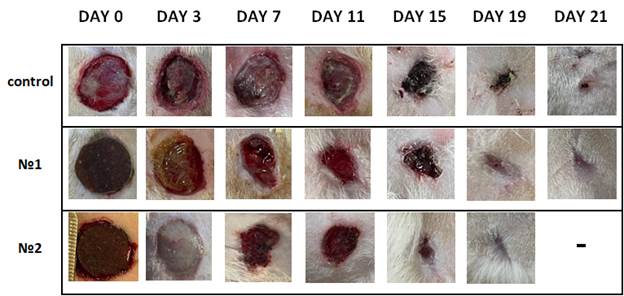
Результаты исследования и их обсуждение. Признаки инфицирования в зоне повреждения мягких тканей у экспериментальных животных развивались через 48 часов от внесения в рану бактериальных патогенов. К этому времени визуализировались парциальные некрозы кожи краев раны, отек и гиперемия. Цвет мышц в дне ран варьировал от желто-зеленого и бордово-синюшного до черного с участками некроза и налетами фибрина. Из ран поступало от 0,5 до 1,0 мл мутного отделяемого желто-зеленого цвета со зловонным запахом и примесью крови. На 3-и сутки эксперимента в группе контроля в ране преобладал гнойно-некротический характер воспаления, распространявшийся на поверхностные мышцы спины животных. Гнойное отделяемое в ГК сохранялось в течение 11–13 дней. В группе № 1 на 3-и сутки эксперимента в ранах отмечалась смена стадии воспалительного процесса на экссудативную. К 15-м суткам в ранах животных групп № 1 и ГК сформировался плотный струп, после отторжения которого к 21-м суткам констатирована эпителизация ран. В группе № 2 на 3-и сутки эксперимента на поверхности раневого дефекта сформировалась белесоватого цвета пленка, основу которой составляло помещенное на рану лекарственное покрытие. Заживление раневых дефектов в этой группе проходило без образования вторичного струпа с эпителизацией к 19-м суткам наблюдения (рис. 1).
|
|
Рис. 1. Визуальная картина процесса заживления ран кожи в динамике по данным фотофиксации в процессе эксперимента
Данные, представленные в таблице 1, позволяют констатировать, что в группе № 2 показатель уменьшения площади раневой поверхности в целом выше, чем в группах № 1 и контроля. На 19-е сутки эксперимента этот показатель в группе № 2 составил 98,4±1,34%, что на 21,13±0,9% больше, чем в ГК (p<0,05), и на 6,25±0.31% больше, чем в группе № 1 (p<0,05).
Таблица 1
Количественные параметры изменения площади раны кожи в динамике
|
Сроки наблюдения (сутки) |
Площадь раневой поверхности (% уменьшения от исх.) в группах |
||
|
контроля |
№ 1 |
№ 2 |
|
|
3-и |
5,22±0,24* |
19,6±4,6* |
26,6±3,41* |
|
7-е |
15,22±1,12* |
33,06±2,4* |
48,63±2,08* |
|
11-е |
25,2±3,67* |
47,95±1,78* |
57,95±3,66* |
|
15-е |
56,8±12,42 |
63,4±5,1* |
82,15±6,71* |
|
19-е |
77,27±2,24* |
92,15±1,65* |
98,4±1,34* |
|
21-е |
95,64±3,88* |
97,9±1,05* |
- |
Примечание: *p<0,05
При сравнении данных по группам № 1 и контроля показатель площади раневого дефекта был ниже в группе № 1. На 11-й день наблюдения в ГК он составил 25,2±3,67%, что в 1,95 раза меньше, чем в группе № 1 (47,95±1,78, p<0,05).
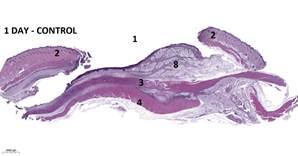
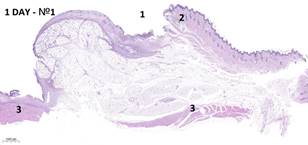
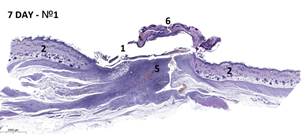
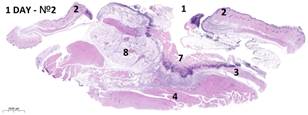
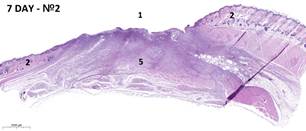
Морфологическое изучение комплекса тканей (зона экспериментальной раны, края дефекта кожи, подкожно-жировая клетчатка, участок подлежащих мышц) позволило установить, что степень выраженности некроза тканей и интенсивности фазы экссудации в воспалительном процессе к исходу недели после нанесения дефекта тканей отличалась в разных группах. Через день морфологические изменения в тканях животных всех групп оказываются идентичными и характеризуются интерстициальным отеком, геморрагическим пропитыванием из-за механической травмы. Основным патоморфологическим феноменом стало развертывание воспаления: паравульнарные ткани массивно инфильтрированы нейтрофилами, макрофагами, лимфоцитами и тучными клетками, выявлен отек всех слоев тканей. Структура мышц вблизи дефекта в основном сохранена, однако они несколько разволокнены, отечны. Интенсивность воспалительной инфильтрации в группах № 1 и № 2 оказалась менее выраженной, чем в ГК, что подтверждено морфометрическими исследованиями (p<0,05). В группе № 2 раньше сформировался демаркационный вал, отделяющий зону необратимого повреждения (рис. 2). Дно дефекта заполнено тканевым детритом, густо инфильтрированным полиморфноядерными лейкоцитами. Поверхностные мышцы спины в области дна раны отечны, эндомизий мозаично инфильтрирован нейтрофильными гранулоцитами. Во всех группах отмечено выбухание в раневой дефект отечной окружающей подкожной клетчатки.
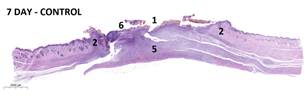
В ГК на 7-е сутки эксперимента раны оказались заполненными грануляционной тканью с полнокровными кровеносными сосудами. Поверхность ран покрыта струпом, сдерживающим краевую эпителизацию. В группе № 1 выявлены признаки формирования грануляционной ткани. Основу ее стромы составляли тонкие хаотично направленные пучки коллагеновых волокон, продуцируемых малодифференцированными фибробластами. В составе тонкостенных новообразованных сосудов выявлены гистиоциты и эндотелиоциты, единичные тучные клетки и лимфоциты. В группе № 2 на месте поверхностной мышцы сформирована грануляционная ткань. В ее структуре определялись единичные мышечные волокна в процессе деградации, а также вновь образованные кровеносные сосуды. Ближе к краям раны визуализировались сохранившиеся мышечные волокна с минимальной лейкоцитарной инфильтрацией и отеком стромального компонента. Констатированы признаки активной краевой эпителизации.
|
|
|
|
|
|
|
|
|
Рис. 2. Варианты гистологической картины раневых дефектов кожи:
1 – зона дефекта; 2 – края раны; 3, 4 – мышцы спины; 5 – грануляционная ткань; 6 – струп; 7– демаркационный воспалительный вал; 8 – жировая ткань.
Окраска: гематоксилин и эозин. Масштаб: 1:2000 µm
Количественно и качественно инфильтрацию мышечной ткани оценивали, анализируя участок поверхностных мышц спины крысы. По результатам морфометрического исследования (табл. 2) выявлено, что на 1-е сутки эксперимента в ГК инфильтрация лейкоцитов над мышцей была больше, чем в группах № 1 и № 2 (p=0,004). На 7-е сутки в группе № 1 показатель лейкоцитарной инфильтрации во всех слоях раны выше, чем в ГК и группе № 2 (p=0,001).
Таблица 2
Динамика показателей лейкоцитарной инфильтрации раны в 1-е и 7-е сутки после травмы
|
Группы |
Параметры лейкоцитарной инфильтрация тканей после нанесения травмы в течение |
|||||
|
1-е сутки |
7-е сутки |
|||||
|
эпимускулярно |
Интрамуску- лярно |
Субмуску-лярно |
Эпимуску-лярно |
Интрамуску-лярно |
Субмуску-лярно |
|
|
контроля |
405±78,4* |
269,3±114.7 |
279,4±63,8 |
550±198,3 |
501±51,5 |
490±131,9 |
|
№ 1 |
322,2±109,2 |
273±110,5 |
167,8±25,3 |
623±197,9* |
567±289,2* |
615±77,6* |
|
№ 2 |
122,7±28,2 |
135,5±97,7 |
295,5±104,1 |
405±52,7 |
218±74,6 |
186±60,2 |
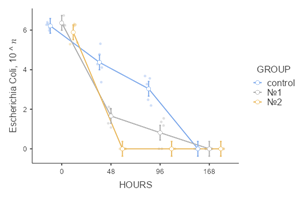
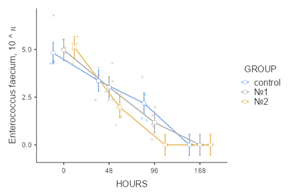
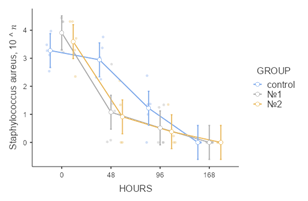
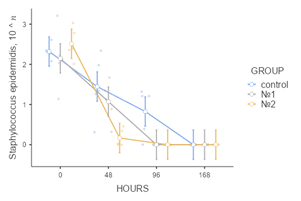
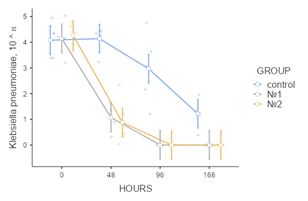
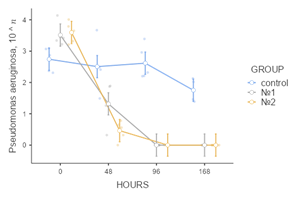
По результатам изучения данных о бактериологических посевах отделяемого из экспериментально созданных ран на начальном этапе исследования подтвержден полимикробный характер контаминации: обнаружены S. epidermidis, S. aureus, K. pneumoniae, P. aeruginosa. E. faecalis, E. coli. В экспериментальной группе № 2 показатель бактериальной контаминации оказался ниже, чем в других группах исследования, во все анализируемые сроки наблюдения. К 48 часам от начала учета данных эксперимента в ранах, укрытых мембранами «ЦМ» № 2, не обнаружено E.сoli (p<0,05), а концентрации St. epidermidis и K.pneumoniae стали минимальными (p<0,05), через 96 часов не обнаружено E.faecalis (p<0,05). Микробная контаминация в группе № 1 по сравнению с ГК также оказалась ниже, однако при исследовании E. faecalis в показателях этих групп не выявлено статистически значимой разницы (p=0,13). В экспериментальных группах животных, у которых лечение осуществлялось с применением лекарственных пластин, через 168 часов не обнаружено роста бактерий. В ГК в указанный промежуток времени сохранялся рост колоний K.pneumoniae, P.aeruginosa (рис. 3).
|
|
|
|
|
|
|
|
|
Рис. 3. Графические отображения изменения показателей микробной контаминации ран с учетом бактериальных групп патогенов
В эксперименте оценены возможности применения органических биоразлагаемых мембран «ЦМ» № 1 и № 2 в случаях дефектов мягких тканей. Пористые желатиновые композиты хорошо впитывают экссудат, что способствует эпителизации дефектов, сохраняя влагу. Желатиновая матрица покрытия обеспечивает механическую и структурную поддержку, способствует миграции клеток и эпителизации ран [6, 7].
В настоящее время для борьбы с очагами персистирующей хирургической инфекции в состав раневых покрытий добавляются неспецифические противомикробные лекарственные компоненты разнонаправленного действия [8]. Биоразлагаемые мембраны «ЦМ» содержат ряд противомикробных средств: натуральные природные компоненты (экстракты зверобоя, шалфея, тысячелистника), биосинтетический антибиотик широкого спектра действия (гентамицин).
Экстракт зверобоя in vitro обладает выраженным антимикробным действием в отношении грамположительных бактерий [9, 10]. Некоторые авторы сообщают об антиоксидантных свойствах экстракта тысячелистника, его выраженной фунгицидной активности, бактерицидном действии в отношении B. cereus, S.aureus [11]. Эфирное масло и спиртовой раствор экстракта шалфея оказывают клинически значимое бактерицидное и бактериостатическое действие в отношении B. cereus, B. megaterium, B. subtilis, E. faecalis, L. Monocytogenes, S. epidermidis, E. coli, K. oxytoca, K. pneumonia, P. morgani и S. enteritidis [12, 13]. Олеаноловая, урсоловая кислоты, тритерпеноиды, содержащиеся в шалфее, способны ингибировать рост полирезистентных бактерий (ванкомицинрезистентные энтерококки, пенициллинрезистентный Streptococcus pneumonia и метициллинрезистентный S. Aureus) [14, 15]. Таким образом, компоненты, входящие в состав лекарственных пластин «ЦМ», способствуют деконтаминации инфицированных дефектов мягких тканей и потенциально могут применяться в качестве современного эффективного перевязочного материала, что подтверждается проведенными экспериментальными изысканиями.
Заключение. При проведении исследования установлено, что аппликация лекарственных пластин «ЦМ», обладающих выраженным бактерицидным действием, способствует сокращению сроков эпителизации экспериментальных микробно контаминированных дефектов мягких тканей. В целом, лекарственные пластины «ЦМ» могут рассматриваться в качестве перспективного средства для оказания медицинской помощи пациентам с дефектами мягких тканей при явлениях раневой инфекции.