Впервые диагноз COVID-19 был установлен в г. Ухань в декабре 2019 г. На сегодняшний день во всем мире практически каждая семья столкнулась с SARS-CoV-2, возбудителем инфекции, в разной степени. Несмотря на устойчивое снижение уровня заболеваемости, COVID-19 остается с нами и требует дальнейшего мультидисциплинарного подхода к изучению. Течение COVID-19 может варьировать от гриппоподобных симптомов до тяжелых осложнений (19% пациентов), требующих госпитализации, в том числе и в отделение интенсивной терапии [1; 2]. Согласно современным представлениям, эндотелиальная дисфункция играет ключевую роль в патогенезе коронавирусной инфекции (COVID-19) и ее инвалидизирующих осложнений. Повреждение эндотелия происходит непосредственно вирусом, а также возникающей гиперэргической иммунной реакцией с развитием системного эндотелиита и клеточного апоптоза [3]. Характерным является гиперкоагуляционный синдром с тромбозами и эмболиями, а также повреждение органов иммунной системы [4]. При аутопсии умерших от COVID-19 основные патологические изменения выявляют в легких, однако нередко отмечают одновременное с легкими поражение других органов, которое по своей тяжести может превалировать над легочной патологией [5]. Учитывая наличие данных о поражении глаз при инфицировании COVID-19, необходимым является контроль офтальмологического статуса на разных стадиях заболевания, а также изучение влияния коморбидности на характер офтальмопатологии у пациентов, перенесших COVID-19-ассоциированную пневмонию [6]. Существует предположение, что остаточная активация иммунной системы после острой фазы может быть связана со стойкой эндотелиальной дисфункцией во время выздоровления. Европейское общество кардиологов подчеркивает необходимость клинической оценки функции эндотелия у пациентов с перенесённым COVID-19 для выявления отдаленных сердечно-сосудистых осложнений [7]. К факторам риска неблагоприятного течения инфекции относят пожилой возраст (60 лет и более), коморбидные состояния (сахарный диабет в 20% случаев, артериальную гипертензию в 15%, другие сердечно-сосудистые заболевания в 15%, фармакологическую иммуносупрессию, избыточную массу тела). Вероятность летального исхода повышается при прогрессирующей лимфопении, повышенных уровнях трансаминаз, лактатдегидрогеназы (ЛДГ), ИЛ-6, D-димера, ферритина [8]. Глазные проявления COVID-19 представлены неспецифическим поражением практически всех структур глазного яблока [9]. Наиболее часто в современной научной литературе описывается фолликулярный конъюнктивит как начальный или последующий симптом у пациентов с COVID-19 (приблизительно 3-10%, по разным источникам) [10; 11]. Для инфекционного заболевания характерны определенные периоды болезни, в том числе период реконвалесценции (ранней реконвалесценции – с 22-го дня болезни до 2 месяцев, поздней реконвалесценции до 2 лет) [12]. В любом периоде заболевания могут возникнуть осложнения основного процесса и признаки обострения или декомпенсации сопутствующей (коморбидной) патологии, что требует повышенного контроля, коррекции плана обследования и лечения [13].
Цель исследования. Изучение состояния иммунного ответа, коморбидности и офтальмопатологии у пациентов, перенесших COVID-19-ассоциированную пневмонию, в периоде реконвалесценции в зависимости от степени поражения легких.
Материал и методы исследования. Проведено рандомизированное исследование 90 пациентов (180 глаз) через три месяца после выписки из стационара с документированным диагнозом COVID-19-ассоциированной пневмонии. Все пациенты дали информированное согласие на участие в исследовании, которое проведено через институциональный этический комитет. Медиана возраста обследуемых пациентов составляет 48 лет (от 19 до 78 лет). Пациенты разделены на три группы (по 30 человек) в зависимости от тяжести перенесенного заболевания (степень поражения легких по данным КТ на момент госпитализации в острый период). Всем пациентам проводили общеклиническое обследование (общий и биохимический анализ крови, ЭКГ, эхокардиография, КТ легких), осмотр кардиолога, врача функциональной диагностики, офтальмолога. Офтальмологическое обследование включало стандартные методы: визометрию с определением максимально корригируемой остроты зрения, авторефрактометрию, тонометрию, периметрию, биомикроскопию, осмотр глазного дна в условиях мидриаза с помощью асферичной высокодиоптрийной линзы 90Д. С целью выявления нарушений регионарного кровообращения проводилась фотофиксация сосудов бульбарной конъюнктивы при помощи щелевой лампы Slit Lamp SL-45 с использованием CMOS (5Мp) видеокамеры.
Биохимический анализ крови включал изучение липидного спектра, уровня толерантности к глюкозе, содержания интерлейкинов (ИЛ) – ИЛ-1, ИЛ-6, ИЛ-8. Текущий иммунный статус к SARS-CoV-2 оценивали по наличию иммуноглобулинов IgG (количественно, ОЕ/мл). В первую группу (объем поражения легких КТ-1, <25%) вошли 17 (56,7%) мужчин, средний возраст 35 (19-71) лет, и 13 (43,3%) женщин, средний возраст 45 (24-66) лет; во вторую группу (КТ-2, 25-50%) – 18 (60,0%) мужчин, средний возраст 54 (29-75) года, и 12 (40,0%) женщин, средний возраст 50 (20-68) лет; в третью группу (КТ-3, 50-75%) – 9 (30,0%) мужчин, средний возраст 47 (36-62) лет, и 21 (70,0%) женщина, средний возраст 51 (27-78) год.
Критерии включения: больные, находившиеся на стационарном лечении с документированным диагнозом «COVID-19-ассоциированная пневмония», через три месяца после выписки, в возрасте старше 18 лет, давшие письменное информированное согласие на участие в исследовании.
Критерии исключения: травма органа зрения, хроническое воспаление сосудистой оболочки, сетчатки и зрительного нерва в анамнезе, не ассоциированные с COVID-19, наследственная патология органа зрения (сетчатки и зрительного нерва).
Статистическую обработку результатов при оценке данных лабораторного обследования осуществляли на основании пакета программ IBM SPSS STATISTICS 23.0. Уровни определяемых показателей описывали на основании медианы и интерквартильного размаха (Me [25%; 75%]). Статистическую значимость различий показателей между группами оценивали непараметрическими методами. Статистически значимыми считались различия при P<0,05. Для выявления связей между исследуемыми показателями применяли корреляционный анализ по методу Спирмена (r).
Результаты исследования и их обсуждение. В исследуемых группах при анализе зависимости между тяжестью заболевания (COVID-19-ассоциированная пневмония) и полом в первой и второй группах не выявлено значительной статистически значимой связи, однако в третьей группе наблюдается преобладание женского пола (r=+0,267, P=0,011). В первой и второй группах определяется зависимость тяжести заболевания от возраста (r=-0,341, P=0,001 и r=+0,253, P=0,016 соответственно), в первой группе средний возраст составил 40 лет, тогда как во второй группе 53 года, в третьей группе не выявлено статистически значимой зависимости от возраста.
Сопутствующая патология диагностирована в виде дислипидемии, артериальной гипертензии, метаболического синдрома, сахарного диабета, которые встречались во всех группах с разной частотой (рис. 1).
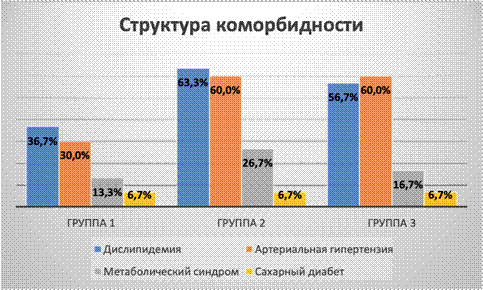
Рис. 1. Структура коморбидности в исследуемых группах
Наличие артериальной гипертензии и дислипидемии является неблагоприятным (утяжеляющим) фактором степени поражения легких (r=-0,267, P=0,011 и r=-0,220, P=0,037, соответственно). Достоверной зависимости между наличием метаболического синдрома, сахарного диабета и тяжестью поражения легких не отмечено. Однако выявлена зависимость тяжести заболевания от индекса массы тела (ИМТ), в первой и третьей группах (r=-0,303, P=0,004 и r=+0,313, P=0,003, соответственно), в первой группе средний ИМТ составил 26,35 (20,05-43,85), тогда как в третьей группе на уровне 30,45 (22,86-42,31). При оценке уровней медиаторов воспаления (интерлейкины 1, 6, 8) не наблюдается превышение референсных значений (ИЛ-1 0-4,9 пг/мл; ИЛ-6 0-7 пг/мл; ИЛ-8 <62 пг/мл) во всех трех группах. В первой группе среднее значение интерлейкинов 1, 6, 8 составляет 1,73 (1,14-4,02), 1,8 (0,4-3,8) и 13,6 (3,9-24,6), соответственно; во второй группе – в пределах 1,83 (0,84-3,71), 2,07 (0,3-3,9) и 14,98 (2-63,2), соответственно. В третьей группе значения также находятся в пределах нормы 1,86 (0,78-4,29), 2,37 (0,8-13,6) и 14,02(2,5-23,8), соответственно. При оценке формирования текущего гуморального иммунного ответа отмечаются более высокие показатели уровня иммуноглобулина G (IgG) у пациентов с тяжелым поражением легких в анамнезе. Это подтверждается статистически (зависимость в первой и третьей группах r=-0,291, P=0,006 и r=+0,301, P=0,004, соответственно) (рис. 2).
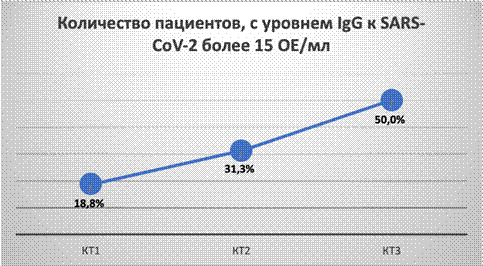
Рис. 2. Количество пациентов, в %, с уровнем иммуноглобулинов G (IgG) к SARS-CoV-2 более 15 ОЕ/мл (относительная единица на миллилитр)
Детальный анализ офтальмологических проявлений представлен в таблице 1.
Таблица 1
Структура офтальмопатологии в исследуемых группах
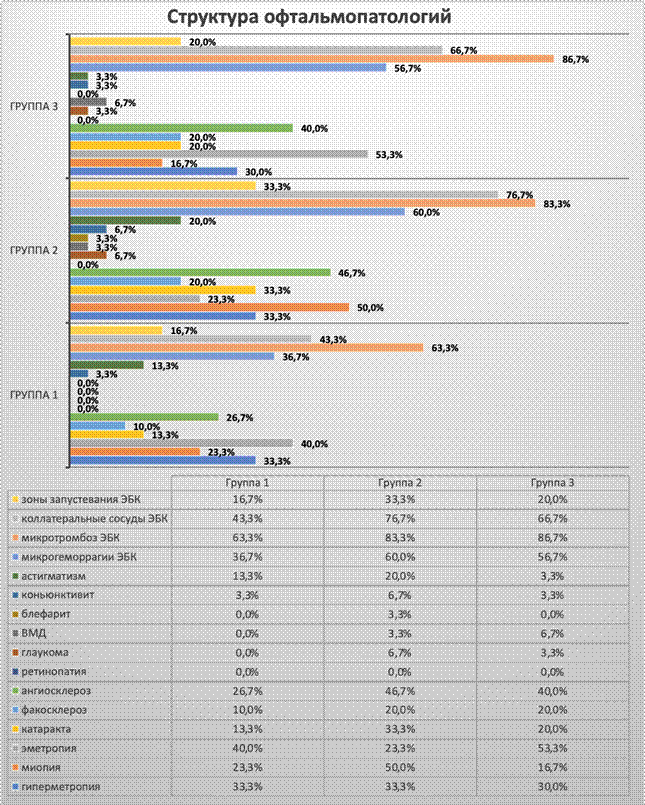
Примечание: ЭБК – эпибульбарная конъюнктива, ВМД – возрастная макулодистрофия.
При исследовании офтальмологического статуса выявлено достоверное преобладание миопии (r=+0,309, P=0,003) и уменьшение частоты встречаемости эмметропии (r=-0,226, P=0,032) у пациентов второй группы. Фоновое изменение сосудов сетчатки не зависит от степени поражения легких, однако выявлена прямая корреляционная зависимость от наличия артериальной гипертензии (r=+0,562, P=0,000) и дислипидемии (r=+0,654, P=0,000). Патология хрусталика (факосклероз, катаракта) не зависит от тяжести поражения легких, в то же время наблюдается статистически значимая прямая корреляционная связь с дислипидемией (r=+0,368, P=0,000 и r=+0,297, P=0,004, соответственно). Частота встречаемости дегенеративных изменений заднего полюса глазного яблока (возрастная макулодистрофия – ВМД) и нарушений гидродинамики (глаукома) не отличается от частоты встречаемости в обычной популяции [14]. Поражения век и конъюнктивы чаще встречаются у пациентов второй группы (10%) по сравнению с первой и третьей группами. Нарушения микроциркуляции бульбарной конъюнктивы выявлены в виде паравазальных (микрогеморрагии), внутрисосудистых изменений (микротромбозы), а также изменений формы сосудов (зоны запустевания и наличие коллатеральных сосудов) (рис. 3).
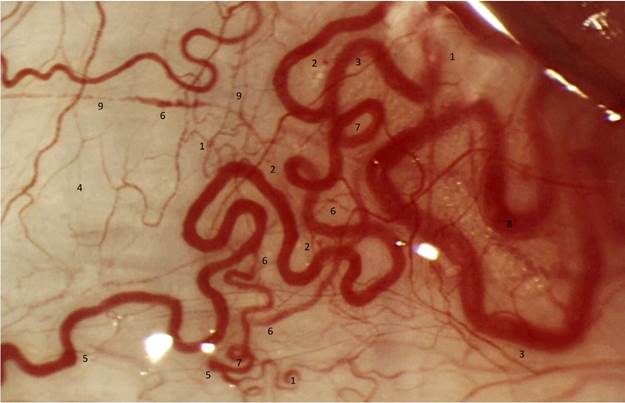
Рис. 3. Биомикроскопия конъюнктивы пациента С., 64 года: 1 – периваскулярный отек, 2 – единичная геморрагия, 3 – уменьшение артериовенозного соотношения более ¼, 4 – зоны запустевания, 5 – аневризмы в венулах и капиллярах, 6 – микротромбоз, 7 – патологическая извитость вен, неравномерный калибр, 8 – коллатеральные сосуды конъюнктивы, 9 – сладж-феномен
Анализ зависимости нарушений микроциркуляции от клинических данных пациентов представлен в таблице 2.
Таблица 2
Корреляционные связи между нарушениями микроциркуляции конъюнктивы и клиническими данными пациентов, перенесших COVID-19-ассоциированную пневмонию
|
Исследуемый показатель |
Изменения |
Формы сосудов |
||||||
|
паравазальные |
внутрисосудистые |
зоны запустевания |
коллатеральные сосуды |
|||||
|
r |
P |
r |
P |
r |
P |
r |
P |
|
|
Возраст |
- |
- |
+0,570 |
0,000 |
- |
- |
+0,416 |
0,000 |
|
ИМТ |
+0,239 |
0,023 |
+0,418 |
0,000 |
- |
- |
+0,307 |
0,003 |
|
Артериальная гипертензия |
+0,311 |
0,003 |
+0,452 |
0,000 |
- |
- |
+0,448 |
0,000 |
|
Дислипидемия |
+0,266 |
0,011 |
+0,505 |
0,000 |
+0,212 |
0,045 |
+0,356 |
0,001 |
|
Метаболический синдром |
+0,245 |
0,02 |
+0,258 |
0,014 |
- |
- |
+0,317 |
0,002 |
Обращает внимание наличие положительных корреляционных связей возраста пациентов, индекса массы тела (ИМТ), артериальной гипертензии (АГ), дислипидемии и метаболического синдрома с нарушениями микроциркуляции конъюнктивы, что может свидетельствовать о влиянии сопутствующих заболеваний на степень выраженности офтальмопатологии. В исследуемых группах прямой корреляционной связи между степенью поражения легких при COVID-19-ассоциированной пневмонии и изменениями микроциркуляции бульбарной конъюнктивы не выявлено.
Заключение. Наше исследование показало отсутствие превышения значений медиаторов воспаления (ИЛ-1, ИЛ-6, ИЛ-8) в периферической крови у пациентов, перенесших COVID-19-ассоциированную пневмонию, через три месяца после выписки из стационара. Формирование выраженного иммунного ответа зависит в том числе от тяжести (по данным КТ) перенесенного заболевания.
Утяжеляющими факторами течения заболевания в большей степени являются пожилой возраст, артериальная гипертензия, дислипидемия и ожирение. Метаболический синдром и сахарный диабет встречаются с одинаковой частотой. Женщины более старшего возраста с сопутствующей коморбидностью подвержены более тяжелой форме поражения легких.
Офтальмологические проявления в исследуемых группах характеризуются нарушением микроциркуляции бульбарной конъюнктивы, особенностью которой являются сосудистые, внутрисосудистые и внесосудистые изменения, связанные с коморбидными заболеваниями [15]. В ходе исследования выявлено преобладание нарушений микроциркуляции бульбарной конъюнктивы у пациентов второй и третьей группы по сравнению с пациентами первой группы: наличие паравазальных геморрагий выше в 1,63 и 1,54 раза; микротромбозов – в 1,31 и 1,37 раза; наличие коллатеральных сосудов – в 1,77 и 1,54 раза; зон запустевания – в 1,99 и 1,20 раза, соответственно. Такую разницу можно объяснить, на наш взгляд, менее выраженной сопутствующей патологией у пациентов первой группы, а также выраженностью изменений (преобладанием дислипидемии и метаболического синдрома) в структуре коморбидности у пациентов второй группы. Особенностью офтальмологических проявлений в постковидном периоде является наличие фоновых изменений (в зависимости от коморбидности) конъюнктивы (паравазальные, внутрисосудистые нарушения, изменение формы сосудов), внутренних структур глаза (хрусталика), сетчатки (ретинопатия, ВМД), нарушение гидродинамики (глаукома). Аномалии рефракции (миопия, астигматизм) преобладают у пациентов второй группы, также в этой группе в единичных случаях встречается конъюнктивит. Следует отметить, что накопленный опыт за период пандемии COVID-19 свидетельствует о возможном поражении глаз в разные периоды заболевания. Из этого следует, что стратификация рисков офтальмопатий требует дальнейшего изучения.



