Сепсис определяется как жизнеугрожающая острая органная дисфункция, возникающая в результате нарушения регуляции ответа макроорганизма на инфекцию, которая остается основной причиной высокой смертности в отделениях интенсивной терапии [1,2]. Одна из трудностей лечения сепсиса связана с неоднородностью этиологической структуры и способов определения первичного очага инфекции. Причинами развития сепсиса являются как внебольничные, так и внутрибольничные инфекции [3]. Благоприятный исход сепсиса напрямую зависит от своевременного обнаружения патогенов в культурах крови, что является золотым стандартом для диагностики сепсиса [4].Однако длительное время, необходимое для получения результатов посева, и высокие отрицательные результаты посевов у пациентов с сепсисом в значительной степени ограничивают его клиническую применимость[5]. В связи с этим диагностика сепсиса всегда была и остается серьезной проблемой.
Несмотря на то что за последние десятилетия при сепсисе было оценено более 100 биомаркеров, до сих пор ни один из них не считается адекватным для рутинного клинического использования [6].Еще в 1985 г. Wassonet al. [7]определили, что полезный диагностический биомаркер сепсиса должен соответствовать четырем критериям: биологическая достоверность, высокая чувствительность, специфичность и положительная и отрицательная прогностическая ценность интересующего исхода. Поэтому для назначения ранней этиотропной антибиотикотерапии и снижения устойчивости микроорганизмов к антибактериальным препаратам необходимы лабораторные инструменты для выявления пациентов с тяжелыми инфекциями и дифференцирования небактериальных и бактериальных состояний.
Нейтрофилы являются наиболее распространенными лейкоцитами в крови и одними из первых клеток, которые активируются в ответ на инфекцию, что указывает на то, что они могут сильно влиять на первоначальный иммунный ответ[8,9].Антимикробная активность нейтрофилов заключается в распознавании вторгающихся патогенов и микробных компонентов, запускающих последующий сигнальный путь, ведущий к высвобождению воспалительных цитокинов и хемокинов, генерации оксидантов, фагоцитозу, дегрануляции и высвобождению ядерных нитей в виде нейтрофильных внеклеточных ловушек (НВЛ, NET) для уничтожения микробов[10].
Цель исследования: сравнить показатели функциональной активности нейтрофилов, НВЛ, уровней PAD4, ИЛ-1β, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-18, ФНО-α у пациентов с сепсисом и оценить возможность использования изучаемых иммунологических показателей в ранней диагностике бактериального сепсиса.
Материал и методы исследования
Исследование проводилось на базе Центральной научно-исследовательской лаборатории и Научно-исследовательского института иммунологи ФГБОУ ВО ЮУГМУ Минздрава России, а также в лаборатории клинической микробиологии ГБУЗ «ЧОКБ» и согласовано на заседании этического комитета. В иммунологическое исследование были включены 48 пациентов с сепсисом, находившихся на лечении в отделениях реанимации и интенсивной терапии хирургического профиля ГБУЗ Челябинская областная клиническая больница, диагноз выставлялся врачом-клиницистом. Средний возраст больных составил 53±2,17 года. Материал для исследования забирали сразу после выставления диагноза на 1-е и 3-и сутки. Контрольную группу составили 20 условно здоровых лиц в возрасте 38–60 лет, у которых отсутствуют хронические, онкологические, геморрагические, иммунологические, гематологические заболевания. Для посева крови использовались стандартные коммерческие флаконы с готовой питательной средой. Идентификация выделенных микроорганизмов проводилась с помощью рутинных микробиологических методов и анализатора VITEK®2Compact (BioMerieux, Франция). В зависимости от результатов бактериологического исследования пациенты были поделены на группы с положительной (идентифицированы бактерии) и отрицательной гемокультурой, которые были сопоставимы по полу и возрасту. Иммунологическое исследование включало подсчет лейкоформулы, изучение функциональной активности нейтрофилов (фагоцитарная активность и НСТ-тест), уровень нейтрофильных внеклеточных ловушек, уровней PAD4, ИЛ-1β, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-18, ФНО-α. Анализ фагоцитарной активности проводили по методике И.С. Фрейдлин Постановку НСТ теста осуществляли в аранжировке А.Н. Маянского и М.Е. Виксмана [11]. Обнаружение нейтрофильных внеклеточных ловушек проводили путем окраски препарата по Романовскому–Гимзе [12]. Подсчет НВЛ выполняли в фиксированных препаратах цельной крови, приготовленных аналогично мазку крови для подсчета лейкоцитарной формулы. Учет окрашенных мазков проводили с помощью иммерсионного объектива светового микроскопа, увеличение х100. Определение уровней PAD4 и цитокинов осуществляли методом ИФА на автоматическом иммуноферментном анализаторе Adaltis Personal Lab (Италия) с помощью тест-систем производства «Вектор-Бест» (Новосибирск, Россия) для цитокинов и «Fine Biotech» (Китай) для PAD4.
Статистический анализ полученных данных проводили с использованием статистического пакета Past 4.05 (Past4Project) и MedCalc 20.104 – 64 – bit (MedCalc® statistical software 1993–2022). В ходе статистического анализа полученных данных использовали методы описательной статистики, выборочных сравнений и многомерные методы. Распределение признаков отличалось от нормального, поэтому для количественных переменных определяли медиану Me и интерквартильный интервал (IQR, 25%:75%). При сравнении трех групп использовали критерий Краскела–Уоллиса. Внутригрупповое сравнение выборок проводили по критерию Уилкоксона. При получении статистически достоверных результатов проводили множественные попарные апостериорные сравнения, используя критерий Данна. Дляоценки диагностической значимости количественных признаков припрогнозировании, рассчитанной спомощью регрессионной модели, применяли метод анализа ROC-кривых. Различия показателей считали статистически значимыми при p<0,05.
Результаты исследования и их обсуждение
Была проведена оценка результатов изучаемых иммунологических параметров у пациентов с сепсисом на 1-е и 3-и сутки в зависимости от результата бактериологического исследования посева крови. Сравнительный анализ иммунологических показателей был проведен в группах пациентов с положительной и отрицательной гемокультурой по сравнению с контрольной группой на 3-и сутки относительно 1-х суток внутри групп, отдельно на 1-е и 3-и сутки между группами. Данные сравнительного анализа представлены в таблицах 1, 2, 3.
Показатели общего количества лейкоцитов, абсолютное и относительное число нейтрофилов, палочкоядерных и сегментоядерных нейтрофилов, абсолютное количество моноцитов достоверно было выше, а относительное и абсолютное содержание лимфоцитов – ниже у пациентов в обеих группах на 1-е и 3-и сутки в сравнении с контрольной группой (табл. 1). У пациентов с положительным посевом крови на 3-и сутки относительное количество лимфоцитов повышалось в сравнении с аналогичным показателем в 1-е сутки. При межгрупповом сравнении на 1-е и 3-и сутки статистически значимых изменений показателей форменных элементов крови обнаружено не было.
Следующий этап исследования заключался в изучении НВЛ и функциональной активности нейтрофилов и представлен в таблице 2. В изучаемых группах пациентов с сепсисом относительное и абсолютное количество НВЛ статистически значимо было выше независимо от суток наблюдения, чем показатели в контрольной группе. Фагоцитарное число у пациентов с положительной гемокультурой в 1-е сутки и отрицательной гемокультурой в обеих временных точках было выше по сравнению с данным показателем в контрольной группе. В динамике в группе с отрицательной гемокультурой на 3-и сутки относительные и абсолютные показатели НВЛ были выше, чем в 1-е сутки. Межгрупповое сравнение у пациентов с положительным посевом крови показало, что относительное и абсолютное количество НВЛ в 1-е сутки и фагоцитарное число на 3-и сутки увеличивались относительно пациентов с отрицательной гемокультурой на 1-е и 3-и сутки соответственно. При анализе НСТ-теста не было получено достоверных различий.
Ведущую роль в возникновении тяжелых инфекций играют сбои и дисфункции цитокиновой регуляции иммунобиологических процессов [13], что и стало следующим этапом исследования – изучение уровней ИЛ-1β, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-18, ФНО-α.
Таблица 1
Показатели лейкоцитарной формулы у больных с сепсисом в зависимости от результата бактериологического исследования посева крови (Ме [Q1–Q3])
|
Показатели |
Контрольная группа |
Положительная гемокультура (n=30) |
Отрицательная гемокультура (n=18) |
||
|
1-е сутки |
3-и сутки
|
1-е сутки |
3-и сутки
|
||
|
1 |
2 |
3 |
4 |
||
|
Общее количество лейкоцитов, х109/л |
4,95 (4,45; 5,68) |
12,1* (7,93; 15,15) |
9,7* (7,36; 13,83) |
10,85* (7,65; 15) |
12,07* (9,15; 14) |
|
Нейтрофилы юные, % |
0 (0; 1) |
1,0 (0; 2) |
0 (0; 2) |
2,0 (0; 4,25) |
1,0 (0; 4) |
|
Нейтрофилы палочкоядерные, % |
1,0 (0; 2) |
9,5* (4,75; 16,5) |
9,0* (4; 11,5) |
10,5* (4,75; 15,25) |
10,0* (5; 13) |
|
Нейтрофилы сегментоядерные, % |
54,0 (49,25; 63) |
70,0* (64,5; 79) |
73,0* (64,5; 78) |
70,0* (67,25; 78,5) |
78,0* (69; 79,5) |
|
Моноциты, % |
4 (2,25; 6) |
5 (3; 6,25) |
5 (1,5; 7) |
4 (2; 6,25) |
3 (1,5; 5,5) |
|
Моноциты, х109/л |
0,23 (0,10 ;0,29) |
0,59* (0,29; 0,74) |
0,35* (0,14; 0,82) |
0,38* (0,27; 0,70) |
0,35* (0,18; 0,67) |
|
Лимфоциты,% |
18,0 (14; 21) |
7,0* (4,0; 11,50) |
11,0* (7; 13,5) |
8,5* (6; 13,5) |
6,0* (4,5; 10) |
|
Лимфоциты, х109/л |
0,83 (0,74; 1,04) |
0,795 (0,57; 1,06) |
1,02 (0,53; 1,69) |
0,91 (0,63; 1,29) |
0,8 (0,54; 1,17) |
|
Нейтрофилы, % |
59,0 (51; 64,25) |
85,0* (79,5; 89,25) |
83,0* (78,5; 87) |
81,5* (76; 88,25) |
86,0* (83,5; 88,5) |
|
Нейтрофилы, х109/л |
2,99 (2,36; 3,43) |
10,39* (6,40 13,39) |
7,56* (5,52 11,36) |
8,42* (5,87 13,46) |
10,09* (8,10 12,11) |
Примечание к таблице 1:
* – достоверность отличий показателей больных от показателей группы контроля, p<0,05, критерий Краскела–Уоллиса
** – достоверность различий показателей у больных с сепсисом и положительным результатом гемокультуры на 1-е и 3-и сутки, p<0,05, критерий Уилкоксона
Также нам представилось интересным изучить уровень пептидил-аргинин-деиминазы 4 (PAD4) – кальций-зависимого фермента, который катализирует превращение пептидил-аргинина в пептидил-цитруллин и необходим для образования НВЛ [13].
Таблица 2
Показатели НВЛ и функциональной активности нейтрофилов у больных с сепсисом в зависимости от результата бактериологического исследования посева крови (Ме [Q1–Q3])
|
Показатели |
Контрольная группа |
Положительная гемокультура (n=30) |
Отрицательная гемокультура (n=18) |
||
|
1-е сутки |
3-и сутки
|
1-е сутки |
3-и сутки
|
||
|
|
1 |
2 |
3 |
4 |
|
|
НВЛ, % |
1,5 (0,25; 2) |
25,0* (13,75; 35,75) |
20,0* (11; 36) |
12,0*/# (4; 16,5) |
22,0*/*** (13; 39) |
|
НВЛ, х109/л |
0,06 (0,01; 0,14) |
2,37* (1,21; 4,7) |
2,39* (0,8; 4,16) |
1,05*/# (0,52; 1,98) |
2,72*/*** (1,76; 4,34) |
|
Фагоцитарная активность, % |
58,0 (52,5; 63) |
52,0 (29,5; 65,25) |
42,0 (32; 63) |
51,0 (28; 71,75) |
55,0 (34,5; 76,5) |
|
Интенсивность фагоцитоза, усл. ед. |
1,90 (1,46; 2,36) |
3,01 (1,08; 6,21) |
2,18 (0,88; 5,92) |
3,86 (1,04 7,83) |
6,98 (1,37; 10,15) |
|
Фагоцитарное число, усл. ед. |
3,35 (2,43; 4,55) |
5,80* (3,18; 9,7) |
5,20 (2,5; 8,4) |
8,7* (3,63; 13,53) |
11,5*/& (3,6; 14,75) |
Примечание к таблице 2:
* – достоверность различий показателей больных от показателей группы контроля, p<0,05, критерий Краскела–Уоллиса
*** – достоверность различий показателей у больных с сепсисом и отрицательным результатом гемокультуры на 1-е и 3-и сутки, p<0,05, критерий Уилкоксона
# – достоверность различий показателей у больных с сепсисом при положительном и отрицательном результате гемокультуры на 1-е сутки, p<0,05, критерий Краскела–Уоллиса
& – достоверность различий показателей у больных с сепсисом при положительном и отрицательном результате гемокультуры на 3-и сутки, p<0,05, критерий Краскела–Уоллиса
При анализе показателей PAD 4 и цитокинового профиля у пациентов обеих изучаемых групп независимо от результатов бактериологического исследования наблюдаются статистически достоверные различия уровней PAD4, ИЛ-1β, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-18 при сравнении показателей больных с сепсисом с отрицательной и положительной гемокультурой на 1-е и 3-и сутки в сравнении с контрольной группой. ФНО-α был выше контрольных значений только в группах с положительной культурой на 1-е и 3-и сутки, а также у пациентов с отрицательной культурой на 1-е сутки. При внутригрупповом сравнении показателей у пациентов обеих групп на 3-и сутки отмечено снижение уровня PAD4 относительно 1-х суток, однако достоверно значимым результат был только в группе с отрицательной гемокультурой. Также в группе больных с положительной гемокультурой уровни ИЛ-10 и ФНО-α снижались на 3-и сутки по сравнению с 1-ми сутками, аналогичная тенденция, но без достоверно значимых различий, наблюдалась и в группе пациентов с отрицательной гемокультурой.
Таблица 3
Показатели PAD 4 и цитокинов у больных с сепсисом в зависимости от результата бактериологического исследования посева крови (Ме [Q1...Q3])
|
Показатели |
Контрольная группа |
Положительная гемокультура (n=30) |
Отрицательная гемокультура (n=18) |
||
|
1-е сутки |
3-е сутки
|
1-е сутки |
3-и сутки
|
||
|
|
к |
1 |
2 |
3 |
4 |
|
PAD4, пг/мл |
0,97 (0,45; 1,21) |
35,9* (31,15; 53,1) |
30,1* (26,63; 37,65) |
30,4* (27,2; 36,7) |
26,95*/*** (25,35; 30,93) |
|
ИЛ-1β, пг/мл |
1,53 (1,38; 1,86) |
2,74* (2,13; 3,55) |
2,1* (0,97; 3,35) |
4,11* (2,02; 6,73) |
2,1* (1,90; 2,80) |
|
ИЛ–6, пг/мл |
21,66 (19,98; 23,90) |
108,81* (67,03; 215,57) |
69,7* (35,16; 133,28) |
142,51* (27,18; 365,46) |
90,78* (47,39; 186,99) |
|
ИЛ–8, пг/мл |
16,82 (15,58; 18,11) |
83,76* (53,59; 146,66) |
78,565* (42,76; 137,72) |
68,73* (52,6; 88,62) |
55,47* (27,39; 80,44) |
|
ИЛ–10, пг/мл |
8,44 (7,87; 9,17) |
23,75* (14,78; 48,32) |
15,87*/** (9,30; 32,88) |
24,5* (14,78; 50,52) |
17,17* (8,59; 37,5) |
|
ИЛ–18, пг/мл |
270,55 (265,02; 283,45) |
759,08* (552,36; 994,12) |
644,50* (511,95; 983,23) |
751,67* (582,64; 979,52) |
741,65* (370; 990,31) |
|
ФНО-α, пг/мл |
2,23 (2,13; 3,01) |
8,18* (5,05; 14,58) |
4,79*/** (2,52; 6,75) |
5,32* (3,75; 13,25) |
3,71 (1,48; 12,07) |
Примечание к таблице 3:
* – достоверность различий показателей больных от показателей группы контроля, p<0,05, критерий Краскела–Уоллиса
** – достоверность различий показателей у больных с сепсисом и положительным результатом гемокультуры на 1-е и 3-и сутки, p<0,05, критерий Уилкоксона
*** – достоверность различий показателей у больных с сепсисом и отрицательным результатом гемокультуры на 1-е и 3-и сутки, p<0,05, критерий Уилкоксона
Так как относительное количество НВЛ в крови статистически достоверно отличалось у пациентов с положительной и отрицательной гемокультурой в 1-е сутки, а способ их определения достаточно простой и дешевый, следующий этап исследования заключался в определении прогностической ценности данного показателя с помощью ROC-анализа. В качестве зависимой переменной был определен бинарный признак 1 – положительная гемокультура, 0 – отрицательная гемокультура. Независимая переменная – относительное количество НВЛ (%) в крови. Результаты ROC-анализа для показателя относительного количества НВЛ представлены в таблице 4 и на рисунке.
Таблица 4
Характеристики диагностической эффективности показателя НВЛ (относительное количество, %) у больных с сепсисом в зависимости от результата бактериологического исследования посева крови
|
Срок |
Площадь под ROC-кривой [95% ДИ] |
Чувствительность / Специфичность, % [95% ДИ] |
+LR |
–LR |
+PV |
–PV |
Критерий |
Значимость |
|
1-е сутки |
0,829 [0,692; 0,922] |
60,0 [40,6; 77,3] 100,0 [81,5; 100,0] |
– |
0,4 |
100 |
60 |
>23 |
z=5,727 p<0,0001 |
|
+LR – положительное отношение правдоподобия; –LR – отрицательное отношение правдоподобия; +PV – положительное прогностическое значение; –PV – отрицательное прогностическое значение |
||||||||
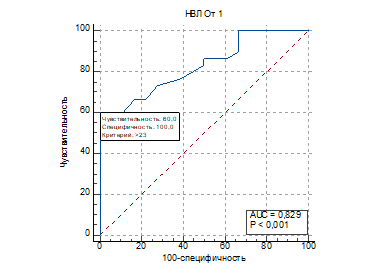
ROC-кривая диагностической эффективности показателя относительного количества НВЛ в крови при выявлении гемокультуры, р – показатель достоверности результатов, AUC – площадь под ROC-кривой
На графике представлена информация о диагностической эффективности относительного количества НВЛ (%) в крови у пациентов с положительной и отрицательной гемокультурой. Площадь под ROC-кривой составила 0,829, что демонстрирует очень хорошее качество модели. При относительном количестве НВЛ в крови более 23% у пациента с сепсисом можно прогнозировать положительные результаты бактериологического посева крови с диагностической чувствительностью 60% и специфичностью 100%.
Заключение. Раннее выявление возбудителя из крови по-прежнему остается главной проблемой при сепсисе, так как время получения микробиологического заключения может составлять от 5 до 7 дней. С учетом имеющихся данных о том, что сепсис напрямую влияет на иммунную систему, изменяя продолжительность жизни и функцию эффекторных клеток, ответственных за гомеостаз организма [14], а каждый час задержки введения антибактериального препарата повышает риск летальности на 6% [15], мы предположили, что один или несколько факторов врожденного иммунитета могут выступать в качестве биомаркеров положительного результата гемокультуры до момента получения микробиологического заключения. Исследования продемонстрировали, что способность образовывать НВЛ в крови характерна для пациентов с сепсисом независимо от результатов бактериологического посева крови и суток наблюдения. Однако полученная достоверная разница в данном показателе между пациентами с положительной и отрицательной гемокультурой дала возможность оценить его в прогностической модели. И, несмотря на уже известные представления об участии нейтрофилов и НВЛ в патогенезе сепсиса, нам удалось получить новые результаты использования относительного количества НВЛ (%) в крови как прогностического биомаркера бактериального сепсиса. К тому же мы предположили, что изучаемые факторы врожденного иммунитета можно использовать и для дифференциальной диагностики грамотрицательного и грамположительного сепсиса, что будет отражено в наших последующих исследованиях. Полученные результаты показывают значимость факторов врожденного иммунитета в регуляции иммунного ответа при развитии сепсиса, что говорит о важности дальнейшего их изучения при септических состояниях.



