Состояние роговицы (выраженность послеоперационного отека, потери эндотелиальных клеток, конфигурация операционных разрезов) является важным показателем безопасности хирургии катаракты [1-3]. Операционная травма роговицы может быть вызвана длительным воздействием ультразвуковой энергии и ирригационных потоков, механической травмой хирургическими инструментами и фрагментами хрусталика, резкими перепадами внутриглазного давления [2; 4-7].
Помимо этапа удаления ядра, которому традиционно уделяется большое внимание, высокий риск повреждения роговицы возникает и на этапе удаления кортикальных масс хрусталика.
С целью снижения воздействия вышеперечисленных повреждающих факторов предложены различные медико-технические решения, которые в основном касаются этапа удаления ядра. Однако, учитывая тенденцию к совершенствованию и повышению безопасности хирургии катаракты, и на этапе удаления кортикальных масс имеется потенциал [8].
Для повышения эффективности и безопасности данного этапа на базе отдела микрохирургического оборудования ЗАО «Оптимедсервис» разработана система для ультразвуковой аспирации кортикальных масс (патент РФ № 2679305 «Способ аспирации кортикальных масс и устройство для его осуществления» от 06.02.2019) [9]. Отличительной особенностью данной системы является возможность использования дополнительной дозированной ультразвуковой энергии, благодаря которой облегчается эвакуация кортикальных масс. Это сокращает длительность операции, уменьшается длительность воздействия ирригационных потоков на эндотелий роговицы, снижается необходимость дополнительных манипуляций хирургическими наконечниками, направленными на измельчение трудноаспирируемых кортикальных масс [10]. Вместе с тем требует изучения степень влияния дополнительной ультразвуковой энергии на состояние роговицы при использовании разработанной системы.
Цель исследования – изучить гистологические особенности роговицы кроликов после экспериментальной ультразвуковой аспирации кортикальных масс хрусталика.
Материал и методы исследования
Эксперименты были выполнены на 20 кроликах породы шиншилла (масса 2,2±0,2 кг, возраст 4,9±0,8 месяца) с соблюдением общепринятых принципов гуманности, согласно правилам проведения работ с использованием экспериментальных животных (Приказ Минздрава России от 01.04.2016 г. № 199н «Об утверждении Правил надлежащей лабораторной практики», «Европейская конвенция о защите позвоночных животных, используемых для экспериментов или в иных научных целях» от 18 марта 1986 г. [11] и Федеральный закон Российской Федерации «О защите животных от жестокого обращения» от 01.01.1997 г.). До и во время проведения экспериментов животные содержались в идентичных условиях.
На глазах кроликов был смоделирован этап ирригации-аспирации кортикальных масс хрусталика, выполненный с помощью разработанной ультразвуковой системы на отечественной офтальмологической хирургической платформе «Оптимед Профи» (ЗАО «Оптимедсервис», Россия).
Ход эксперимента.
После предоперационной подготовки в глазную щель кролика был установлен блефаростат, дополнительно в конъюнктивальный мешок закапаны обезболивающие капли и выполнены два парацентеза шириной 1,2 мм.
Перед введением в переднюю камеру инструментов активировали ирригацию путем перевода педали факоэмульсификатора в первое положение, затем последовательно через один парацентез вводили ирригационный, через другой – аспирационный наконечники (активация аспирации осуществлялась переводом педали во второе положение).
Во время проведения экспериментов инструменты располагали таким образом, чтобы они не касались и не травмировали интраокулярные структуры (эндотелий роговицы, радужку, хрусталик).
Настройки микрохирургической системы во время проведения экспериментальной ирригации-аспирации кортикальных масс были следующие: производительность аспирации – 35 мл/мин., высота ирригационной емкости – 75 см, предел вакуума – 400 мм рт. ст., мощность ультразвука 30%, режим ультразвука – постоянный, время активации ультразвука – 10 секунд (активация ультразвука проводилась путем перевода педали факоэмульсификатора в боковое положение).
С целью широкой оценки безопасности и возможности использования новой технологии в ходе эксперимента мы использовали более высокие значения мощности ультразвука, чем требуется для аспирации кортикальных масс [10]. Во время эксперимента ирригационный и аспирационный наконечники местами не меняли. Длительность каждого эксперимента была одинаковая.
Для чистоты эксперимента и исключения случайных повреждений эндотелия роговицы хирургическими инструментами, фрагментами ядра и кортикальных масс хрусталика мы намеренно отказались от проведения самой факоэмульсификации.
После завершения эксперимента инструменты удаляли, осуществляли контроль герметизации парацентезов, под конъюнктиву вводили раствор антибиотика и стероидного противовоспалительного средства. В послеоперационном периоде всем кроликам в конъюнктивальный мешок закапывали антибактериальные и нестероидные противовоспалительные капли.
На каждый срок послеоперационного наблюдения (1, 7, 14, 30-й дни) из эксперимента выводили по 5 кроликов путем безболезненной воздушной эмболии с последующей энуклеацией глаз.
Подготовка препаратов для гистологического исследования проводилась по стандартной методике [12]. Энуклеированные глазные яблоки в течение 3-5 суток фиксировали в 10%-ном растворе формалина по Лилли. После на предметном столике роговицу с ободком склеры, радужкой, цилиарным телом выкраивали, обезвоживали в спиртах восходящей концентрации и заливали в парафин. Затем были выполнены серийные срезы роговицы на микротоме LEICA RM2125RTS (Leica, Германия). Срезы окрашивали гематоксилином и эозином, пикрофуксином по Ван Гизону.
Микроскопию и фотографирование полученных препаратов осуществляли на световом микроскопе LEICA 108MD со встроенной камерой (Leica, Германия) при увеличении ×40, ×100, ×200 и ×400.
Сбор и обработка полученных данных проводились в программе Microsoft Excel 2016. Для оценки переменных использовали методы описательной статистики: для количественных переменных – среднее значение и стандартное отклонение, для качественных – частота (%).
Результаты исследования и их обсуждение
На 1-й день после операции на всех гистологических препаратах (в 100% случаев) толщина роговицы кроликов была равномерной почти на всем протяжении.
В переднем эпителии дифференцировались все слои (базальный, шиповатый и поверхностный). В единичных эпителиальных клетках были выявлены признаки слабо выраженных дистрофических изменений в виде просветления цитоплазмы в околоядерных зонах (рис. 1). Боуменова мембрана не просматривалась (характерная особенность роговицы кроликов).
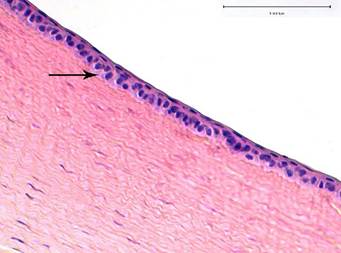
Рис. 1. Структура роговицы кролика на 1-й день после экспериментальной ультразвуковой аспирации кортикальных масс хрусталика. Слабо выраженные дистрофические изменения в переднем эпителии роговицы – просветление цитоплазмы в околоядерных зонах (черная стрелка). Окраска гематоксилином и эозином
Строма роговицы состояла из параллельно лежащих роговичных пластин, основу которых составляли пучки коллагеновых волокон. Между ними просматривались удлиненные веретенообразной формы кератоциты (рис. 1). Ближе к десцеметовой мембране отмечалось слабое набухание коллагеновых волокон. В отдельных участках стромы визуализировалось небольшое разволокнение коллагеновых волокон в результате мукоидного набухания основного вещества стромы (рис. 2, 3).
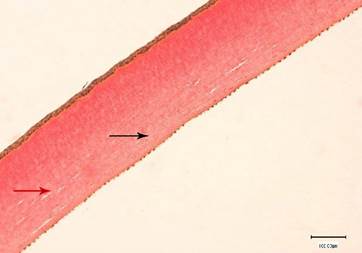
Рис. 2. Структура роговицы кролика на 1-й день после экспериментальной ультразвуковой аспирации кортикальных масс хрусталика. Слабое набухание коллагеновых волокон внутренней части стромы (черная стрелка). Разволокнение коллагеновых волокон стромы (красная стрелка). Окраска по Ван Гизону
Десцеметова мембрана визуализировалась в виде плотной однородной ленты, изменений в ее структуре обнаружено не было.
На большем протяжении десцеметовой мембраны был зафиксирован равномерный монослой эндотелиальных клеток. Также были зафиксированы участки с несколько набухшими эндотелиоцитами (их цитоплазма становилась прозрачной (рис. 3)).
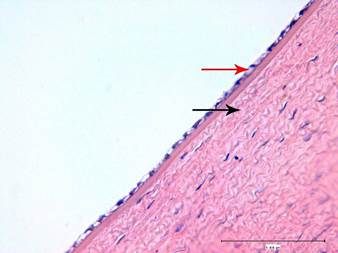
Рис. 3. Структура роговицы кролика на 1-й день после экспериментальной ультразвуковой аспирации кортикальных масс хрусталика. Набухание эндотелиальных клеток (красная стрелка). Слабое набухание коллагеновых волокон (черная стрелка). Окраска гематоксилином и эозином
На 7-й день после операции описанные изменения роговицы всех кроликов были выражены в меньшей степени. На всем протяжении роговица была равномерной. Дистрофических изменений в переднем эпителии роговицы не наблюдалось. Боуменова мембрана не просматривалась. В отдельных участках ближе к десцеметовой мембране сохранялись слабо выраженные признаки набухания коллагеновых волокон. На отдельных участках определялось слабое разволокнение коллагеновых волокон. В передней части роговицы изменений в фиброархитектонике коллагеновых волокон отмечено не было. Десцеметова мембрана представляла собой плотную однородную ленту, прилегающую к задней поверхности соединительнотканной стромальной пластинки. Эндотелиальные клетки выглядели интактными (рис. 4).
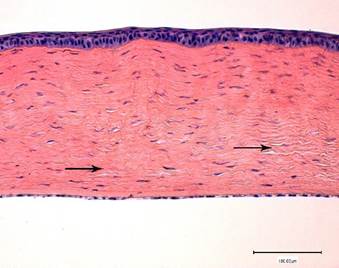
Рис. 4. Структура роговицы кролика на 7-й день после экспериментальной ультразвуковой аспирации кортикальных масс хрусталика. Слабое набухание и разволокнение коллагеновых волокон внутренней части роговой пластинки (черные стрелки).
Окраска гематоксилином и эозином
На 14-й и 30-й дни послеоперационного наблюдения на всех гистологических препаратах роговица кроликов выглядела интактной, соответствовала нормальной картине. Переднюю поверхность соединительнотканной пластинки покрывал ровный слой многослойного плоского неороговевающего эпителия, состоящего из базального, шиповатого и поверхностного слоев. Боуменова мембрана не визуализировалась. Строма роговицы состояла из ровных параллельно лежащих роговичных пластин, основу которых составляли пучки коллагеновых волокон. Между ними просматривались удлиненные веретенообразной формы кератоциты – фибробластические клетки стромы роговой оболочки глаза. Заднюю поверхность соединительнотканной пластинки покрывала ровная плотная десцеметова мембрана, на которой плотно лежал слой эндотелиальных клеток, без каких-либо изменений. (рис. 5 А, Б).
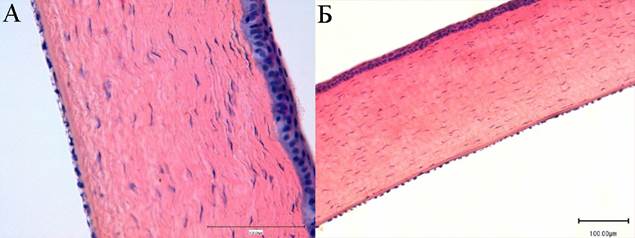
Рис. 5. Интактная структура роговицы кролика (соответствующая нормальной картине) на 14-й (А) и 30-й (Б) дни после экспериментальной ультразвуковой аспирации кортикальных масс хрусталика. Роговица равномерная, все слои визуализируются четко, признаки дистрофии отсутствуют. Окраска гематоксилином и эозином
Заключение
По результатам проведенных исследований с использованием разработанной ультразвуковой системы для аспирации кортикальных масс в гистологической структуре роговицы были обнаружены слабовыраженные дистрофические изменения, которые полностью регрессировали к 14-му дню послеоперационного периода, на основании чего можно сделать вывод об их обратимом характере.



