Ведение пациентов с коморбидной патологией является задачей не только врачей-терапевтов, врачей общей практики, но и инфекционистов, фтизиатров [1]. В контексте ведения пациентов с коморбидной патологией существует проблема рациональной фармакотерапии, обеспечивающей адекватное лечение каждого заболевания без неблагоприятных эффектов при сочетании нескольких препаратов [2]. При лечении туберкулеза легких (ТЛ) у пациентов с коморбидной патологией нельзя ограничиваться модификацией стандартных режимов химиотерапии [3]. Функциональное состояние кардиореспираторной системы оказывает значимое влияние на течение туберкулезного процесса, и рациональная коррекция коморбидных состояний за счет основных и плейотропных эффектов препаратов призвана повысить эффективность лечения ТЛ и ограничить токсические эффекты противотуберкулезных препаратов на организм в целом [4, 5]. При подборе индивидуализированной лекарственной терапии для излечения пациента от туберкулеза важны знание совокупного вклада нарушений вентиляционной способности легких, гипоксии, показателей кардиогемодинамики и их эффективная коррекция [3].
Целью настоящего исследования явилась оценка эффективности различных вариантов фармакотерапии сердечно-сосудистой коморбидной патологии (АГ, ИБС, ХСН) у пациентов с впервые выявленным туберкулезом легких на фоне ХОБЛ.
Материалы и методы исследования
Простое сравнительное когортное проспективное исследование проводилось на базе бюджетного учреждения здравоохранения Омской области «Клинический противотуберкулезный диспансер» (БУЗОО КПТД). Критерии включения: впервые выявленный ТЛ; наличие ХОБЛ, АГ, ИБС, ХСН; информированное согласие на участие в исследовании. Критерии исключения: внелегочный туберкулез; ВИЧ-инфекция; гепатит; нежелание пациента участвовать в исследовании. Исследование выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской Декларации [6, 7]. Протокол исследования одобрен Этическим комитетом ФГБОУ ВО «Омский государственный медицинский университет» Минздрава России.
В исследование включены 203 пациента с впервые выявленным ТЛ, получавших химиотерапию по I и III режиму [3]. Инфильтративный ТЛ был у 180 больных, очаговый – у 14, диссеминированный – у 6, фиброзно-кавернозный ТЛ – у 3. Согласно стандартам лечения ТЛ, пациенты без бактериовыделения получали терапию по III режиму химиотерапии (изониазид, рифампицин, пиразинамид, этамбутол), интенсивная фаза 60 доз, с последующим переводом на фазу продолжения. При наличии бактериовыделения и сохраненной лекарственной чувствительности к основным противотуберкулезным препаратам, подтвержденных молекулярно-генетическим исследованием мокроты, назначалась противотуберкулезная терапия по I режиму (изониазид, рифампицин, пиразинамид, этамбутол). Пациенты с легкой (n=19) и средней (n=154) степенью тяжести ХОБЛ согласно Global Initiative for chronic Obstructive Lung Disease (GOLD) получали монотерапию антихолинергическими препаратами длительного действия (ДДАХ). Пациенты с тяжелой степенью ХОБЛ (n=30) получали комбинированные бронходилатирующие препараты (ДДАХ+ДДБА) [4]. Лечение пациентов с сердечно-сосудистой патологией осуществлялось согласно клиническим рекомендациям по АГ, ИБС и ХСН [8–12]. Продолжительность наблюдения – 6 месяцев.
Пациенты были разделены на 3 группы: 1-я группа – 76 пациентов с ТЛ, ХОБЛ и АГ, из них 41 мужчина и 35 женщин (χ2=0,43, p=0,514), медиана возраста среди мужчин и женщин 1-й группы (Me (P25;75) 58,00 (56,50; 60,00) лет. Все пациенты 1-й группы имели АГ 2-й степени, II стадии [9]. Вторая группа – 68 пациентов с ТЛ, ХОБЛ и ИБС (стенокардия напряжения 2-го или 3-го функциональных классов), из них 48 мужчин и 20 женщин (χ2=10,86, p=0,001), медиана возраста 2-й группы 57,00 (51,00; 77,00) лет [10]. Третья группа – 59 пациентов с ТЛ, ХОБЛ и ХСН, из них 53 мужчины и 6 женщин, медиана возраста 3-й группы 61,0 год (58; 64,5). ХСН I функционального класса (ФК) имели 8 пациентов (13,6%), ФК II – 28 больных (47,5%), ФК III – 23 (38,9%) [11, 12]. Варианты терапии по подгруппам представлены в таблице 1. Более высокая доля мужчин по сравнению с женщинами связана с большей частотой встречаемости ТЛ и ХОБЛ среди мужчин.
Таблица 1
Варианты комбинированной терапии в группах наблюдения
|
Терапия Группа |
Варианты терапии |
||||||
|
1-я группа ТЛ + ХОБЛ + АГ |
1-я подгруппа ИАПФ + Д1 (n=19) |
2-я подгруппа АРА + Д2 (n=19) |
3-я подгруппа ИАПФ + ДАК3 (n=19) |
4-я подгруппа АРА + ДАК4 (n=19) |
|||
|
2-я группа ТЛ + ХОБЛ + ИБС |
5-я подгруппа БАБ + ДАК5 (n=18) |
6-я подгруппа БАБ + Т6 (n=24) |
7-я подгруппа НДАК + Т7 (n=26) |
||||
|
3-я группа ТЛ + ХОБЛ + ХСН |
8-я подгруппа ИРААС+БАБ+ АМР8 (n=29) |
9-я подгруппа ИРААС+БАБ+ АМР+Т 9 (n=30) |
|||||
Примечание:
1ИАПФ+Д – ингибитор ангиотензин-превращающего фермента (лизиноприл) + диуретик (гидрохлортиазид);
2АРА+Д – антагонист рецепторов ангиотензина II (лозартан) + диуретик (гидрохлортиазид);
3ИАПФ+ДАК – ингибитор ангиотензин-превращающего фермента (лизиноприл) + дигидропиридиновый антагонист кальция (амлодипин);
4АРА+ДАК – антагонист рецепторов ангиотензина II (лозартан) + дигидропиридиновый антагонист кальция (амлодипин);
5БАБ+ДАК – бета-адреноблокатор (бисопролол) + дигидропиридиновый антагонист кальция (амлодипин);
6БАБ+Т – бета-адреноблокатор (бисопролол) + триметазидин;
7НДАК+Т – недигидропиридиновый антагонист кальция (верапамил) + триметазидин;
8ИРААС+БАБ+АМР – ингибитор ренин-ангиотензин-альдостероновой системы (ИАФП, при непереносимости – АРА) + бета-адреноблокатор (титрация дозы от 1,25 мг/сут до 5 мг/сут в зависимости от переносимости) + антагонист минералокортикоидных рецепторов (спиронолактон);
9ИРААС+БАБ+АМР+Т – ингибитор ренин-ангиотензин-альдостероновой системы (ИАФП, при непереносимости – АРА) + бета-адреноблокатор (титрация дозы от 1,25 мг/сут до 5 мг/сут в зависимости от переносимости) + антагонист минералокортикоидных рецепторов (спиронолактон) + триметазидин
Пациентам 1-й группы проводилось суточное мониторирование артериального давления (СМАД) исходно и через 3 месяца от начала терапии в подгруппах (табл. 1). Для анализа были взяты показатели среднесуточного систолического артериального давления (САД24) и среднесуточного диастолического артериального давления (ДАД24) [13, 14]. Для оценки эффективности различных вариантов антиишемической терапии у пациентов 2-й группы учитывалось количество приступов загрудинных болей. В качестве клинических критериев, определяющих функциональный класс ХСН, использовались показатели Шкалы оценки клинического состояния больного ХСН (ШОКС) (в модификации В.Ю. Мареева) [12]. В качестве объективного критерия оценки эффективности терапии ХСН применены тест с 6-минутной ходьбой и показатель ЧСС по результатам ЭКГ. Эффективность лечения туберкулеза оценивалась по критериям негативации мазка, закрытия полостей распада и прекращения бактериовыделения [3].
Статистическая обработка данных была проведена с использованием пакетов программ Statistica 8.0: Выборка не подчинялась законам нормального распределения, в силу этого использовались непараметрические методы статистической обработки. Рассчитывались показатели описательной статистики: количественные данные представлены в виде медианы Ме (Р25; Р75), качественные данные представлены в виде абсолютных чисел, процентов (%). Межгрупповые различия (независимые выборки) определялись с помощью критерия χ2, критерия Вальда–Вольфовица (Z); если анализировались 3 и более групп, использовался ранговый дисперсионный анализ Краскела–Уоллиса (H). Межгрупповые различия (зависимые выборки) определялись с помощью критерия Вилкоксона парных сравнений (W). Уровень статистической значимости принимали р<0,05.
Результаты исследования и их обсуждение
На момент включения в исследование у пациентов 1-й группы разницы в уровне АД не было, медиана САД24 для всех подгрупп – 138 (131,5; 140,0), ДАД24 – 84,5 (82,0; 86,0). Различия показателей СМАД между подгруппами представлены на рисунке 1.
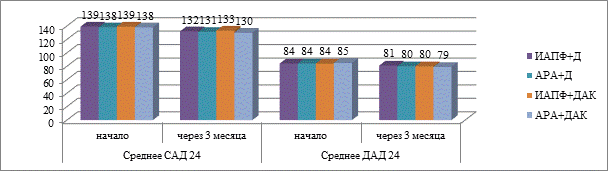
Рис. 1. Показатели САД24 и ДАД24 в начале исследования и через 3 месяца у пациентов ТЛ+ХОБЛ+АГ
На фоне лечения в 1-й подгруппе снижение САД24 после 3 месяцев терапии наблюдалось на 5 мм рт. ст. (W=2,78, p=0,005), ДАД24 – на 3 мм рт. ст. (W=3,53, p=0,000); динамика в 4-й подгруппе: САД24 – на 8 мм рт. ст. (W=3,72, p=0,000), ДАД24 – на 6 мм рт. ст. (W=3,72, p=0,000). При межгрупповом сравнении 1-й и 2-й подгрупп получены различия по показателям САД24 (Z=2,97; p=0,003), ДАД24 (Z=3,24; p=001) в пользу АРА+Д. В 3-й и 4-й подгруппах в комбинации с ДАК статистически значимые различия отмечаются в пользу 4-й подгруппы (АРА+ДАК) по САД24 (Z=2,18; p=0,03) и ДАД24 (Z=2,23; p=0,02)) [9]. Негативация мазка мокроты за 6 месяцев наблюдения достигнута у 100% пациентов 4-й подгруппы и 85,9% – 3-й подгруппы, у 89,5% пациентов во 2-й подгруппе и у 84,2% – в 1-й подгруппе (Z=2,14;p=0,033). Прекращение бактериовыделения имело место у 100% больных в 4-й подгруппе против 84,3% в 3-й подгруппе (Z=–3,45; p=0,000) и 94,5% во 2-й подгруппе (Z=–3,45; p=0,000). Закрытие полостей распада в 4-й подгруппе наблюдалось чаще – 78,9% против 73,7% в 3-й подгруппе, 68,4% во 2-й подгруппе, 63,2% в 1-й подгруппе (р>0,05).
Через 3 месяца наблюдения пациентов 2-й группы (ТЛ+ХОБЛ+ИБС) лучший эффект по критерию минимизации количества приступов загрудинных болей в неделю и урежению ЧСС наблюдался в 7-й подгруппе, несколько меньше – в 6-й подгруппе (рис. 2).

Рис. 2. Показатели средней ЧСС и количества приступов загрудинных болей в неделю у пациентов ТЛ+ХОБЛ+ИБС, абс
При межгрупповом сравнении трех подгрупп через 3 месяца по снижению ЧСС для 6-й подгруппы выявлены преимущества против 7-й подгруппы (H=4,439; р<0,05), для группы БАБ+Т против НДАК+Т (H=5,498; р<0,05). У части пациентов при прогрессировании бронхообструктивного синдрома на фоне БАБ альтернативным препаратом оказывались НДАК, способные поддерживать рекомендуемую для пациента ЧСС. При оценке клинической эффективности пациенты всех групп отмечали урежение эпизодов загрудинных болей менее 1 раза в неделю, но преимущества по количеству пациентов, достигших целевых значений (1 раз в неделю и менее), были в 7-й подгруппе (НДАК+Т). Подтверждение преимущества комбинированной антиишемической терапии с добавлением миокардиального цитопротектора триметазидина к верапамилу (НДАК) получено при межгрупповом сравнении результатов ХолтерЭКГ по минимизации эпизодов диагностически значимой депрессии сегмента ST у пациентов 7-й подгруппы в сравнении с 6-й подгруппой (Z=–1,965; p=0,05). По эффективности терапии ТЛ негативация мазка в 7-й подгруппе (НДАК+Т) наблюдалась у 88,2% пациентов, а в подгруппе БАБ+ДАК – у 76,5% (Z=–2,26; p=0,024).
Эффективность фармакотерапии пациентов 3-й группы (ТЛ+ХОБЛ+ХСН) представлена на рисунках 3 и 4.
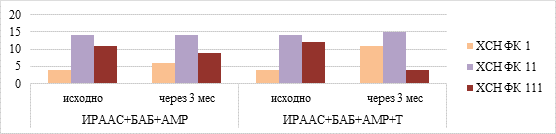
Рис. 3. Показатели ХСН ФК (по ШОКС) у пациентов с ТЛ+ХОБЛ+ХСН в начале терапии и через 3 месяца, абс
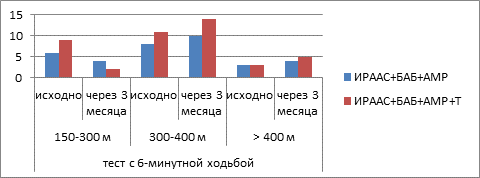
Рис. 4. Переносимость физических нагрузок на фоне терапии у пациентов с ТЛ+ХОБЛ+ХСН
У части больных на фоне противотуберкулезной терапии отмечалось появление или усугубление симптомов ХСН, что требовало медикаментозной коррекции ХСН в 8-й подгруппе (ИРААС+БАБ+АМР) согласно клиническим рекомендациям [11, 12]. Пациентам 9-й подгруппы (с синдромом ХСН) в дополнение к вышеописанной комбинированной терапии был назначен миокардиальный цитопротектор (триметазидин). Через 3 месяца лечения наблюдались увеличение количества пациентов с ХСН ФК I (рис. 3), уменьшение количества пациентов с ХСН ФК III (рис. 3), увеличение количества больных, способных пройти более 400 м за 6 минут, и уменьшение тех, которые проходили менее 300 метров, особенно в 9-й подгруппе (рис. 4). Негативация мазка через 6 месяцев наблюдения отмечена у 90,0% больных в 9-й подгруппе и у 82,8% – в 8-й подгруппе (Z=–2,10; p=0,036), закрытие полостей распада – у 66,7% и 58,6% пациентов (Z=–0,002; p=0,998), прекращение бактериовыделения – у 76,7% и 72,4% соответственно (Z=–1,05; p=0,294).
Выводы
1. Преимущественной по антигипертензивному эффекту у пациентов 1-й группы (ТЛ+ХОБЛ+АГ) оказалась комбинация АРА и ДАК, побочных эффектов, которые бы требовали отмены препаратов, не наблюдалось. ДАК оказывают дилатирующее действие не только на артерии, но и в меньшей степени – на бронхи [5], защищают кальциевый насос, работа которого страдает на фоне приема некоторых противотуберкулезных препаратов, что определяет преимущества использования этой группы препаратов у коморбидных пациентов [3, 5, 9, 14]. На фоне лечения ТЛ в подгруппе АРА+ДАК негативация мазка наблюдалась на 10,5% чаще, чем в группе ИАПФ+ДАК (Z=2,14; p=0,033).
2. Во 2-й группе пациентов (ТЛ+ХОБЛ+ИБС) лучшие результаты по антиишемическому и ритмурежающему эффекту получены в 6-й и 7-й подгруппах пациентов, принимавших комбинацию БАБ или НДАК (верапамил) в сочетании с миокардиальным цитопротектором (триметазидином). У пациентов с бронхообструктивным синдромом применение НДАК сопровождалось хорошей переносимостью при достаточном ритмурежающем эффекте [3, 10, 15]. У пациентов, получавших НДАК+Т, на 11,7% чаще происходила негативация мазка в сравнении с пациентами, получавшими БАБ+ДАК (Z=–2,26; p=0,024).
3. У пациентов 3-й группы (ТЛ+ХОБЛ+ХСН) преимущества по оценке клинического состояния (использована ШОКС) и переносимости физических нагрузок (тест с 6-минутной ходьбой) получены в подгруппе ИРААС+БАБ+АМР+Т, при этом негативация мазка наблюдалась на 7,2% чаще, чем в подгруппе ИРААС+БАБ+АМР (Z=–2,10; p=0,036). С учетом клинических рекомендаций [11, 12] триметазидин может быть использован в составе комбинированной терапии у пациентов с ТЛ и ХСН, в том числе и для защиты кардиомиоцитов от потенциального повреждения различного генеза (ишемического, токсического и т.д.). Этот препарат в условиях гипоксии способен модифицировать энергетический обмен в клетках с окисления свободных жирных кислот на окисление глюкозы как более энергетически выгодный.
Заключение
Применение индивидуализированной фармакотерапевтической тактики для коррекции АГ, ИБС и ХСН у пациентов с впервые выявленным ТЛ на фоне ХОБЛ в период их лечения в стационаре позволило не только улучшить соматическое состояние пациентов за счет нормализации АД, минимизации эпизодов загрудинных болей, уменьшения одышки, урежения частоты сердечных сокращений, улучшения переносимости физических нагрузок, но и увеличить частоту негативации мазка, прекращения бактериовыделения и закрытия полостей распада за 6 месяцев наблюдения без усиления противотуберкулезной терапии.



