Диагностика давности механических повреждений является важным вопросом в практике судебно-медицинского эксперта. В настоящее время предложено достаточное количество различных методик, позволяющих в той или иной степени дать ответ на поставленный вопрос [1], однако, несмотря на неоспоримые преимущества каждой из них, они имеют свои недостатки, что делает актуальными дальнейшую разработку и поиск новых методов.
Иммунная система и гистофизиологические процессы, происходящие в ней, являются автономными, однако немалое влияние на них оказывают нервная и эндокринная системы, а также другие факторы внешней и внутренней среды. Иммунная система, в свою очередь, оказывает влияние на функции нервной и эндокринных систем согласно принципу обратных отрицательных связей. Именно поэтому иммунная система может рассматриваться как общерегуляторная. Специфическими функциями иммунной системы являются: обнаружение, связывание и удаление антигенов, как экзогенных, так и эндогенных. Выполнение этих функций обеспечивают гистофизиологические процессы. Высокая динамичность является важной особенностью гистофизиологии иммунной системы. В ней непрерывно протекают процессы пролиферации, дифференцировки, миграции, кооперации, апоптоза лимфоцитов [2].
В ответ на механическую травму организм отвечает стрессовой реакцией, приводящей к активации адаптивной перестройки органов и тканей. Ключевым механизмом этого процесса является воспалительная реакция. В тимусе происходят дифференцировка и «обучение» Т-лимфоцитов, что играет важную роль в поддержании иммунитета живых организмов [2]. Морфологические сдвиги в структуре тимуса определяют развитие дефектов в иммунной системе. При воздействии острых стрессовых ситуаций в организме происходит акцидентальная инволюция тимуса, что может привести к развитию иммунодефицитных состояний [3].
Избыточная продукция глюкокортикоидов может приводить к инволюции тимуса, что связано с быстрой реакцией коры надпочечников на стресс. Именно поэтому травму нельзя рассматривать только как локальное поражение, она всегда сопровождается общими процессами с вовлечением иммунной и эндокринной систем [3]. Тимусная инволюция – осложнение многих клинических проявлений, включая развитие инфекции, нарушение аппетита, развитие иммунодепрессивных состояний. Системные повышения уровней глюкокортикоидов и воспалительных цитокинов, как известно, способствуют тимусной атрофии. Немного известно, однако, о внутритимусных механизмах, которые, с одной стороны, способствуют истощению тимуса, с другой – тимусному восстановлению после воздействия стресса [4].
Старение повышает нарушения продукции цитокинов после травмы. Продукция ИФНγ и IL – 2 была значительно ниже у старых животных в ранний период после травмы, что может увеличивать частоту сепсиса и смерти у пожилых. Мужской пол и возраст, видимо, являются причинными неблагоприятными факторами в развитии иммуносупрессии после травмы [5].
Было установлено, что фазовые изменения показателей иммунного ответа, сопровождающие развитие раневой инфекции у пострадавших с тяжелой механической травмой, отличаются от изменений иммунной системы при инфекционных, хирургических заболеваниях более длительным восстановлением показателей клеточного иммунитета и выраженной дисиммуноглобулинемией – повышением иммуноглобулина М и снижением иммуноглобулина G. Зависимость иммуногенеза от состояния обменных процессов позволяет отнести изменения иммунитета к проявлениям общей катаболической реакции организма на травму, которые наиболее выражены на 3–5-е сутки после травмы, в эти же сроки выражена иммуносупрессия. Вторая фаза изменений иммунной системы в процессе посттравматической регенерации тканей начинается со 2-й недели и продолжается до 3 недель – фаза Т-клеточной гиперплазии. Эта фаза характеризуется генерализованным накоплением Т-клеток в тимусе, регионарном лимфатическом узле и селезенке, что является результатом постстрессовой перестройки иммунной системы [6].
Лимфоцит является круглой клеткой, ядро занимает его большую часть, оно окружено ободком протоплазмы. По происхождению и функции различают Т-лимфоциты (образуются из клеток-предшественников, расселяющихся из костного мозга в тимус, и обеспечивают реакции клеточного иммунитета) и В-лимфоциты (образуются в красном костном мозге), которые отвечают за обеспечение гуморального иммунитета. По размеру лимфоциты разделяются на малые, средние и большие. Наивысшей пролиферативной активностью обладают большие лимфоциты, которые являются начальной стадией дифференцировки стволовых клеток после попадания в субкапсулярную зону дольки тимуса. Новые клетки перемещаются в корковое вещество тимуса, а затем трансформируются в средние и малые лимфоциты, они слабо пролиферируются, однако продолжают дифференцироваться. Средние лимфоциты – это промежуточное звено в дифференцировке и пролиферации лимфоидных клеток до зрелых форм, то есть до малых лимфоцитов [4].
Лимфоциты внутренней кортикальной зоны составляют 60–80% всех лимфоцитов. Такие лимфоциты несут хоминг-рецепторы, с помощью которых осуществляется миграция в Т-зависимые зоны периферических лимфоидных органов.
Корковая зона дольки подразделяется на субкапсулярную и внутреннюю кортикальную зоны. Функция субкапсулярной зоны заключается в создании микроокружения для костномозговых предшественников с целью дальнейшей пролиферации. Внутренняя кортикальная зона представляет собой сеть эпителиальных клеток. Участки без эпителиальной сети называются резервуарами для Т-лимфоцитов. Популяции лимфоцитов внутрикортикальной зоны гетерогенны, они составляют 60–80% от всех лимфоцитов тимуса. Функция внутрикортикальной зоны состоит в дальнейшей дифференцировке ранее поступивших тимоцитов.
Мозговое вещество долек представлено сетью крупных эпителиальных клеток и меньшим числом Т-лимфоцитов, а также мезенхимальными клетками. В медуллярной зоне находятся тельца Гассаля. Т-лимфоциты медуллярной зоны составляют 15–20% всех лимфоцитов тимуса и являются функционально активными. Т-лимфоциты являются либо рециркулирующими (при поступлении из крови), либо отдельной субпопуляцией лимфоцитов. Мозговая зона отвечает за обеспечение антигензависимого созревания Т-лимфоцитов за счет использования тимических гормонов, а также при прямом контакте с интердигитальными клетками и воздействии интерлейкинов. Кроме того, гормоны коры тимуса обладают местным действием, а гормоны мозгового вещества выделяются в кровь [4].
Нами был проведен количественный анализ динамики показателей лимфоцитов в зависимости от фазы процесса воспаления на фоне нанесения механической травмы крысам.
Цель исследования – изучить динамику изменений клеточного состава коркового и мозгового вещества долек тимуса крыс в процессе регенерации кожно-мышечного повреждения при механической травме бедра.
Материал и методы исследования
Мы использовали 84 половозрелые крысы массой тела 250–300 г. Экспериментальное исследование, содержание и последующая эвтаназия животных осуществлялись согласно «Правилам проведения работ с экспериментальными животными» (Приложение к приказу МЗ СССР от 12.09.1977 г. № 755). Протокол заседания этического комитета экспериментального исследования № 3.14.2 от 06.02.2019 г.
Животные были разделены на 2 группы: 1 – контрольная (n=12), 2 – экспериментальная (n=72). Механическое повреждение на задней лапе справа в области бедра наносили при помощи специальной установки, которая дозированно предавала тканям кинетическую энергию, сопоставимую с силой удара винтовки калибра 5,6 мм [7]. Далее животные были разделены на 4 подгруппы в зависимости от времени, прошедшего с момента нанесения механического повреждения: 1 – 1 сутки; 2 – 3 суток; 3 – 15 суток; 4 – 25 суток. Выбор таких сроков исследования обусловлен фазами посттравматической регенерации тканей [8]. Животные выводились из эксперимента путем декапитации с последующим извлечением тимуса для гистологического исследования. Морфологические исследования включали приготовление, микроскопирование и морфометрию гистологических препаратов тимуса. Биоматериал фиксировали в 10%-ном растворе формалина с последующим обезвоживанием в спиртах, просветляли в ксилоле и заливали в парафин по общепринятой методике с дальнейшим формированием срезов толщиной 7 мкм. Готовые срезы окрашивали гематоксилин-эозином. Микроскопирование осуществляли под бинокулярным микроскопом (Германия) при увеличении х7 или х10, объективы х40 или х90. Для проведения морфометрии была использована микросетка. При исследовании тимуса определяли соотношение содержания больших, средних и малых лимфоцитов в корковом и мозговом веществе долек. Общее количество исследованных микропрепаратов – 168. Для статистической оценки полученных результатов был использован пакет программ SPSS for Windows.
Результаты исследования и их обсуждение
В контрольной группе в корковом веществе долек тимуса содержание больших лимфоцитов составило 8,1±0,7%, средних – 40,6±2,4% и малых – 51,3±1,7%. Изменения соотношения разновидностей лимфоцитов в тимусе на этапах раневого процесса приведены на рисунке 1.
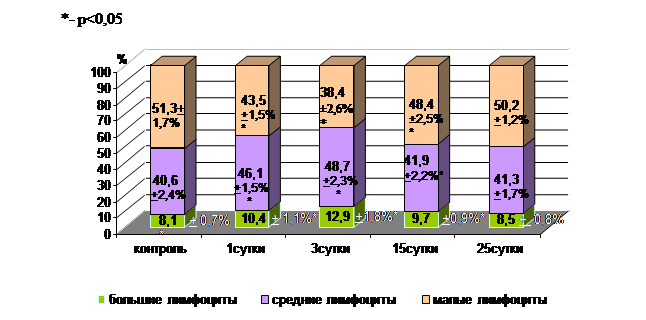
Рис. 1. Динамика уровня лимфоцитов коркового слоя долек тимуса у крыс в процессе заживления механической раны конечности
Анализ результатов изменения соотношения разных видов лимфоцитов у крыс в корковом веществе долек тимуса к концу 1-х суток опыта, в фазе альтерации, показал, что количество больших и средних лимфоцитов имело тенденцию к увеличению на 2,3% и 5,4% соответственно в сравнении с контролем. Содержание малых лимфоцитов у животных в этой фазе было ниже на 7,8%(p<0,05) в сравнении с контрольной группой.
На 3-и сутки исследования количество больших и средних лимфоцитов у крыс основной группы было выше, чем в контрольной группе (12,9±1,8% и 48,7±2,3% против 8,1±0,7% и 40,6±2,4%; р1 и р2 <0,05). При этом содержание малых лимфоцитов снижалось в сравнении с контролем (38,4±2,6% и 51,3±1,7%, р<0,05).
На 15-е сутки в фазе регенерации у крыс экспериментальной группы в корковом веществе долек тимуса содержание средних лимфоцитов снизилось на 6,8% (p<0,05) в сравнении с фазой острого воспаления, а количество малых лимфоцитов увеличивалось с 38,4±2,7% до 48,4±2,5% (р<0,05), но не достигло уровня контроля. Содержание больших лимфоцитов имело тенденцию к снижению относительно предыдущих сроков эксперимента.
На 25-е сутки, в фазе адаптивной перестройки, динамика количества лимфоцитов показала, что число больших, средних и малых лимфоцитов коркового слоя долек тимуса у крыс экспериментальной группы опыта приблизилось к уровню контрольной группы.
Динамика уровня содержания отдельных видов лимфоцитов в корковом слое тимуса на фоне заживления механической травмы показала, что наибольшее увеличение больших лимфоцитов наблюдалось на 3-и сутки. Фазовые изменения клеточного состава тимуса характеризовались постепенным повышением количества больших лимфоцитов и снижением их уровня до контрольных значений в восстановительном периоде после травмы. В фазе регенерации (15-е сутки) наблюдаются увеличение числа средних и снижение количества больших лимфоцитов. В фазе адаптивной перестройки (25-е сутки) отмечается восстановление количества больших, средних и малых лимфоцитов. Полное восстановление измененных показателей лимфоцитов отмечалось только к 25-м суткам исследования.
Нами был также проведен анализ результатов исследования показателей разновидностей лимфоцитов мозгового вещества тимуса, результаты которого представлены в таблице.
Динамика уровня лимфоцитов мозгового слоя тимуса у крыс в процессе заживления механической травмы конечности (%)
|
Фазы |
Лимфоциты |
||
|
Большие |
Средние |
Малые |
|
|
Контроль |
2,5±0,8 |
60,5±3,1 |
37±3,4 |
|
1-е сутки |
4,2±0,7* |
57,1±2,4* |
38,7±2,5 |
|
3-и сутки |
5,9±0,9* |
54,4±2,3* |
39,7±2,5 |
|
15-е сутки |
4,0±0,7* |
55,9±2,3* |
38,1±2,6 |
|
25-е сутки |
3,0±0,8 |
59,0±3,0 |
38,0±2,7 |
* – p<0,05
Как видно из данных, представленных в таблице, у крыс контрольной группы в мозговом слое тимуса преобладали лимфоциты средних размеров (60,5±3,1%), количество больших лимфоцитов было в 3 раза меньше, чем в корковом слое, и составило 2,5±0,8%; малых – почти в 2 раза ниже уровня средних лимфоцитов.
После нанесения экспериментальной механической травмы животным опытной группы в 1-е и 3-и сутки (завершающая фаза альтерации и острого воспаления) изменения лимфоцитов в мозговом слое тимуса характеризовались тенденцией к снижению содержания средних лимфоцитов на 3,4% и на 6,1% соответственно в сравнении с группой контроля. Содержание больших и малых лимфоцитов имело тенденцию к увеличению в 1-е и 3-е сутки – на 1,7% и 3,4%, и на 1,7% и 2,7% соответственно в сравнении с контролем.
На 15-е сутки количество средних лимфоцитов имело тенденцию к увеличению и составило 55,9±2,3% по сравнению с фазой острого воспаления, а содержание больших и малых лимфоцитов – к снижению на 32,2% и 4,1% соответственно.
К 25-м суткам опыта показатели содержания всех разновидностей лимфоцитов в мозговом слое тимуса практически не отличались от контрольного уровня.
Заключение
Таким образом, результаты анализа количественного исследования динамики лимфоцитов в процессе заживления механической раны бедра у крыс в фазе альтерации и острого воспаления выявили увеличение числа больших лимфоцитов и снижение количества средних и малых лимфоцитов, а начиная с фазы регенерации – уменьшение количества больших лимфоцитов и увеличение количества средних и малых лимфоцитов, что свидетельствует о начальной стадии восстановительного процесса и снижении реактивного напряжения со стороны лимфопоэза. В корковом слое отмечается опустошение клеточного состава в основном за счет малых лимфоцитов, а в мозговом слое – средних лимфоцитов; процесс нормализации соотношения разных видов лимфоцитов начинается в фазе пролиферации, а полное восстановление достигается в фазе адаптивной перестройки тканей. Полученные результаты могут быть использованы в экспертной практике с целью определения давности механических повреждений.



