Первичная медиастинальная В-крупноклеточная лимфома (ПМВКЛ) представляет собой агрессивную неходжкинскую лимфому с отсутствием четкого молекулярно-генетического портрета. Для данного варианта характерна генетическая гетерогенность: ей присущи признаки лимфомы Ходжкина, диффузной В-крупноклеточной лимфомы, лимфомы серой зоны. В качестве первой линии лечения уже длительное время используются различные CHOP-подобные режимы (R-CHOP, DAR-EPOCH, R-CHOEP) с лучевой терапией на остаточную опухолью. Однако, несмотря на успехи в лечении пациентов с ПМВКЛ, остается треть пациентов, рефрактерных к проводимой терапии. Роль дистанционной лучевой терапии (ДЛТ) также противоречива [1]. С целью изучения возможных вариантов преодоления этой рефрактерности необходимы дальнейшие исследования. В литературе имеются отдельные данные о характерных для ПМВКЛ молекулярных изменениях, однако все эти работы часто сведены к изучению данного варианта в сравнении с другими лимфомами. Секвенирование нового поколения (NGS) позволило бы расширить сведения о мутационном профиле ПМВКЛ, найти новые мишени для разработки таргетных препаратов.
Цель исследования. Выявить новые молекулярные мишени для лечения первичной медиастинальной В-крупноклеточной лимфомы.
Материалы и методы исследования. В исследование включены данные о 47 пациентах с верифицированным диагнозом ПМВКЛ, получивших лечение в ФГБУ «НМИЦ онкологии» МЗ РФ с 2011 по 2021 гг. Пациенты были поделены на две группы в зависимости от схемы индукционной терапии. Первая группа больных получала ХТ по схеме R-CHOP (n=23), вторая – DAR-EPOCH (n=24). Пациентам с остаточной опухолью проводилась дистанционная лучевая терапия (ДЛТ). Были оценены результаты общей выживаемости пациентов в зависимости от проводимой терапии по Каплан–Майеру. Статистически значимыми являлись различия при уровне значимости p<0,05.
В связи с наличием больных, рефрактерных к лечению, были отобраны 23 человека, 11 из которых имели неблагоприятное течение заболевания и 12 – ответивших на лечение. Средний возраст больных, включенных в исследование, составил 39,25±11,63 года. Были проведены молекулярно-генетические исследования, материалом для которых послужили парафиновые блоки опухолей пациентов.
Выделение геномной ДНК из парафиновых блоков выполняли с применением Gene Read DNA FFPE Kit, Qiagen, США согласно официальному протоколу. Концентрацию ДНК измеряли флуориметрически на Qubit 2.0 (Life Technologies, USA). Для NGS использовалась панель AVENIO Tumor Expanded Panel, Roche, США, включающая в себе 77 генов. Исследование выполнено на системе NextSeq 550. Патогенность нуклеотидных замен оценивали с учетом рекомендаций ACMG (American College of Medical Genetics and Genomics) и AMP (Association of Molecular Pathology). В среднем количество ДНК составило 77,55 нг. Обработку данных производили при помощи программного обеспечения AVENIO Oncology Analysis Software для поиска клинически значимых мутаций, а также с учетом рекомендаций Li M., Datto M. Standards and Guidelines for the Interpretation and Reporting of Sequence Variants in Cancer.
Найденные варианты валидировали методом прямого секвенирования по Сэнгеру, которое проводили с использованием набора BigDye Terminator v3.1 Cycle Sequencing Kit (Applied Biosystems, США) на анализаторе ABI PRISM 3500 (Applied Biosystems, США) в соответствии с рекомендациями производителя.
Результаты исследования и их обсуждение. В литературе имеется ряд публикаций, в которых описаны преимущества тех или иных схем химиотерапии: с одной стороны, учитывая агрессивность данной лимфомы, использование в качестве индукции более токсичных режимов оправдано, с другой – в ряде статей говорится о развитии неприемлемых нежелательных явлений и часто некупируемых осложнений [2, 3]. Также встречаются работы по изучению влияния ритуксимаба на эффективность терапии [4]. Так, добавление ритуксимаба к другим режимам лечения, например DA-EPOCH, статистически значимо улучшало общую и безрецидивную выживаемость при ПМВКЛ [5], тогда как в другом исследовании не было доказано преимуществ схемы R-CHOP над CHOP режимом [6]. При этом в ряде работ говорится о высоком уровне первичной рефрактерности при лечении в режиме R-CHOP [7].
При анализе результатов проводимого лечения были получены следующие данные. Общего ответа удалось добиться у 34 пациентов, неблагоприятное течение, включающее рефрактерное и рецидивирующее, наблюдалось у 13 человек (26%). В нашем исследовании применение схемы R-CHOP в сочетании с лучевой терапией статистически значимо улучшало общую выживаемость больных относительно использования этой схемы без лучевой терапии (77,1±14,4% против 38,9±18,5%). Использование схемы DAR-EPOCН с консолидирующей лучевой терапией не выявило значимых отличий в общей выживаемости пациентов (88,9±10,5% против 88,9±10,5%). Использование схемы DAR-EPOCН по сравнению с R-CHOP позволило получить лучшие показатели общей выживаемости (88,9±10,5% против 38,9±18,5%), различия статистически значимы, логранговый критерий р<0,05.
Необходимость облучения остаточной опухоли при ПМВКЛ до сих пор остается обсуждаемым вопросом. В одних статьях говорится о синергическом эффекте лучевой терапии после проведения химиотерапии, в других описываются вероятные осложнения лучевой терапии на область средостения, а также определяется риск возникновения вторичных опухолей после терапии [8, 9]. В нашей работе применение ДЛТ независимо от схемы индукционной терапии (R-CHOP или DAR-EPOCH) не продемонстрировало значимых различий в общей выживаемости пациентов с ПМВКЛ (77,1±14,4% против 88,9±10,5%).
Таким образом, имеющиеся литературные данные и результаты нашего исследования не дают четкого ответа на вопрос выбора наилучшего варианта индукционного лечения для пациентов с ПМВКЛ. Требуются дальнейшее изучение и поиск новых таргетных мишеней для преодоления рефрактерности проводимой терапии.
В ряде публикаций уже описаны наиболее значимые сигнальные пути, а также характерные мутации, имеющие значение для ПМВКЛ, однако они неспецифичны. Молекулярно-генетические исследования позволили выявить аномалии, характерные для ПМВКЛ. Так, мутации в гене STAT6 обнаруживаются в трети случаев ПМВКЛ [10]. В литературе описаны мутации в гене TNFAIP3, KIT, TP53, SOCS1, которые встречаются при ПМВКЛ, но они также характерны и для других вариантов лимфом [11–13].
Все пациенты, которым было проведено секвенирование, получали ДЛТ. Так, выявлен ряд полиморфизмов, ранее не охарактеризованных для ПМВКЛ (рис. 1). Среди них идентифицированы 20 однонуклеотидных полиморфизмов в 10 генах: 15 миссенс-мутаций, 3 синонимичных и 2 нонсенс-мутации.

Рис. 1. Спектр генов, в которых обнаружены SNP
Обнаруженные варианты подтверждены методом прямого секвенирования по Сэнгеру у 24 пациентов, часть из которых имели неблагоприятное течение заболевания, а часть – ответили на лечение. Валидированы полиморфизмы в генах: MET, FGFR3, PIK3CA, ALK, EZH2, RNF43.
Так, в образце ДНК опухоли пациента, рефрактерного к проводимой терапии, в гене RNF43 было обнаружено два однонуклеотидных полиморфизма – c.1233C>T (р.Pro411Pro), и c.1189C>T (p.Arg397Trp) – rs531889929, локализованных в 9-м экзоне. Согласно различным базам данных (My Cancer Genome, COSMIC, dbSNP и др.), мутации в данном гене встречаются при многих типах солидных опухолей. Мутация rs531889929 – чрезвычайно редкое событие в популяции согласно различным базам данных (GnomAD, dbSNP). В базе COSMIC – COSM3787382 (c.1189C>T) зарегистрирован для рака поджелудочной железы и описан как «нейтральный». В базе VarSome полиморфизм rs531889929 характеризуется как «вероятно доброкачественный» и описан для рака молочной железы, а также рака кожи. В ClinVar данная мутация не описана. В GWAS – не описана. В ClinGen – нет данных. В литературе имеются данные о том, что наличие мутаций в гене RNF43 обусловливает чувствительность к терапии ингибиторами Wnt [14].
У другого больного с непрерывно-прогрессирующим течением ПМВКЛ были обнаружены два однонуклеотидных полиморфизма гена FGFR3 – c.1108G>T (p.Glu370Cys), c.1114G>T (p.Gly372Cys), локализованных в 9-м экзоне, – rs121913479. Частота rs121913479 – А=0.000004 (1/249268) согласно базе GnomAD_exome. Распространенность rs121913479 в европейской популяции – G=1.00000, A=0.00000, T=0.00000, что также является чрезвычайно редким явлением в популяции. Согласно COSMIC, полиморфизмы встречаются при опухолях кожи, раке мочевыделительной системы, шейки матки. В базе COSMIC ClinVar зарегистрирована как «патогенная». Согласно VarSome, мутация как мутация с неопределенным клиническим значением.
Обнаружены два однонуклеотидных полиморфизма гена MET (у пациента с непрерывно-прогрессирующим течением) – c.3029C>T (р.Thr1010lle) и c.2975C>T (p.Thr992lle) – rs56391007, которые локализованы в 14-м экзоне. Согласно базе GnomAD_exome, распространенность rs56391007 в популяции – 0,007891 (1962/248630), в базе ALFA – 0,011107 (2467/222108); в европейской популяции – C=0,987968 T=0,012032. Данная мутация ранее не была описана для ПМВКЛ. Согласно базе dbSNP, полиморфизм rs56391007 встречается у пациентов с острым лимфобластным лейкозом, а также при меланоме и колоректальном раке. В базе ClinVar rs56391007 зарегистрирована как мутация с противоречивой интерпретацией патогенности. Согласно базе VarSome, был зарегистрирован как мутация с неопределенной значимостью.
Обнаруженные полиморфизмы в гене EZH2 (у больного, ответившего на лечение) – c.1936T>A (p.Tyr646Asn) – rs267601395, c.1804T>A (p.Tyr602Asn), локализованы в 16-м и 15-м экзонах. Согласно COSMIC, мутация COSM139744, COSM37031 – (c.1936T>A) зарегистрирована как мутация, характерная для опухолей гемопоэтической и лимфоидной тканей. В этой же базе данных и VarSome она охарактеризована как патогенная (0,99). В ClinVar c.1936T>A зарегистрирован как «вероятно патогенный».
В образце ДНК опухоли пациента с непрерывно-прогрессирующим течением был обнаружен однонуклеотидный полиморфизм гена PIK3CA – c.1624G>A (p.Glu542Lys), локализованный в 10-м экзоне, – rs121913273. Распространенность rs121913273 согласно базе ALFA: A=0.000 (0/478). В базе dbSNP, VarSome значится как «патогенная». В ClinVar описана как «патогенная»/«вероятно патогенная». В ClinGen – идентификатор СА16602697. Имеются данные о том, что мутация встречается при диффузных В-крупноклеточных лимфомах и хроническом лимфолейкозе, характерна для некоторых солидных опухолей (например, рака молочной железы, колоректального рака, нейроэндокринного рака) [15].
В другом образце опухоли обнаружены два однонуклеотидных полиморфизма гена ALK (больной с непрерывно-прогрессирующим течением) – c.3542G>A (p.Arg1181His) – rs1034835558 и c.422G>A (p.Arg141His), которые локализованы в 23-м и 5-м экзоне соответственно. Согласно GnomAD_exome rs1034835558 – редкое событие в популяции: 0,000004 (1/251324). При скрининге меньшей выборки, результаты которого были приведены в базе ALFA, полиморфизм c.422G>A (p.Arg141His) не регистрировали (0/10680). Согласно COSMIC, c.3542G>A (COSM6226578) ранее описана как патогенная для рака толстой кишки, поджелудочной железы, шейки матки. В TCGA – мутация была охарактеризована для рака шейки матки. В базе данных ClinVar, VarSome c.3542G>A характеризуется как мутация с неопределенным клиническим значением и описана для нейробластомы. Также известна как мутация, являющаяся потенциальной мишенью в лечении немелкоклеточного рака легкого [16]. В базе данных СlinGen полиморфизмы не зарегистрированы.
Обнаруженные полиморфизмы ранее не описывались для первичной медиастинальной В-крупноклеточной лимфомы и могут быть потенциальными мишенями для дальнейших исследований их прогностической значимости и разработки таргетных препаратов.
Для ПМВКЛ наиболее часто описывают активацию нескольких сигнальных путей: JAK-STAT, а также NF-kB. Однако, несмотря на важнейшую роль этих сигнальных путей в патогенезе данного заболевания, в качестве мишеней таргетной терапии они рассматриваются лишь в нескольких клинических исследованиях [17].
В нашем исследовании среди выявленных полиморфизмов были выделены мутированные гены с патогенным / вероятно патогенным и неизвестным клиническим значением. В ходе биоинформационного анализа получены данные, что эти мутированные гены одновременно задействованы в регуляции нескольких сигнальных путей: PI3K-AKT, JAK-STAT, RAP1, RAS, MAPK, Signaling pathways regulating pluripotency of stem cells), однако они не специфичны для ПМВКЛ. Согласно литературным данным, активация сигнального пути PI3K/Akt/mTOR связана с прогрессированием рака яичников, канцерогенезом опухолей головы и шеи, немелкоклеточного рака легкого, а также с развитием резистентности к лечению цисплатином [18]. А сигнальный путь Ras/MEK/ERK описан в качестве потенциальной терапевтической мишени для терапии злокачественных опухолей гемопоэтической системы, в частности острого лимфобластного лейкоза [19].
Однако наиболее значимым сигнальным путем оказался FGF/FGFR, активирующий через фактор роста FGF все указанные. Согласно литературным данным, при активации сигнального пути FGF/FGFR возможно развитие рефрактерности к химиотерапии. Повышенная регуляция FGFR3 обнаружена в радиорезистентных клеточных линиях плоскоклеточного рака, а при множественной миеломе способна обусловливать резистентность к дексаметазону [19–21]. В нашем исследовании общая выживаемость пациентов, получивших лучевую терапию с аберрантными изменениями FGFR3, составила 52,4±14,3%; (±SE); против 77,8±13,9%; (±SE) (у пациентов без аберрантных изменений). Таким образом, общая выживаемость пациентов с изменениями в FGFR3 меньше, чем у пациентов без таких изменений (рис. 2).
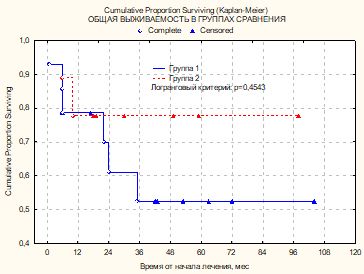
Рис. 2. Общая выживаемость у пациентов с ПМВКЛ, получавших лучевую терапию, в зависимости от активности FGF/FGFR. Группа № 1 – пациенты с аберрантными изменениями FGFR3 (n=13); группа № 2 – пациенты без аберрантных изменений FGFR3 (n=9)
Заключение. Несмотря на успехи в лечении ПМВКЛ, в настоящее время у ряда пациентов наблюдается рефрактерное течение заболевания. В исследовании получены противоречивые данные относительно режимов индукционной химиотерапии, результатов применения дистанционной лучевой терапии в качестве консолидации ремиссии. С целью поиска возможных мишеней преодоления имеющейся рефрактерности были проведены молекулярно-генетическое исследование NGS, с дальнейшей валидацией полученных мутаций методом прямого секвенирования по Сэнгеру. Охарактеризованы клинически значимые мутации в генах, ранее не описанные для данной нозологии. На основании выявленных генов-кандидатов в ходе биоинформационного анализа выделены сигнальные пути (JAK-STAT, MAPK, RAP1, RAS, PIK-Akt, Signaling pathways regulating pluripotency of stem cells), задействованные в патогенезе ПМВКЛ. Обнаружено, что аберрантные изменения сигнального пути FGF/FGFR, который способен определять резистентность к лучевой терапии, были ассоциированы с меньшей общей выживаемостью наших пациентов, что в дополнение к обнаруженным мутациям открывает новые возможности для последующих исследований в области преодоления рефрактерности проводимого лечения.



