Позвоночно-спинномозговая травма почти в 100% случаев сопровождается серьезными осложнениями и инвалидностью. Ежегодно во всем мире происходит около 750000 новых травм позвоночника [1]. В 60-80% случаев она является прерогативой лиц от 16 до 45 лет [2], и почти в 90% - мужчин [2; 3]. В отдаленный период после травмы позвоночника и спинного мозга формируется стойкий комплекс грубых функциональных и неврологических нарушений [4]. Одним из методов реабилитации данной категории пациентов является эпидуральная электростимуляция (ЭЭС). За последние несколько лет в области нейромодуляции спинного мозга были получены многообещающие результаты, которые потенциально могут обеспечить восстановление функций посредством эпидуральной электростимуляции (ЭЭС) [5]. Однако ЭЭС восстанавливает локомоцию на экспериментальных моделях повреждения спинного мозга, а у людей она менее эффективна [6]. Периодическая стимуляция не допускает блокировки проприоцептивной информации и обеспечивает надежный контроль над активностью двигательных нейронов. Это свидетельствует о важности определения протоколов стимулирования, учитывающих сохранение проприоцептивной информации [6; 7]. Несмотря на потенциальные возможности ЭЭС в восстановлении функций, в настоящее время использование ЭЭС ограничивается недостаточными исследованиями на людях с травматической болезнью спинного мозга и требует дальнейшей проверки эффективности [5]. Изолированная эпидуральная электростимуляция носит временный эффект. Для формирования устойчивых супраспинальных связей необходимо сочетание ЭЭС с тренировкой проприоцептивной рецепции.
Целью данного исследования являлся анализ динамики функционального состояния пациента с последствиями позвоночно-спинномозговой травмы после курса эпидуральной электростимуляции, сочетающейся с активацией проприорецепторного аппарата.
Материалы и методы исследования
В настоящей работе представлен клинический случай пациента в отдаленном периоде позвоночно-спинномозговой травмы: мужчина 35 лет с последствиями перелома L1 позвонка, травматической болезнью спинного мозга (поздний период), нижним грубым парапарезом и нарушением функции тазовых органов. Для оценки состояния пациента использовали шкалу SCIM III (Spinal Cord Independence Measure). Анализ нейромышечного аппарата осуществлялся посредством регистрации амплитуды моторных ответов (М-ответов) мышц нижних конечностей (цифровой электромиографической системы Viking EDX, Natus Medical Incorporated, США). Исследование силовых характеристик мышц бедра осуществляли с использованием динамометрического стенда [8]. Двигательную функцию и общее качество походки оценивали с помощью 10-метрового Walk-теста. Пациент ходил со вспомогательными средствами опоры (ходунки) с предпочтительной скоростью ходьбы по 10-метровой дорожке без какого-либо перерыва до конечной точки. Определялось время на промежуточных 6 метрах. Рассчитывалась скорость ходьбы (м/сек.).
С помощью электрического эстезиометра (термистор EPCOS Inc., Германия), производили исследование температурно-болевой чувствительности в дерматомах L1-S1.
Имплантацию временного эпидурального электрода осуществляли мини-инвазивно на уровне поясничного утолщения спинного мозга. Накожный электрод располагали в проекции заинтересованной мышечной группы. Электростимуляцию проводили посредством нейромышечного стимулятора «РехаБраво» (MTR+ Vertriebs GmbH, Германия), в режиме Continuous (непрерывный), с длительностью импульсов 450μС и частотой следования 5 Гц. Силу тока подбирали индивидуально до появления парестезий и/или безболезненных сокращений группы заинтересованных мышц, продолжительность процедуры составляла 10 мин. Электростимуляцию осуществляли 2 раза в день на протяжении 10 дней. Процедуры эпидуральной стимуляции сопровождались активацией проприорецепторного аппарата (ходьба с опорой на ходунки с произвольной, предпочтительной скоростью). Кроме того, в течение данного лечебно-реабилитационного периода проводилась лечебная физкультура (2 раза в день по 30 минут), которая включала изометрическую, корректирующую, координационную гимнастику и лечебный массаж нижних конечностей.
Проведенное исследование было одобрено комитетом по этике ФГБУ «НМИЦ ТО им. академика Г.А. Илизарова» Минздрава России и проводилось в соответствии с этическими стандартами, изложенными в Хельсинкской декларации с последующими изменениями. Пациент подписал информированное добровольное согласие на публикацию данных, полученных в результате исследований, без идентификации личности.
Описание случая из практики
Пациент К., 35 лет, поступил в клинику Центра (26.11.2019) с жалобами на ограничение активных движений нижних конечностей, снижение чувствительности в нижних конечностях, нарушение функции тазовых органов. В неврологическом статусе был выявлен нижний грубый парапарез, гипестезия кожи с уровня L1 дерматома. Мочеиспускание осуществлялось путем самокатетеризации, чувство наполнения мочевого пузыря отсутствовало. Стул был нерегулярным, со слабительным. Пациент, как правило, самостоятельно не передвигался (кресло-каталка), вертикализировался с опорой на ходунки и фиксацией нижних конечностей ортезами (тип В по ASIA).
В анамнезе пациента присутствовала автодорожная травма (в 2016 году), после которой наблюдалась потеря активных движений и чувствительности в нижних конечностях. Была выполнена декомпрессивно-стабилизирующая операция на поясничном отделе позвоночника, после которой было отмечено появление силы в мышцах бедра.
При поступлении в клинику Центра показатель независимости пациента насчитывал 60 баллов. Величина 10-метрового Walk-теста достигала 35 сек. (ходьба с опорой на ходунки) и была на 75% выше нормы (20 секунд) (рис. 1). Скорость ходьбы составляла 0,17 м/сек.
|
|
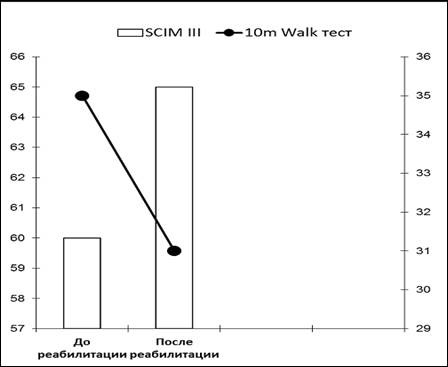
Рис. 1. Пациент К., 35 лет. Динамика показателя независимости при повреждениях спинного мозга (SCIMIII) и показателя 10-метрового Walk-теста до и после курса эпидуральной стимуляции, сочетающейся с активацией проприорецепторного аппарата (ходьба с опорой на ходунки)
Максимальные моменты силы мышц бедра были значительно снижены относительно нормы: разгибателей голени справа и слева – на 73,6% и 98,5% (норма - 186,2±5,6 Н*м); сгибателей голени справа и слева на 98,4% (норма - 152,4±6,8 Н*м) (рис. 2).
Исследование температурно-болевой чувствительности показало, что в области дерматомов L1 слева, L2 справа она была в пределах нормы (табл. 1). В дерматоме L1 справа – тепловая чувствительность отсутствовала, порог болевой соответствовал норме. В дерматоме L2 слева, L3 справа - тепловая чувствительность отсутствовала. Порог боли в дерматомах L2 слева, L3 справа повышен на 2, 8 градусов соответственно. В дерматомах L3 слева, L4 справа и слева, L5 справа и слева, S1 справа и слева температурно-болевая чувствительность не определялась.
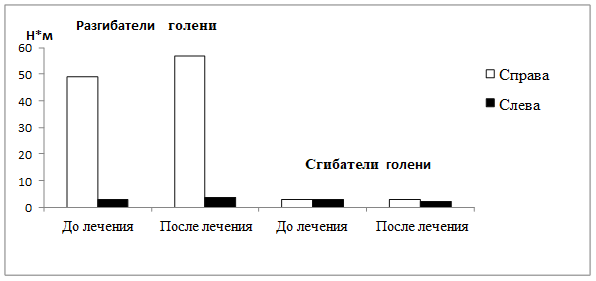
Рис. 2. Пациент К., 35 лет. Максимальные моменты силы (Н*м) разгибателей и сгибателей голени до и после реабилитационных мероприятий
Таблица 1
Показатели температурно-болевой чувствительности (град.) в дерматомах корешков конского хвоста пациента К., 35 лет, до реабилитационных мероприятий
|
Дерматома
|
Показатель температурно-болевой чувствительности (град.) |
||||||||
|
Контрольная группа |
Справа |
Слева |
|||||||
|
Т° кожи |
Порог тепла |
Порог боли |
Т° кожи |
Порог тепла |
Порог боли |
Т° кожи |
Порог тепла |
Порог боли |
|
|
L1 |
31,1± 0,2 |
33,3± 0,4 |
42,4± 0,5 |
31,2 |
нет |
40 |
31,4 |
34 |
40 |
|
L2 |
31,6± 0,2 |
33,1± 0,3 |
42,3± 0,2 |
31 |
31 |
40 |
31,2 |
нет |
44 |
|
L3 |
31,7± 0,1 |
33,6± 0,4 |
41,5± 0,5 |
31,0 |
нет |
50 |
31,0 |
нет |
нет |
|
L4 |
30,1± 0,3 |
32,3± 0,5 |
41,6± 0,2 |
30,6 |
нет |
нет |
30,8 |
нет |
нет |
|
L5 |
30,1± 0,2 |
32,2± 0,2 |
41,7± 0,1 |
31 |
нет |
нет |
31 |
нет |
нет |
|
S1 |
30,8± 0,4 |
32,5± 0,6 |
41,0± 0,8 |
29,2 |
нет |
нет |
29,2 |
нет |
нет |
Амплитуда М-ответа мышц нижних конечностей была снижена (на 26-98%) при исследовании всех обследуемых мышц нижних конечностей (табл. 2).
После комплексного обследования пациента была произведена пункционная имплантация временного эпидурального электрода на уровне поясничного утолщения спинного мозга. Курс эпидуральной электростимуляции сочетался с активацией проприорецепторного аппарата (ходьба с опорой на ходунки с произвольной, предпочтительной скоростью).
Таблица 2
Амплитуда М-ответа мышц нижних конечностей пациента К., 35 лет, до и после реабилитационных мероприятий
|
Мышца (основной корешок) |
Амплитуда М-ответа (мВ) |
|||||||||
|
До реабилитационных мероприятий |
После реабилитационных мероприятий |
|||||||||
|
справа |
слева |
справа |
слева |
|||||||
|
мВ |
% от нормы |
мВ |
% от нормы |
мВ |
% от нормы |
Прирост (%) |
мВ |
% от нормы |
Прирост (%) |
|
|
m. rectus fem. (L4) |
13,0 |
62 |
5,7 |
27 |
15,0 |
71% |
16 |
6,6 |
31 |
15 |
|
m.tibialisant. (L5) |
5,3 |
67 |
5,8 |
74 |
7,3 |
93% |
26 |
5,8 |
74 |
10 |
|
m.ext.dig.br. (L5) |
0,4 |
3,8 |
0,2 |
2 |
0,5 |
5% |
25 |
0,7 |
6,6 |
250 |
|
m.gastr. (c.lat.) (S1) |
7,5 |
24 |
11,5 |
37 |
6,7 |
21,3% |
-11 |
14 |
44 |
20 |
|
m.flex.dig.br. (S1) |
8,7 |
48 |
6,6 |
36 |
9,4 |
52 |
8 |
8,6 |
48 |
30 |
При обследовании через 9 месяцев после курса реабилитационных мероприятий пациент отмечал увеличение силы мышц бедер, появление мышечно-суставного чувства и поверхностной чувствительности в области стоп, голеней, голеностопных суставов, гиперестезию кожи тыльной поверхности стоп, возникновение чувства наполнения мочевого пузыря. Пациент передвигается только в ходунках, инвалидным креслом не пользуется, самостоятельно водит машину. Уровень независимости пациента увеличился на 8,5% и составил 65 баллов. Показатель 10-метрового Walk-теста уменьшился на 11,4% и достиг 31 сек. (рис. 1). Скорость ходьбы составляла 0,2 м/сек., что было больше на 17,7% относительно исходного уровня. Максимальные моменты разгибателей голени справа и слева увеличились на 16,3% и 28,6% соответственно. Сила мышц сгибателей голени значительно не изменялась (рис. 2).
В этот период наблюдения также отмечалось улучшение температурно-болевой чувствительности (табл. 3), которое выражалось в восстановлении тепловой чувствительности в дерматомах L1 справа, L2 слева, L3 справа и слева и болевой чувствительности - L3 слева.
Также определялось снижение порогов болевой чувствительности на 1 градус (L2 слева, L3 справа). Кроме того, определялась гиперестезия болевой чувствительности в дерматоме L1 справа и слева.
Таблица 3
Показатели температурно-болевой чувствительности (град.) в дерматомах корешков конского хвоста пациента К., 35 лет, после реабилитационных мероприятий
|
Дерматома
|
Показатель температурно-болевой чувствительности (град.) |
||||||||
|
Контрольная группа |
Справа |
Слева |
|||||||
|
Т° кожи |
порог тепла |
порог боли |
Т° кожи |
порог тепла |
порог боли |
Т° кожи |
порог тепла |
порог боли |
|
|
L1 |
31,1± 0,2 |
33,3± 0,4 |
42,4± 0,5 |
33,0 |
31(в) |
39 |
33,4 |
33 |
39 |
|
L2 |
31,6± 0,2 |
33,1± 0,3 |
42,3± 0,2 |
33,6 |
30 |
40 |
33,6 |
35 (в) |
43 |
|
L3 |
31,7± 0,1 |
33,6± 0,4 |
41,5± 0,5 |
33,6 |
39 (в) |
49 |
33,9 |
47 (в) |
50 (в) |
|
L4 |
30,1± 0,3 |
32,3± 0,5 |
41,6± 0,2 |
33,6 |
нет |
нет |
33,6 |
нет |
нет |
|
L5 |
30,1± 0,2 |
32,2± 0,2 |
41,7± 0,1 |
33,6 |
нет |
нет |
33,6 |
нет |
нет |
|
S1 |
30,8± 0,4 |
32,5± 0,6 |
41,0± 0,8 |
30,5 |
нет |
нет |
30,3 |
нет |
нет |
Примечание: (в) - восстановление чувствительности.
Показатели амплитуды М-ответов мышц на правой и левой нижних конечностях увеличивались на 10-250% (табл. 2). Исключение составляет m. gastrocnemius справа, где амплитуда М-ответа уменьшилась на 11%. При осмотре пациента через 1,5 года достигнутый результат лечения сохранялся.
Результаты исследования и их обсуждение
Несмотря на большое количество фундаментальных и клинических исследований, посвященных проблемам восстановления спинного мозга после травматического повреждения, значительное улучшение функциональных результатов в популяции больных с последствиями позвоночно-спинномозговой травмы по-прежнему отсутствует [9].
Одним из методов реабилитации данной категории пациентов является эпидуральная электростимуляция (ЭЭС). В последние годы появились публикации, в которых были описаны случаи восстановления произвольного движения ног, стояния и осуществления шаговых движений при эпидуральной стимуляции спинного мозга, сочетающейся с двигательной тренировкой у пациентов с нижней параплегией [10].
M.L. Jones et al., на выборке, состоящей из 48 пациентов с неполным повреждением спинного мозга (тип С и D по ASIA) в отдаленном периоде травматической болезни, показал эффективность терапии двигательных тренировок в сочетании с функциональной электростимуляцией [11].
В нашей работе проанализирована динамика функционального состояния пациента с последствиями позвоночно-спинномозговой травмы (тип В по ASIA) после однократного курса эпидуральной электростимуляции, сочетающейся с активацией проприорецепторного аппарата. Была определена позитивная динамика, которая выражалась в увеличении показателя независимости, скорости ходьбы, силы разгибателей голени, в уменьшении величины 10-метрового Walk-теста. Также наблюдались: положительная динамика температурно-болевой чувствительности, увеличение М-ответов почти всех исследуемых мышц нижних конечностей. Появилось чувство наполнения мочевого пузыря.
В настоящее время в литературе ряд авторов утверждает, что под воздействием ЭЭС оптимизируется функциональное состояние сегментарных интернейронных ансамблей и мотонейронных пулов, что восстанавливает их эффективное взаимодействие с системой супраспинальных связей, высшими отделами ЦНС [12], обеспечивает оптимизацию состояния проприорецептивной иннервации [6].
Aфферентные сигналы от нижних конечностей при стоянии и ходьбе с весовой нагрузкой в сочетании с ЭЭС синергически (усиливая совместный эффект) модулируют спинальные двигательные схемы, что может позволить произвольно контролировать мышечную активность [13]. ЭЭС стимулируют сначала средние и толстые афферентные волокна заднего корешка [14], которые могут транссинаптически активировать моторные схемы, позволяя движению адаптироваться к поступающим сенсорным сигналам при положении стоя или ходьбе с опорой на вес тела. Сенсорная информация, связанная с нагрузкой на конечности и положением тела, играет решающую роль в эффективности ЭЭС у больных с позвоночно-спинномозговой травмой [15].
Кроме того, в литературе сообщалось об улучшении деятельности сердечно-сосудистой системы, дыхательной функции, положения тела и функции мочевыведения у больных с травматической болезнью спинного мозга после ЭЭС [5]. В нашей работе наблюдалось улучшение функции мочевыделительной системы.
Заключение
Таким образом, у пациента с отдаленными последствиями позвоночно-спинномозговой травмы после курса эпидуральной электростимуляции, сочетающейся с активацией проприорецепторного аппарата, в ближайший и отдаленный периоды наблюдения регистрировались положительная динамика в двигательной и чувствительной сферах, увеличение уровня независимости пациента, улучшение функции мочевыделительной системы.



