При разных видах хронической функциональной недостаточности у некоторых пациентов проведение трансплантации внутренних органов оказывается жизненно необходимым [1]. В большинстве случаев выполнение трансплантационных вмешательств позволяет продлить больным жизнь и/или улучшить ее качество. Вместе с тем на фоне стабильного состояния пациентов после трансплантации иногда, по жизненным показаниям, возникает необходимость проведения операции по причине других патологических состояний, развивающихся симультанно. Это, в частности, происходит при онкозаболеваниях [2].
Рак предстательной железы занимает ведущие позиции в структуре показателей заболеваемости мужчин опухолевым процессом [3, 4]. В связи с этим данные об особенностях оказания медицинской помощи пациентам со злокачественными новообразованиями простаты, в том числе и раком предстательной железы, представляют интерес, а в отношении пациентов, ранее подвергшихся трансплантации органов, эти сведения оказываются особо значимыми.
Общепризнанно, что больным раком предстательной железы с локализованными формами онкологического процесса показано выполнение радикальной простатэктомии. В то же время осуществление такого хирургического вмешательства открытым доступом у пациентов, перенесших трансплантацию органов на фоне постоянной иммуносупрессивной терапии, сопряжено с высоким риском осложнений как в раннем, так и в отдаленном послеоперационном периоде. Изучение результатов применения мини-инвазивных методик (в том числе и с использованием робототехники) в плане поиска путей снижения этих рисков не кажется излишним [5, 6]. Данные о проведении робот-ассистированной радикальной простатэктомии после трансплантации органов в источниках литературы встречаются лишь единично [7, 8]. Пример одного из таких сообщений – публикация о том, что в феврале 2021 г. пациенту ФГБУ «НМИЦ им. В.А. Алмазова», перенесшему 5 лет назад пересадку сердца, успешно осуществлена робот-ассистированная радикальная простатэктомия [9]. Операция выполнена впервые не только в России, но и в странах СНГ и Восточной Европы. Схожий клинический случай при оказании медицинской помощи больному раком предстательной железы наблюдался в ГБУЗ «НИИ – Краевая клиническая больница № 1 им. проф. С.В. Очаповского» г. Краснодара в 2017 г., когда роботизированную радикальную простатэктомию выполнили мужчине, перенесшему трансплантацию почки (в 2010 г.).
Чтобы показать возможности применения хирургических методик при лечении больных раком предстательной железы, ранее прошедших процедуры трансплантации органов, в плане достижения максимальных результатов радикальности при мини-инвазивных подходах, приводим данные об этом клиническом событии.
Материалы и методы исследования. Проанализированы данные о 2 клинических наблюдениях выполнения радикальной простатэктомии с использованием робототехники у больных, ранее перенесших трансплантацию органов, проходивших обследование и лечение в ГБУЗ «НИИ – Краевая клиническая больница № 1 им. проф. С.В. Очаповского» Краснодарского края и ФГМУ «НМИЦ им. В.А. Алмазова». Анализ данных о пациентах осуществлялся путем обработки медицинских карт стационарного и амбулаторного больного, клинической работы с пациентами, ассистенции при выполнении хирургических вмешательств.
Результаты исследования и их обсуждение. У пациента Т., 60 лет, в 2008 г. выявлен хронический гломерулонефрит в терминальной стадии почечной дисфункции. Это обусловило необходимость проведения программного гемодиализа в течение почти 2 лет (с 2009 г. больной пребывал в ожидании операции по трансплантации почки). В 2010 г. в ГБУЗ «НИИ – Краевая клиническая больница № 1 им. проф. С.В. Очаповского» пациенту в левую подвздошную область успешно трансплантирована правая почка трупа. Течение раннего и послеоперационного периодов было гладким, без особенностей. Функция трансплантата оказалась срочной, появился адекватный водной нагрузке диурез, снизились показатели азотистых шлаков в крови до нормальных значений. Необходимость в проведении хронического гемодиализа отпала. Однако была назначена иммуносупрессивная терапия комбинацией циклоспорина и метилпреднизолона в регулярном приеме. После операции больной постоянно находился под наблюдением специалистов-нефрологов Краевого уронефрологического центра Краснодара с корректировкой доз иммуносупрессивных препаратов. В 2017 г. во время очередного обследования выявлен повышенный (до 4,5 нг/мл) уровень в крови простатспецифического антигена (ПСА). Пациент осмотрен урологом. При оценке status objectivus communis особенностей не отмечено, а при пальцевом исследовании per rectum ее слизистая оболочка интактна, смещаема, а предстательная железа – безболезненна, шаровидной формы, размерами 3 х 4 см с очагами уплотнения до 1 см в обеих долях. Урологом принято решение о выполнении трансректальной полифокальной биопсии простаты под ТРУЗ-наведением из 14 точек.
Результат патоморфологического исследования трансректальной полифокальной биопсии предстательной железы: ацинарная аденокарцинома G4 в обеих долях органа, сумма Глисона 9 (4+5), периневральный рост, без инвазии в капсулу железы и без признаков поражения семенного комплекса.
10.04.2017 г. пациент госпитализирован в отделение онкоурологии НИИ – Краевой клинической больницы № 1. При стандартном обследовании и оценке его данных противопоказаний к выполнению радикальной простатэктомии не выявлено (при общем анализе крови и мочи отклонений от нормы нет, в биохимическом исследовании крови уровни креатинина и мочевины составили 105 мкмоль/л и 6,4 ммоль/л соответственно (т.е. в допустимых пределах, тем более для пациента с трансплантированной почкой).
По данным трансректального УЗИ объем предстательной железы составил 56 см3 при объеме остаточной мочи до 20 мл. Согласно сведениям, полученным посредством компьютерной томографии головы, органов грудной клетки, брюшной полости и таза (с контрастным усилением), имеются изменения в виде сморщивания обеих почек и дислокации органов живота в связи с ранее проведенной трансплантацией почки слева. Подтверждена структурная перестройка простаты. Метастатические изменения не выявлены, в том числе и в костях скелета (при остеосцинтиграфии). Состояние почечного трансплантата по данным УЗИ: кровоток удовлетворительных качеств, умеренное (до 7 мм) расширение верхних групп чашечек. Объем суточного диурез пациента в среднем составлял 2 л.
Состояние пациента оценено нефрологом, гастроэнтерологом и кардиологом. Формулировка клинического диагноза:
Основные заболевания: 1) рак предстательной железы cT2cN0M0 Gleason 9(4+5); 2) хронический гломерулонефрит, гипертонический вариант.
Осложнения основных заболеваний: хроническая болезнь почек С5 (т); программный гемодиализ (с 23.06.2008 г.); аллотрансплантация трупной почки (24.03.2010 г.); постоянная иммуносупрессивная терапия.
Сопутствующие заболевания: симптоматическая артериальная гипертония III ст. Риск IV. Гиперхолестеринемия. Редкая желудочковая экстрасистолия. Хроническая сердечная недостаточность (ХСН) I ст., функциональный класс (ФК) I (NYHA). Неэрозивная гастроэзофагальная рефлюксная болезнь (ГЭРБ). Хронический гастрит. Желчнокаменная болезнь (ЖКБ); холецистэктомия (2013 г.).
Консилиумом врачей-экспертов (хирург-онколог, химиотерапевт, лучевой терапевт, онкоуролог и нефролог) рекомендовано выполнение радикальной простатэктомии с тазовой лифодиссекцией.
Укомплектованность штата медицинской организации (МО) опытными специалистами (онкоурологами, хирургами, анестезиологами, нефрологами, терапевтами) и оснащенность стационара высокотехнологичным оборудованием (в том числе роботизированной системой DaVinci), позволяли с высокой долей гарантии надеяться на успешность проведения хирургического вмешательства с минимальными рисками послеоперационных осложнений у данного пациента.
Операция выполнена с использованием робототехники 12.04.2017 г. в объеме «радикальная простатвезикулэктомия с расширенной тазовой лимфаденэктомией справа». Первый оптический троакар после наложения карбоксиперитонеума был введен в брюшную полость в стандартной локализации (на 2 см выше пупка по срединной линии). Во время эндовидеоревизии органов брюшной полости установлено, что почти всю левую подвздошную область занимает почечный трасплантат. Данное обстоятельство обусловило необходимость смещения входов для троакаров краниально и медиальнее (в отличие от стандартного расположения инструментов в обычных ситуациях). Выявлен существенный спаечно-рубцовый процесс при мобилизации передней поверхности мочевого пузыря, что не помешало проведению простатэктомии в стандартном варианте при фокусировании всех инструментов в малом тазу. Из-за опасения нарушения трофики траснсплантата от проведения лимфодиссекции подвздошных сосудов слева решено воздержаться, ограничившись выполнением лимфаденэктомии справа (рис. 1).
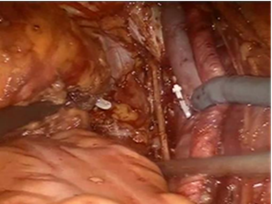
Рис. 1. Выполнение тазовой лимфаденэктомии справа
Удаление самой предстательной железы осуществлялось с вскрытием внутритазовой фасции с обеих сторон, широким иссечением «ножек» простаты и фасции Денонвилье. После простатвезикулэктомии выполнены задняя реконструкция тазового дна методом шва Рокка (рис. 2), формирование уретро-пузырного анастомоза и передняя тазовая реконструкция. С этой целью использовали шовный материал V-locTM (Covidien) 3/0 длиной 23 см.
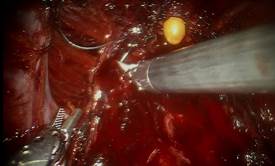
Рис. 2. Задняя реконструкция тазового дна
Время операции составило 185 минут, объем кровопотери не превысил 100 мл. Послеоперационный период в целом протекал без осложнений. С целью профилактики инфекционно-воспалительных осложнений в раннем послеоперационном периоде осуществлялась антибактериальная терапия (цефоперазон + сульбактам 2 г 3 раза в сутки). Для предупреждения тромбоэмболических осложнений в течение 14 дней пациенту вводился фраксепорин 40 мг 1 раз в сутки. Периодически проводился контроль концентрации иммуносупрессивных препаратов без коррекции их дозировки.
Больной активизирован в первые сутки после операции. Питался самостоятельно. Страховой дренаж удален из брюшной полости через 24 часа после хирургического вмешательства. Зоны введения в полость брюшины инструментов зажили первичным натяжением в течение нескольких дней. После выполнения цистографии на 150 мл раствора контрастного вещества (анастомоз признан герметичным) уретральный катетер удален через 12 суток после операции, что является чуть более поздним сроком, чем при стандартных случаях выполнения радикальной простатэктомии. Функция удержания мочи у пациента полностью восстановлена через месяц после хирургического вмешательства. Тем не менее ежедневно в течение года больной выполнял упражнения для укрепления мышц тазового дна. Эректильная функция согласно опроснику «Международной индекс эректильной функции – 5» составила 7 баллов (оказалась утраченной).
Данные патоморфологического исследования удаленного препарата: низкодифференцированная ацинарная аденокарцинома (G5), сумма Глисона 9 баллов (4+5) предстательной железы с поражением обеих долей при врастании в ткань семенных пузырьков с периневральным и экстрапростатическим ростом и со множественными опухолевыми эмболами в сосудах. В краях резекции уретры, шейки мочевого пузыря, во всех исследованных лимфатических узлах, во фрагментах стенки толстой кишки опухолевый рост не обнаружен.
Наблюдение за пациентом в течение четырех лет позволяет считать результат лечения больного положительным (почечный трансплантат функционирует без сбоев, осложнений ни в раннем, ни в отдаленном послеоперационном периоде не отмечено, удержание мочи восстановлено). По контрольным данным уровня ПСА в крови в течение 2 лет признаков активизации онкологического процесса нет. Однако в сентябре 2019 г. уровень ПСА составил 0,44 нг/мл, а в ноябре этого же года – 0,96 нг/мл. Учитывая данное обстоятельство, больному назначена гормональная терапия по программе максимальной андрогенной блокады. При выполнении контрольных тестов крови уровня общего ПСА этот показатель не превышал 0,1 нг/мл при постоянном приеме агонистов лютеинизирующего гормона – рилизинг-гормона (ЛгРг) и антиандрогенов.
Одной из негативных сторон трансплантации органов является необходимость обязательного ежедневного применения в послеоперационном периоде иммуносупрессивных препаратов с целью подавления реакций организма в виде отторжения пересаженных органов и тканей. Назначение иммуносупрессоров сопряжено с увеличением риска активизации онкогенных процессов. Даже при опухолях низкой степени злокачественности (для которых в обычных условиях не характерны агрессивное течение, быстрый рост и распространение) на фоне приема иммуносупрессивных медикаментозных средств течение онкологического процесса может оказаться малопредсказуемым. Поэтому пациенты, подвергшиеся трансплантации внутренних органов (почек, сердца, печени, легких и др.), относятся к особой группе риска в плане прогноза, течения и исхода онкологических заболеваний, что обусловливает необходимость целенаправленного индивидуального подхода к их обследованию и лечению.
Тактика, изложенная в представленном наблюдении, оказалась успешно реализованной благодаря мультидисциплинарному подходу на фоне отмечаемых в последние годы возможностей повышения уровня оснащенности медицинских организаций и роста квалификации специалистов. В России впервые данный тренд идеологически сформулирован сотрудниками ФГМУ «НМИЦ им. В.А. Алмазова» [9]. В этом учреждении для проведения радикальной простатвезикулэктомии пациенту с ранее пересаженным сердцем при оказании медицинской помощи целенаправленно была сформирована группа специалистов, осуществившая тщательную подготовку больного к операции, скрупулезное, методически безукоризненное выполнение непосредственно самого вмешательства и индивидуализированное ведение пациента в послеоперационном периоде. Работу специалистов могли осложнять высокий индекс массы тела больного, большой объем предстательной железы (более 80 см³), предшествующая антикоагулянтная терапия, а в особенности то, что у пациента был установлен кардиостимулятор, обеспечивающий три варианта сердечного ритма. В связи с этим во время хирургического вмешательства практически невозможно было использовать монополярную коагуляцию (электрический ток коагулятора мог обусловить нарушение ритма сердца). Кроме того, выполнение робот-ассистированной радикальной простатэктомии пациенту осуществлялось в положении Тренделенбурга, с наклоном головного конца операционного стола на 30° на фоне карбоксиперитонеума для того, чтобы создать должное по объему рабочее пространство для введения и движения инструментов. Все эти неблагоприятные моменты способствовали давлению на диафрагму, легкие и сердце, затрудняя их работу.
Только при комплексном подходе умелых опытных специалистов, обладающих должными знаниями и профессиональными навыками, при возможности использовать высокотехнологичное оборудование можно рассчитывать на то, что хирургическое вмешательство и анестезиологическое пособие гарантированно можно осуществить в штатном формате и без осложнений.
Заключение. Представленные данные позволяют считать, что при системном динамическом наблюдении за пациентами, перенесшими трансплантацию органов и пребывающими под воздействием средств иммуносупрессивной терапии, особое внимание должно придаваться целенаправленному упреждающему выявлению онкологических заболеваний на ранних стадиях их формирования. Применение мини-инвазивных методов радикального хирургического лечения в сочетании с мультидисциплинарным подходом в условиях многопрофильного стационара обеспечивает оказание качественной медицинской помощи данной категории больных с минимальным риском осложнений и оптимальными результатами в отношении эффективности противораковой борьбы.



