Вопрос о характере регуляции процесса регенерации кожи при ожоговых ранах остается актуальным. Регенерация кожи включает несколько фаз, отличающихся определенной стадийностью [1–3].
Так, в процессе заживления ожоговой раны выделяют гнойно-некротическую фазу (1–3-и сутки), которая характеризуется высоким уровнем бактериальной загрязненности, гиперемией области раны, отечностью тканей и активным противостоянием бактериальной флоре иммунной системы. Далее следует фаза грануляции, которая является периодом очистки раны от гнойно-некротических масс, сопровождающимся уменьшением и исчезновением отеков, подавлением бактериальной агрессии (4–14 суток), и, наконец, фазу эпителизации, в период которой происходят восстановление кожного покрова или формирование рубца и окончательное заживление раны (3–4 недели).
В ряде работ показана возможность использования для лечения ран антиоксидантов, которые могут обеспечивать эффект стимуляции процессов репаративной регенерации [4, 5]. Одним из возможных препаратов для лечения ожоговых поверхностей может быть препарат, изготовленный на основе рекомбинантной супероксиддисмутазы [6].
Цель исследования. Оценить характеристики морфологических преобразований кожи и функционального статуса фибробластов в зоне ожоговой раны под влиянием супероксиддисмутазы.
Материалы и методы исследования
Экспериментальное исследование выполнено на 20 самцах беспородных крыс массой 180–200 г (ПЛЖ «Рапполово» Ленинградской области). Животных содержали в виварии с регулируемым световым режимом и свободным доступом к пище и воде, что соответствует ГОСТу 33044-2014 «Принципы надлежащей лабораторной практики» (приказ Федерального агентства по техрегулированию и метрологии от 20.11.2014 г. № 170-ст), а также Европейской конвенции о защите позвоночных животных, используемых для экспериментов или иных научных целей (ЕТ8 № 123; Страсбург, 18.03.1986 г.; https://textarchive.ru/c-2022735-pall.html). Содержание и дизайн исследований согласованы с Независимым этическим комитетом ФГБОУ ВО КубГМУ Минздрава России (протокол № 54 от 11.10.2017 г.). Исследование проводилось в течение 1,5 месяца. Обезболивание лабораторных крыс осуществляли с использованием ингаляционного наркоза (препарат «Севоран», Великобритания). Для моделирования ожоговой раны использовался латунный цилиндр площадью рабочей поверхности 706 мм2, массой 300 г, нагретый до 100°С в кипящей воде, равномерность давления на всей площади контакта обеспечивалась собственной тяжестью цилиндра. После нагрева цилиндр извлекали из сосуда, удаляли остатки воды и прикладывали своей рабочей поверхностью к депилированной коже лабораторного животного на 15 секунд, что обеспечивало формирование ожога Ша степени [7]. В зависимости от примененных воздействий все животные были разделены на две группы по 10 крыс в каждой. На раны контрольной группы крыс накладывали стерильную салфетку с 0,9%-ным раствором хлористого натрия. В группе сравнения по периферии ожоговой поверхности (на границе визуально определяемой «интактной» кожи) подкожно вводили стерильный раствор препарата супероксиддисмутазы (СОДМ) «Рексод» в концентрации 0,02 мг/кг, что соответствует 8000 ЕД/кг. Забор материала для гистологического исследования проводили на 1-е, 7-е, 14-е и 30-е сутки после отхождения струпа. Дополнительно однократно проводили забор материала для гистологического исследования из участков интактной кожи. Образцы тканей подвергали фиксации в 10%-ном нейтральном формалине. Проводку и заливку материала выполняли в процессорах фирмы Tissue-Tek VIP5Jr., (Япония). Из парафиновых блоков изготавливали срезы толщиной 10 микрон с использованием ротационного микротома HM 340 E (MICROM Laborgerate GmbH, Германия). Срезы окрашивали гематоксилином и эозином. Визуальное изучение материала осуществляли с использованием светового микроскопа МББ-1А при суммарном увеличении х100, х200 и х400. Иммуногистохимическое выявление коллагена было проведено с использованием моноклональных антител к коллагену I и III типа (ABCAM,USA) и системы визуализации (Nikon eclipse 80i, Japan). Документирование результатов исследования осуществляли цифровой фотокамерой DCM-310.
Результаты исследования и их обсуждение
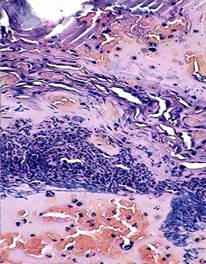
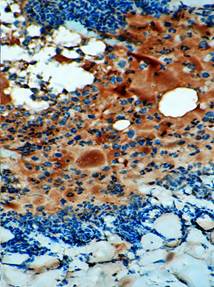
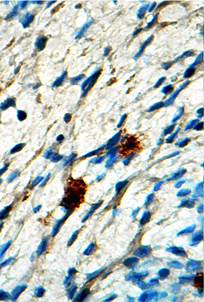
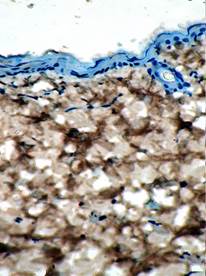
Изучение зоны ожога проведено в различные сроки, однако исходными были 1-е сутки после отторжение струпа. При изучении микропрепаратов, окрашенных гематоксилином и эозином, оказалось, что поверхность повреждения не эпителизирована, а участок дермы заполнен большим числом фибробластов и плазматических клеток. На различных участках повреждения морфологический статус дермы варьировал от зон обширной мононуклеарной инфильтрации со значительным числом кровеносных сосудов, характеризуемых явлениями стаза эритроцитов и зон белковой имбибиции, до участков с относительно стабилизированным клеточным составом, но с небольшим количеством коллагеновых волокон (рис. 1).
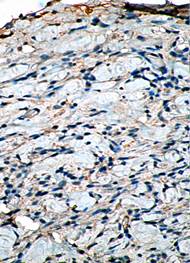
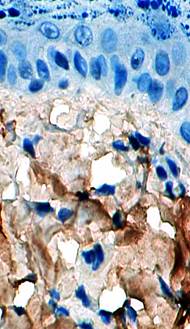
Изучение микропрепаратов с использованием иммуногистохимических реакций на коллаген I показало, что в 1-е сутки после отторжения струпа эффект эпителизации в препаратах контроля (без введения СОДМ) отсутствует, а участок дермы содержит клетки фибробластического типа, обнаруживающие слабую реакцию на коллаген I типа. Клетки уплощены, окрашиваются слабо и диффузно. При этом в отдельных фибробластах, характеризующихся наличием значительного числа отростков, отмечается накопление проколлагена, цитоплазма таких клеток окрашена в коричневый цвет диффузно и умеренно. Среди фибробластов встречается большое число крупных макрофагов (рис. 2).
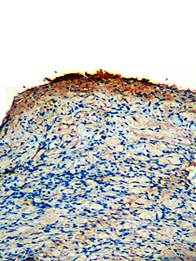
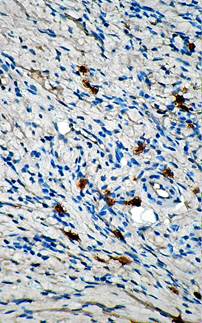
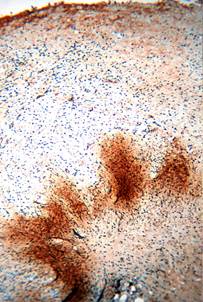
При использовании препарата СОДМ одноименный участок кожи характеризуется появлением положительной реакции на коллаген I типа на участке в зоне отторгнутого струпа, здесь слабо и диффузно окрашивается экстрацеллюлярный матрикс (рис. 3). В глубоких слоях дермы можно увидеть единичные фибробласты с высоким уровнем экспрессии коллагена I типа.
|
|
|
|
Рис. 1. Участок дермы в зоне ожоговой травмы на 1-е сутки после отхождения струпа (контроль, окраска гематоксилином и эозином. х400) |
Рис. 2. Иммуногистохимическая реакция на коллаген I типа в фибробластах (контроль. 1-е сутки после отторжения струпа. х400) |
|
|
|
Рис. 3. Иммуногистохимическая реакция на коллаген I типа в зоне отторгнутого струп (СОДМ 1-е сутки после отторжения струпа. х200)
|
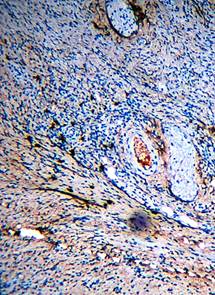
Цитоплазма этих клеток окрашивается диффузно, и клетки определяются в виде клякс с четко очерченной поверхностью. В зоне экстрацеллюлярного матрикса видны тонкие фибриллы, экспрессирующие коллаген III типа (рис. 4). В случае введения препарата СОДМ отмечается появление отдельных участков с умеренным уровнем содержания коллагена III типа в зоне внеклеточного матрикса дермы. Клетки с высоким уровнем экспрессии коллагена III типа выявляются в глубоких слоях дермы. Здесь можно наблюдать участки с высоким содержанием коллагена и в зоне экстрацеллюлярного матрикса (рис. 5). Интересно, что эти участки окружены большим числом клеток фибробластического типа. Коллаген III с высокой степенью экспрессии появляется не только на поверхности зоны ожога, но и в глубине участка повреждения в виде очагов в экстрацеллюлярном матриксе.
|
|
|
|
Рис. 4. Иммуногистохимическая реакция на коллаген III типа (контроль. 1-е сутки после отторжения струпа. х100) |
Рис. 5. Иммуногистохимическая реакция на коллаген III типа (СОДМ. 1-е сутки после отторжения струпа. х400) |
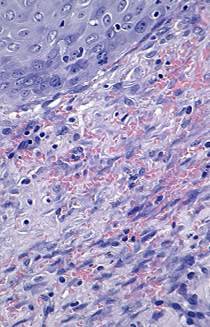
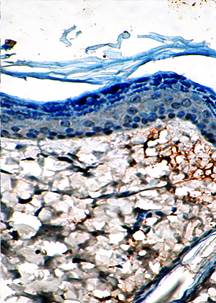
В период, соответствующий 7-м суткам после отторжения струпа (или 21-й день после ожоговой травмы), у животных контрольной группы поверхность раны начинает эпителизироваться, при этом формируемый пласт имеет дифференцируемые слои. Граница между эпидермисом и дермой относительно ровная, базальная мембрана не определяется. Изменения в дерме к этому сроку связаны с появлением в ее поверхностной зоне большого числа коллагеновых волокон, имеющих вид достаточно плотных пучков. Капилляры по-прежнему полнокровны, явления стаза сохраняются, однако белковой имбибиции не наблюдается, а явления мононуклеарной инфильтрации весьма умеренны (рис. 6).
На 7-е сутки после отхождения струпа в контроле в зоне ожога отмечается эффект эпителизации поверхности. При этом реакция на коллаген I типа связана с появлением в поверхностных слоях зоны ожога тонких фибриллярных структур, обнаруживающих умеренную экспрессию коллагена I типа. Прилежащая часть дермы содержит тонкие филаменты и уплотненные немногочисленные фибробласты с умеренным уровнем содержания коллагена I (рис. 7).
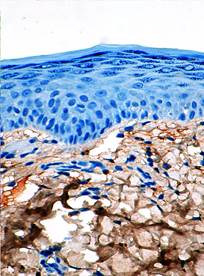
На фоне введения препарата СОДМ 7-е сутки репаративного процесса характеризуются наличием эпидермиса, в составе которого определяются все дифференцированные слои.
В случае лечения с использованием СОДМ интенсивность реакции отдельных компонентов дермы на коллаген I типа возрастает. При этом эффект увеличения экспрессии коллагена прослеживается как в поверхностной, так и в глубоких частях дермы. В других случаях увеличение экспрессии коллагена I типа происходило очагово на отдельных участках. Под действием СОДМ к 7-м суткам наблюдения выявляется резкое увеличение числа активных фибробластов (рис. 8). Клетки становятся крупными с большим числом отростков, т.е. с увеличением поверхности экзоцитоза. В цитоплазме этих клеток появляется большое число гранул, содержащих проколлаген.
|
|
|
|
|
Рис. 6. Зона ожоговой травмы (контроль. 7-е сутки после отхождения струпа. Окраска гематоксилином и эозином. х200) |
Рис. 7. Иммуногистохимическая реакция на коллаген I типа в поверхностной зоне. (контроль. 7-е сутки после отторжения струпа. х400)
|
Рис. 8. Иммуногистохимическая реакция на коллаген I типа (СОДМ. 7-е сутки после отторжения струпа. х200)
|
На 7-е сутки после отторжения струпа при выявлении коллагена III типа ожоговый участок кожи контрольных животных характеризуется наличием хорошо выраженного эпидермиса с четким делением его на дифференцированные слои. Участок дермы обнаруживает умеренную реакцию на коллаген III типа преимущественно в зоне экстрацеллюлярного матрикса, где отчетливо видны отдельные, нагруженные тропоколлагеном фибробласты (рис. 9). На участке с СОДМ в срок, соответствующий 7-м суткам, отмечается появление большого количества крупных активированных фибробластов. Отчетливо видно, что все клетки заполнены большим числом гранул, обнаруживающих высокую экспрессию коллагена III типа. В некоторых случаях обнаруживаются участки с высоким содержанием коллагена III типа в виде фибрилл, ассоциированных между собой с умеренной, а местами – с высокой экспрессией коллагена.
В некоторых случаях при избирательном выявлении коллагена III типа на фоне введения препарата, содержащего СОДМ, можно было наблюдать необычный очаговый характер его распределения (рис. 10).
На 14-е сутки эксперимента участок кожи контрольных животных покрыт эпидермисом. В зоне сосочкового слоя заметны тонкие волокна, обнаруживающие положительную реакцию на коллаген III типа. Здесь же встречались единичные фибробласты с узкой зоной цитоплазмы и низкой экспрессией коллагена III (рис. 11).
На фоне применения СОДМ – эпидермис широкий с большим числом клеток в составе герминативной зоны. Очень хорошо выражен зернистый слой, насчитывающий до 5 клеточных рядов. При этом клетки заполнены большим количеством гранул кератогиалина. Коллаген III типа выявлялся в виде тонких единичных фибрилл в зоне под эпидермисом. Местами обнаруживались мелкие лишенные отростков фибробласты с высоким уровнем экспрессии коллагена III типа (рис. 12).
На 30-е сутки в контрольных срезах определялся регенерированный эпидермальный пласт, сохраняющий эффект гиперплазии герминативного компартмента. Дерма под этим участком имела ровную границу, сосочки сглажены и неглубокие. Реакцию на коллаген III типа обнаруживали фибробласты, уровень экспрессии коллагена которых был достаточно высоким, а в отдельных клетках можно было увидеть единичные гранулы (рис. 13). Встречались фибробласты с неровными контурами за счет прилежащего к этим клеткам слабоокрашенного внеклеточного матрикса.
К 30-м суткам эксперимента на фоне введения препарата СОДМ граница между сосочковым и сетчатым слоями нивелируется. Дерма обнаруживает присутствие небольшого количества фибробластов с нечеткими размытыми границами, окружающий эти клетки экстрацеллюлярный матрикс окрашивается умеренно, а цитоплазма фибробластов – интенсивно (рис. 14).
|
|
|
|
||
|
Рис. 9. Иммуногистохимическая реакция на коллаген коллагена III типа (контроль. 7-е сутки после отторжения струпа. х400) |
Рис. 10. Иммуногистохимическая реакция на коллаген III типа (СОДМ. 7-е сутки после отторжения струпа. х100)
|
Рис. 11. Иммуногистохимическая реакция на коллаген III типа (контроль. 14-е сутки после отхождения струпа. х400) |
||
|
|
|
|
||
|
Рис. 12. Иммуногистохимическая реакция на коллаген III типа (СОДМ. 14-е сутки после отхождения струпа. х400) |
Рис. 13. Иммуногистохимическая реакция на коллаген III типа (контроль. 30-е сутки после отхождения струпа. х400) |
Рис. 14. Иммуногистохимическая реакция на коллаген III типа (СОДМ. 30-е сутки после отхождения струпа. х400) |
||
Известно, что в процессе заживления ожоговой раны выделяют три его фазы [8], среди которых: первая воспалительная, характеризующаяся вазодилатацией и отеком; вторая – пролиферативная фаза с эффектом сближения краев раны и реваскуляризацией; третья фаза – ремоделирование с заживлением зоны повреждения и формированием рубца. Перечисленные процессы ремоделирования протекают за счет биосинтеза коллагена и эластина, а также пролиферации фибробластов с трансформацией последних в миофибробласты. Суммируя вышесказанное, результаты проведенного нами исследования укладываются во вторую и третью его фазы.
Поскольку морфологическое изучение зоны повреждения проведено после отторжения струпа, то срок изучения – 1 сутки – соответствует 2 неделям после ожога. При этом эффект эпителизации зоны ожога и в контроле, и в эксперименте еще отсутствует.
В 1-е сутки после отторжения струпа под влиянием препарата, содержащего СОДМ, по сравнению с контролем происходят резкое увеличение в зоне повреждения числа клеток макрофагального и фибробластического рядов и существенная нормализация гемодинамики, выражающаяся в уменьшении явлений межуточного отека тканей, отсутствии белковой имбибиции, уменьшении явлений стаза в кровеносных сосудах.
Участок дермы после введения препарата, содержащего СОДМ, обнаруживал наличие клеточных элементов типа макрофагов и фибробластов, в составе последних выявлялись гранулы проколлагена, а окружающие их участки экстрацеллюлярного матрикса характеризовались экспрессией коллагена III типа.
На 7-е сутки исследования и в контроле, и в эксперименте при использовании препарата, содержащего СОДМ, имеет место эпителизация. Эпидермис характеризуется наличием четко выраженных клеточных рядов с большим количеством базофильно окрашенных клеток в зоне герминативного компартмента. По периферии ожогового повреждения формируется грануляционная ткань. Однотипные очаги с большим количеством клеток видны и в центре зоны повреждения. На 14-е сутки эксперимента зона герминативного компартмена сохраняет значительное число базофильных (активированных) клеток, а зернистый слой характеризуется присутствием крупных клеток, заполненных большим числом кератогиалина.
В дерме увеличивается число фибрилл, экспрессирующих коллаген I типа. Здесь выявляется много фибробластов с высоким уровнем экспрессии коллагена I. При этом в зоне вокруг фибробластов можно увидеть коллаген III типа.
На 30-е сутки эксперимента и эпидермис и дерма могут интерпретироваться как участок кожи, завершивший процесс регенерации. Использование препарата, содержащего СОДМ, сопровождалось формированием в зоне очага повреждения более широкого слоя эпидермиса, а в зоне дермы к этому времени появлялись упорядоченно расположенные коллагеновые волокна и большое число клеток фибробластического ряда. Объем герминативного компартмента снижался, а в дерме уменьшалось число фибробластов. Остающиеся фибробласты были крупными клетками с нечетко выраженными границами и с высокой степенью экспрессии коллагена III типа вокруг них.
Заключение
Полученные данные свидетельствуют, что использование препарата, содержащего СОДМ, стимулирует эффект эпителизации и изменение клеточного состава дермы и ее экстрацеллюлярного матрикса. Выявленные изменения дермы связаны с активацией фибробластов по пути синтеза ими коллагена с эффектом увеличения объема экстрацеллюлярного матрикса. К 30-м суткам на фоне введения препарата, содержащего СОДМ, эффект заживления завершается, тогда как у животных контрольной группы сохраняются отдельные участки, не восстановившие целостность.