Повсеместное значительное увеличение количества онкологических заболеваний, несмотря на большой арсенал противораковых средств их лечения, заставляет искать новые способы борьбы с ними. В последнее время бурно развивается направление по использованию вирусов различных вариантов (природных и сконструированных) для достижения онколитического эффекта [1, 2].
Считается, что онколитические вирусы обладают как прямым, так и опосредованным через иммунную систему действием, однако вклад каждого из этих эффектов в конечный результат, т.е. в торможение роста опухоли или ее регрессию, остается предметом обсуждения [3, 4]. Учитывая широкое применение в онкологических исследованиях иммунодефицитных животных, можно заключить, что именно они являются оптимальными моделями для разграничения иммуностимулирующего и собственно онколитического действия, хотя в работах, ориентированных на клиническое применение виротерапии, она все чаще упоминается в контексте комплексных и комбинированных, в том числе с иммунотерапией, подходов [5].
Эпидермоидная карцинома А431 представляет собой клеточную линию, выделенную из рака вульвы человека. Учитывая локализацию таких опухолей, они, как и рак шейки матки, часто развиваются в организме, инфицированном вирусами, из которых наиболее изучен вирус папилломы человека (ВПЧ), причем во многих работах сообщается о том, что именно у таких больных чаще наблюдается благоприятный прогноз заболевания. Несмотря на то что ВПЧ-инфекция считается этиологическим фактором этих опухолей, на основании метаанализа 33 работ, выполненных в различных странах мира, был сделан вывод о более благоприятном течении рака вульвы при наличии ВПЧ [6], что свидетельствует о том, что действие даже такого вируса с доказанной онкогенной ролью может быть не только негативным. Представляет несомненный интерес исследование вирусов с онколитическим потенциалом на CDX-модели (cell-derived xenograft) эпидермоидной карциномы А431.
В Ростовском институте микробиологии и паразитологии из фекальных экстрактов детей, больных ротавирусной инфекцией, старшим научным сотрудником к.м.н. С.А. Колпаковым были выделены два штамма ротавирусов (№ 228 и № 100), получивших рабочее название – «ротавирусы группы К (RVK)», поскольку не удалось отнести их ни к одной из известных групп ротавирусов. Штаммы были охарактеризованы как ротавирусные электронно-микроскопическими, серологическими и генетическими методами, аттенуированы и в настоящее время являются апатогенными [7]. Аттенуацию RVK человека проводили путем многократных пассажей (более 80) на гетерологичной культуре перевиваемых клеток эмбриона свиньи (СПЭВ) в среде 199 с добавлением 10% сыворотки крупного рогатого скота. Апатогенность аттенуированных штаммов проверяли на белых беспородных мышах и крысятах, вводя им внутримышечно по 0,3 мл и 0,6 мл штаммов RVK соответственно, что значительно превышает величину максимально переносимой дозы, рекомендуемой при исследовании общетоксических свойств, – 1000 мг/кг. При этом все животные не только были живы, но и сохраняли биологическую активность, их физиологические функции, поведение, аппетит, температура тела и другие показатели не отличались от таковых в сравнении с контрольной группой животных в течение всего срока наблюдения (30 дней).
Нами ранее были показаны литическая и проапоптогенная активность RVK на культурах опухолевых клеток in vitro [8] и противоопухолевое действие в эксперименте на животных-опухоленосителях in vivo с применением различных моделей. В экспериментах на мышах линии С57/Black6 с перевиваемой меланомой B16/F10 при введении им RVK в режимах «вакцинация» и «лечение», т.е. до и после перевивки опухоли соответственно, было показано существенное повышение продолжительности жизни животных [9].
Целью данной работы явилось изучение действия штаммов новой неклассифицированной группы ротавирусов человека семейства Reoviridae на рост эпидермоидной карциномы человека А431 (рака вульвы) в эксперименте.
Материалы и методы исследования. Экспериментальные исследования проводили на 15 бестимусных мышах-самках линии Balb/cNude массой 22–24 г, полученных из «SPF-вивария» ИЦиГ СО РАН (г. Новосибирск). Работа с животными осуществлялась в соответствии с правилами «Европейской конвенции о защите животных, используемых в экспериментах» (Директива 86/609/ЕЕС) и приказом Минздрава России от 19.06.2003 г. № 267 «Об утверждении правил лабораторной практики».
Культуру эпидермоидной карциномы А431, полученную из МНОЦ МГУ, использовали для перевивки после предварительного выращивания на 5 стерильных культуральных флаконах с площадью поверхности 75 см2 в среде RPMI 1640 с добавлением 10% телячьей эмбриональной сыворотки и 0,5% пенициллина-стрептомицина. Снятие культуры с поверхности флаконов проводилось раствором Трипсин-Версена (1:3), подсчет клеток проводили в камере Горяева. Для перевивки животным клеточную суспензию отмывали от компонентов сыворотки и антибиотиков раствором Хенкса, разбавляли в питательной среде RPMI 1640 и перевивали под кожу бедра в количестве 5х106 клеток в условиях SPF-зоны вивария. После образования пальпируемых опухолей (через 1 неделю после перевивки) животным опытных групп начинали еженедельное паратуморальное введение живых RVK штаммов № 100 и № 228 соответственно, всего 5 инъекций по 0,3 мл с концентрацией вирусных частиц 5х109/мл. 3-я (контрольная) группа получала физиологический раствор. Определяли динамику роста опухоли и ее объем, который рассчитывали по формуле Шрека. Индекс торможения и процент торможения роста опухоли вычисляли по формулам: ИТ=Vк/Vоп и ТРО=[(Vк-Vоп)/Vк]x100% соответственно, где Vк – объем опухоли в контрольной группе; Vоп – объем опухоли в опытной группе. Через 2 месяца мышей подвергали эвтаназии, в крови определяли состав субпопуляций лимфоцитов (Т-, В-, NK-клетки; В-клеточное звено: B220, CD23, sIgM) методом проточной цитометрии на анализаторе BD FACS Canto II, результаты выражали в процентах.
Статистическую обработку данных проводили с использованием программы Statistica 13. Поскольку группы были малочисленными и распределение показателей не являлось нормальным, данные обрабатывали с помощью непараметрического метода с определением U-критерия Манна–Уитни. Результаты представлены в виде медианы (Me), верхнего (UQ) и нижнего (LQ) квартиля (Ме [UQ; LQ]). Статистически значимыми считали различия при р<0,05, расценивали как тенденцию при 0,05<p<0,1.
Результаты исследования и их обсуждение
Результаты исследования представлены в таблице 1 и на рисунках 1–3. Как видно из таблицы 1, у мышей опытных групп значения объемов опухолей во все сроки исследования были меньше, чем у контрольных животных, особенно это касается мышей, получавших RVK штамма № 100. Статистически значимых отличий от контроля данный показатель достигает через 2 недели после перевивки и далее на протяжении всего срока наблюдения остается ниже контроля. Для RVK штамма № 228 статистически значимых отличий от контроля не найдено, хотя тенденция к снижению отмечена начиная с 3-й недели после перевивки опухоли.
Таблица 1
Влияние введения RVK на объем опухолей мышей в динамике наблюдения
|
Сроки после перевивки (недель) |
Показатели V опухоли (см3) |
||||
|
№ 100 |
№ 228 |
Контроль |
|||
|
(Ме) [LQ; UQ] |
р |
(Ме) [LQ; UQ] |
р |
(Ме) [LQ; UQ] |
|
|
2 |
2,4 [1,21; 3,01] |
0,045* |
2,9 [2,47; 3,31] |
0,22 |
3,16 [3,1; 4,65] |
|
3 |
2,55 [0,825; 4,8] |
0, 047* |
4,2 [3,6; 5,15] |
0,054** |
5,15 [4,4; 7,3] |
|
4 |
3,1 [1,1; 4,1] |
0,028* |
5,6 [2,5; 6,65] |
0,053** |
6,32 [4,3; 6,4] |
|
5 |
5,36 [1,49; 6,4] |
0,021* |
7,3 [3,17; 11,97] |
0,088** |
10,15 [7,82; 15,9] |
|
6 |
5,85 [1,1; 6,45] |
0,016* |
7,7 [3,13; 13,8] |
0,05** |
11,15 [7,55; 19,9] |
|
7 |
6,6 [2,0; 9,7] |
0,03* |
7,8 [3,9; 11,9] |
0,053** |
13,5 [10,5; 21,45] |
Примечание. * – статистически значимые отличия от контроля (р<0,05); ** – тенденция к отличию от контроля (0,05<p<0,1).
На рисунке 1 представлена динамика процента торможения роста опухоли, иллюстрирующая, что при применении штамма RVK № 100 через 3–4 недели после перевивки показатели выходят на плато, соответствующее 44–52%, а для штамма RVK № 228 такое плато наступает позже (через 37 дней), и нарастание показателя продолжается до 50-го дня после перевивки. Индекс торможения опухоли также был выше у мышей, получавших штамм № 100, и составлял в разные сроки исследования от 1,9 до 2,5, тогда как при введении штамма № 228 – от 1,4 до 1,8.
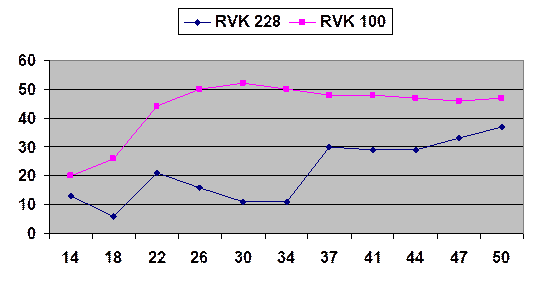
Рис. 1. ТРО А431 в динамике при введении RVK штаммов № 228 и № 100. Ось Х – сутки после перевивки опухоли; ось Y – ТРО (%)
Как видно из рисунка 2, через 2 месяца после перевивки объем опухоли у животных обеих опытных групп был меньше наблюдаемого в контроле, однако тенденция к статистически значимым различиям была только в случае штамма № 100: у мышей этой группы объем опухоли был в 2,7 раза меньше контроля (Ме 6,6 [LQ; UQ 2,2; 10,2] и 17,7 [LQ; UQ 11,4; 22,1] см3 соответственно, р=0,051), а после введения штамма № 228 – в 1,9 раза меньше (Ме 9,1 [LQ; UQ 3,25; 14,85] см3).
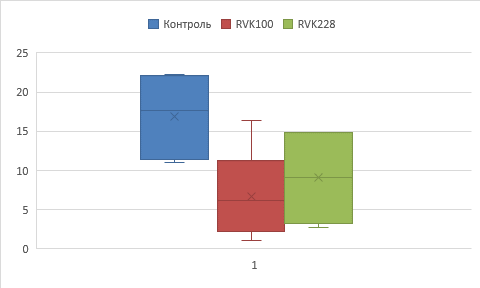
Рис. 2. Объем опухолей на 60-й день после перевивки (Ме); ось Y – объем опухоли (см3)
Результаты определения показателей клеточного иммунитета мышей опытных и контрольной групп представлены на рисунке 3. Т-лимфоциты содержатся в крови бестимусных мышей в минимальном количестве, однако они все же присутствуют, возможно, за счет клеток, содержащихся в Т-зонах лимфоузлов и селезенки. Обращает на себя внимание резкое возрастание содержания NK-клеток в крови опухоленосителей по сравнению с интактными бестимусными мышами (с 1% до 15–17%), при этом у животных опытных и контрольной групп оно не различается. Кроме того, у мышей с опухолями независимо от применения RVK по сравнению с интактными животными возрастает в 2–3 раза популяция не идентифицируемых данной панелью лимфоцитов. Их количество составляло 10–12%, они располагались в лимфоцитарном гейте, однако не относились ни к одной из субпопуляций (Т-В-NK-клеткам); для их характеристики необходима более развернутая панель антител.
Количество наиболее многочисленной популяции лимфоцитов, а именно В-клеток, в крови мышей-опухоленосителей снижено по сравнению с интактными, но при этом у мышей, получавших RVK штамма № 100, их содержание выше, чем у контрольных опухоленосителей (Ме 67 и 54 соответственно). В220 обычно используется как В-клеточный маркер мышей, хотя он эксперссирован и на других видах лимфоцитов и может рассматриваться как аналог СD45 человека (т.е. панлейкоцитарный антиген). СD23, как и у человека, является маркером активированных В-лимфоцитов. Как видно из рисунка 3, у мышей-опухоленосителей обнаружено снижение как В220+, так и СD23+ по сравнению с интактными животными, однако среди сравниваемых групп максимальное количество обеих популяций обнаружено у мышей, получавших RVK № 100, хотя статистически значимых различий выявить не удалось. Количество лимфоцитов с мембранным рецептором IgM составляло от 0,2% до 0,37% от всех лимфоцитов.
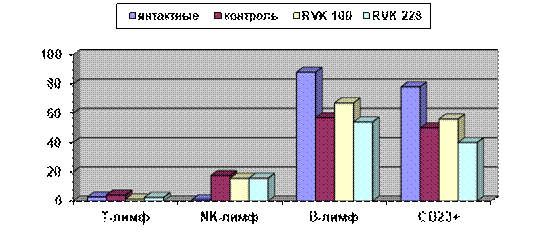
Рис. 3. Влияние введения RVK на показатели клеточного иммунитета у мышей, ось Y – %
Механизмы полученного эффекта, как мы полагаем с учетом использованной модели бестимусных мышей, могут быть связаны, прежде всего, с прямым онколитическим действием вирусов, возможно, осуществляемым через рецепторы опухолевых клеток [10]. Так, в работе C.A. Guerrero (2016), выполненной на культурах клеток, установлено, что свежевыделенные или коллекционные штаммы ротавирусов при адаптации к росту на линиях опухолевых клеток могут взаимодействовать с такими рецепторами, как PD1, HSP70, интегрины, колокализация которых с вирусными антигенами была выявлена авторами с помощью конфокальной микроскопии. В той же работе показано, что ротавирусы, инфицирующие клетки опухолевых линий, вызывают конденсацию хроматина, фрагментацию ДНК и апоптоз, сопровождающийся инактивацией PARP-1, с последующим лизисом и синцитиеобразованием, причем активность адаптированных штаммов отличалась от активности свежевыделенных. Кроме того, она различалась в зависимости от клеток-мишеней, что отражает генетическую гетерогенность ротавирусов, вызванную мутациями или реассортиментом в ходе их адаптации. По данным авторов, адаптация ротавирусов, полученных из различных источников, после многократных пассажей на опухолевых клетках может привести к получению штаммов, высокоактивных против них, хотя нельзя не отметить, что на культуре аденокарцимномы толстой кишки Caco-2 их рост оказался хуже, чем на других, т.е. тропность к клеткам, происходящим из кишечного эпителия, была незначительной [11].
Поскольку вышеназванные рецепторы экспрессированы на многих опухолевых клетках, круг мишеней для ротавирусов может быть весьма широким и не обязательно тканеспецифичным. В этом плане не исследован EGFR, экспрессированный на клетках использованной нами линии [12], также представляют несомненный интерес HSP рецепторы [11]. В дальнейшем такое исследование может быть проведено на PDX-ксенографтах (patient-derived xenografts) [13] или с использованием «локальной гуманизации» иммунодефицитных мышей с помощью мезенхимальных стволовых клеток человека [14].
Кроме того, по-видимому, не следует полностью отвергать и вклад иммунной системы, несмотря на то, что у бестимусных мышей отсутствует полноценное Т-клеточное звено. При введении вирусов у них могут стимулироваться факторы врожденного иммунитета, а полученный эффект сопровождается активацией В-клеточного звена. Как в данной работе, так и в других описано выраженное повышение уровня NK-клеток в крови и селезенке бестимусных мышей с опухолевыми ксенографтами [13, 15].
Заключение. Итак, на модели эпидермоидной карциномы вульвы человека, трансплантированной бестимусным мышам, установлено торможение ее роста под действием RVK, что свидетельствует о наличии у них онколитических свойств, а также, возможно, опосредовано через иммунную систему, представленную у бестимусных мышей преимущественно В-звеном. Такое действие выявлено в большей степени у штамма № 100.



