Сахарный диабет 1-го типа сохраняет лидирующие позиции по росту заболеваемости [1]. По данным федерального регистра, на начало 2021 г. в Российской Федерации больных СД было более 4,5 млн человек [1], из них свыше 6% составили больные сахарным диабетом 1-го типа. Снижение качества жизни и ранняя инвалидизация пациентов с СД 1-го типа обусловлены, в первую очередь, хроническими сосудистыми осложнениями [2]. Негативное влияние длительного повышения уровня глюкозы крови, процессов аутоиммунного воспаления, нарушения функции эндотелия, дисбаланс окислительно-восстановительных процессов, нарушения со стороны вегетативной нервной системы ведут к ухудшению состояния миокарда с развитием нарушения диастолической функции, а в дальнейшем – и нарушением систолической функции [3, 4, 5]. Это в последующем вызывает клинические проявления некоронарогенного поражения миокарда с симптомами сердечной недостаточности у больных СД [4, 6].
Одной из форм диабетической автономной нейропатии является кардиоваскулярная автономная нейропатия (ДКАН) [2, 7], возникающая вследствие нейрональной дегенерации симпатических и парасимпатических волокон, связанной, в первую очередь, с хронической гипегликемией, с характерными проявлениями со стороны сердечной деятельности и тонуса сосудов, которые проявляются тахикардией, нарушениями ритма сердца, нестабильным артериальным давлением, со склонностью к гипотензии [1, 2, 7]. По данным различных авторов, распространенность ДКАН колеблется от 2,5% до 90% [2]. Своевременная диагностика автономной кардиальной нейропатии у больных СД 1-го типа имеет большое значение. Это связано с тем, что манифестация данного осложнения при хронической гипергликемии характерна для больных молодого возраста (25–40 лет) c ограничением их жизненной активности. По данным разных авторов, распространение ДКАН связано с неудовлетворительным контролем углеводного обмена при длительном стаже СД, а также с возрастом [2, 7].
В рассмотрении процессов, влияющих на формирование поражения миокарда при сахарном диабете, вызывает интерес оценка возможного влияния некоторых маркеров эндотелиальной дисфункции. Исследование Е-selectin, Р-selectin и sICAM-1 позволяет рассмотреть механизмы формирования ДД ЛЖ при диабетической кардиопатии более детально.
Использование современных технологий по геномным исследованиям осуществляется с анализом ассоциаций полиморфных генетических маркеров и оценкой силы их влияния на развитие заболеваний. С момента открытия полиморфизма гена эндотелиальной синтазы азота (еNOS) проводится активный поиск ассоциаций различных комбинаций аллелей генов, связанных с оксидативным стрессом и развитием эндотелий-зависимых сосудистых осложнений, в том числе и при СД 1-го типа. В некоторых работах показано, что полиморфизм С(786)Т гена NOS3 обусловливает недостаточную активность NO-синтазы, что является причиной изменения уровня NO, а также его активности [8]. На фоне патологической реакции эндотелия отмечается повышение уровня провоспалительных цитокинов, что приводит к повышению уровня концентрации молекул межклеточной адгезии [9], происходят снижение активности эндотелиальной синтазы оксида азота (eNOS) и одновременный рост концентрации активных форм кислорода [2, 9], которые, в конечном счете, оказывают влияние на развитие, в том числе поражение миокарда у больных сахарным диабетом с нарушением диастолической функции ЛЖ.
Таким образом, для своевременной диагностики данного осложнения является актуальным изучение маркеров эндотелиальной дисфункции и полиморфизма NOS3 C(786)T с проявлениями автономной нейропатии при СД с формированием диастолической дисфункции миокарда.
Разработка модели прогнозирования формирования поражения миокарда с развитием ДД ЛЖ у лиц с инсулинозависимым диабетом при учете влияния отдельных показателей эндотелиальной дисфункции и наличия полиморфизмов генов С(786)Т NOS3 позволит выделить больных группы риска для ранней диагностики и профилактики прогрессирования данного осложнения.
Цель исследования: выявить предикторы развития нарушения диастолической функции миокарда левого желудочка и на их основании разработать метод оценки и прогнозирования ДД ЛЖ у больных сахарным диабетом, проживающих в Забайкальском крае (ЗК).
Материалы и методы исследования
В исследовании использованы данные клинического обследования 190 человек (140 лиц с СД 1-го типа и 50 здоровых лиц, которые составили контрольную группу), постоянно проживающих в ЗК. Набор пациентов инсулинозависимым диабетом осуществлялся в ГУЗ «ККБ» и ГУЗ «КМЦ г. Читы». Согласование по проведению данного исследования одобрено локальным этическим комитетом – протокол № 57 от 13.11.2013 г. Все лица, участвующие в исследовании, были информированы о проводимом исследовании и подписали добровольное согласие на участие в исследовании. В исследование включены больные СД 1-го типа с длительностью более 3 лет в возрасте от 18 до 40 лет, средний возраст составил 32 года [26,5; 40], из них мужчин – 72 человека, женщин – 68.
Критерии исключения: СД 2-го типа; период беременности и лактации; острые осложнения сахарного диабета в течение 2 месяцев; хронические и острые воспалительные заболевания; заболевания сердечно-сосудистой системы с поражением миокарда и коронарных артерий, тяжелые нарушения ритма сердца; артериальная гипертензия; заболевания легких; почечная и печеночная недостаточность; поражение периферической нервной системы недиабетического генеза; аутоиммунные поражения соединительной ткани; онкологические заболевания (любой локализации); хронический алкоголизм.
Всем лицам с СД проводили диагностику диабетической кардиоваскулярной автономной нейропатии с выполнением тестов, рекомендованных «Алгоритмами СД» [1]. Кардиоваскулярная автономная нейропатия диагностирована по результатам тестирования у 159 человек.
Всем пациентам было проведено эхокардиографическое исследование с определением нарушений релаксации левого желудочка. Для оценки диастолической дисфункции использовались следующие критерии:
1-я степень (замедленное расслабление): Е/А <0,8; Е<50 см/сек; или если имеется хотя бы один из нижеперечисленных трех критериев: E/e' >14; ИОЛП > 34 мл/м2; ТР >2,8 м/с;
2-я степень (псевдонормальный тип): если имеются хотя бы два критерия из нижеперечисленных трех: E/e' >14; ИОЛП > 34 мл/м2; ТР >2,8 м/с;
3-я степень (рестрикция): Е/А >2,0 [10].
По результатам исследования функция релаксации левого желудочка у больных сахарным диабетом ДД левого желудочка выявлена у 34 человек.
Для молекулярно-генетического исследования выбрана точка мутации эндотелиальной NOS3 в позиции 786 (Т>С). ДНК выделяли из цельной крови. Амплификацию фрагментов генов проводили в термоциклере. Использовались готовые тест-наборы праймеров HПФ «Литex».
Определение показателей эндотелиальной дисфункции: sICAM-1; sE-selectin; sP-selectin – проводили в сыворотке крови с применением готовых наборов на автоматичeском ИФА-анализаторе.
С помощью пакета специализированных программ проводили статистический анализ данных, полученных в ходе исследования, отображенных в виде (Ме) 25-го и 75-го процентилей. Различия, соответствующие р<0,05, считали статистически значимыми. При анализе вариационных рядов осуществляли тестирование на нормальность с применением критерия Колмогорова–Смирнова. Сравнение 3 показателей и более проводилось с использованием критерия Крускала–Уоллиса. При сопоставлении 2 групп использовался статистический критерий Манна–Уитни. Анализ качественных показателей проводили с помощью критерия Пирсона (χ2).
Проверка генотипов по изученным полиморфным локусам НА соответствие равновесию Харди–Вайнберга проводилась с использованием критерия c2. Высчитывалось отношение шансов (ОШ) с расчетом доверительного интервала (ДИ) 95%. Для построения прогностической модели использовался метод бинарного логистического анализа. Проводили оценку точности прогноза путем расчета показателей чувствительности, специфичности, прогностической ценности положительного и отрицательного результата.
Результаты исследования и их обсуждение
По данным проведенного обследования у 59 человек (42%) с СД 1-го типа диагностирована ДКАН согласно рекомендациям «Алгоритмы по диагностике ДАКН» [1]. У 27,4% больных сахарным диабетом 1-го типа по результатам ЭхоКГ с оценкой трансмитрального потока диагностировано нарушение диастолической функции ЛЖ. Пациенты были распределены следующим образом: 1-я группа – больные с ДД ЛЖ (34 человека), 2-я группа – 90 человек без диагностированной диастолической дисфункции ЛЖ.
При оценке показателей эндотелиальной дисфункции у пациентов с диагностированной ДД левого желудочка и без нее отмечено, что показатели sICAM-1, sP-селектин и sE-селектин в сыворотке крови превышали аналогичные показатели контрольной группы (рис. 1). Так, уровень sE-selectin в группе больных без ДД ЛЖ превышал показатели здоровых лиц на 28,93% (p=0,019), а в группе пациентов с нарушением диастолической функции – на 55,6% (р=0,0036). Уровень sP-селектина в исследуемых группах больных диабетом при сравнении с аналогичным показателем контрольной группы достоверно значимо не менялся (р=0,9). Концентрация sICAM-1 в первой группе лиц с СД 1-го типа выше контрольных показателей на 11,93% (p=0,028), а у больных с диагностированным нарушением диастолической функции ЛЖ при сравнении с контролем выше на 58,37% (р=0,01) (рис. 1).
При сравнении показателей эндотелиальной дисфункции в группах больных СД 1-го типа с ДД ЛЖ и без таковой установлено, что уровень sICAM-1 на 41,5% выше (р=0,03), чем в группе без нарушения диастолической функции миокарда. Значение sE-селектина в группе с ДД левого желудочка на 20,7% превышает аналогичный показатель 2-й группы больных (p=0,009).
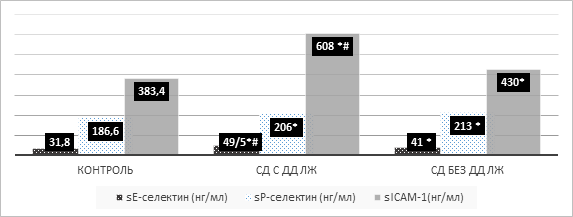
Рис. 1. Уровень sE-селектин, sP-селектин, sICAM-1 у больных сахарным диабетом с ДД ЛЖ и без нее
Примечание: *р≤0,05 при сравнении с контролем, # – р≤0,05 при сравнении с ДД ЛЖ и без ДД ЛЖ
По данным проведенного генетического анализа больных с СД 1-го типа, включенных в настоящее исследование и проживающих в Забайкальском крае, с наличием или отсутствием нарушения диастолической функции миокарда левого желудочка установлено, что исследуемый генотип удовлетворяет критериям закона Хайди–Вайнберга.
Определено, что среди лиц с инсулинозависимым диабетом, у которых диагностирована ДД левого желудочка, и при отсутствии ее генотип CT NOS3 C(786)T встречался в 26,4% и 52,8% случаев соответственно (таблица), данные показатели определены при изучении распределения генотипов. У больных с отсутствием нарушения диастолического наполнения левого желудочка более чем в 1,5 раза чаще регистрировался генотип СC. У пациентов с ДД левого желудочка в 1,6 раза реже был отмечен генотип TT (р=0,02).
На основании полученных результатов генетического распределения частот происходит значительное увеличение рисков формирования нарушения релаксации ЛЖ у лиц с сахарным диабетом 1-го типа, у которых присутствует генотип ТТ NOS3 C(786)T (ОШ 2,58, 95%-ный ДИ: 1,16–5,76, р=0,03). Формирование диастолической дисфункции ЛЖ у носителей генотипа СТ уменьшается в 3 раза (ОШ 0,33, 95%-ный ДИ: 0,14–0,79, р=0,01) (рис. 2) [8].
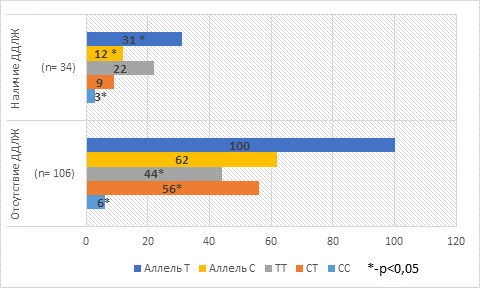
Рис. 2. Распределение генотипов и аллелей у пациентов с СД 1-го типа в зависимости от наличия и отсутствия ДДЛЖ
В настоящей работе использовался метод бинарной логистической регрессии для выявления факторов, оказавших влияние на развитие ДД ЛЖ у больных сахарным диабетом 1-го типа. Для формирования модели применялись показатели, которые имели значимые отличия у больных с диагностированной ДД ЛЖ, а именно: кардиоваскулярная нейропатия, уровень sICAM-1, полиморфизм гена NOS3. В таблице представлены показатели, внесенные в математическую многофакторную модель прогнозирования. Положительная предсказующая ценность при этом составляет 74,1%, а вклад факторов, включенных в модель, – 65,2%. Представлено уравнение итоговое с учетом уровня значимости р=0,006811. Потери при составлении уравнения были 5,873577, χ2=74,3% для 3 степеней свободы. Представленные данные свидетельствуют о высокой степени достоверности.
Показатели (свободный член, коэффициенты регрессии) многофакторной модели прогнозирования развития ДД ЛЖ у больных сахарным диабетом 1-го типа
|
Шаг |
Показатель |
Оценка |
95%-ный ДИ |
p |
χ2 Вальда |
p-Вальда |
|
1 |
B0 |
–0,2343 |
–0,1039; –0,2814 |
0,0069 |
6,6771 |
0,0071 |
|
2 |
sICAM-1 |
0,1637 |
0,0519; 0,1871 |
0,0092 |
9,7813 |
0,0087 |
|
3 |
КДАН |
0,1611 |
0,0431; 0,2235 |
0,0015 |
7,7434 |
0,0011 |
|
4 |
Генотип ТТ гена NOS3 |
0,8222 |
0,3799; 0,9907 |
0,0003 |
7,8684 |
0,0004 |
Примечание: В0 – свoбoдный член; показатель sICAM-1 в сыворотке крови; при КДАН – равен 0 при отсутствии диабетической автономной кардиопатии и равен 1 при ее наличии; Генотип ТТ гена NOS3 – принят равным 0 при отсутствии генотипа ТТ гена NOS3 и принят равным 1 его наличии.
Итоговое урaвнение вероятности формирования ДДЛЖ:
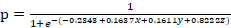 ,
,
где р – вероятность развития ДДЛЖ;
е – основание натурального логарифма ≈ 2,718284;
x – sICAM-1 при концентрации свыше 608 Nr/Mn равен 3, при концентрации от 415 до 608 Nr/Mn равен 2, при концентрации менее 415 Nr/Mn равен 1;
y – принят равным 0 при отсутствии КДАН и принят равным 1 при ее наличии;
z – принят равным 0 при отсутствии генотипа ТТ гена NOS3 и принят равным 1 при его наличии.
Вероятность развития ДД ЛЖ оценивается как высокая при р>0,5 и как низкая при р≤0,5.
С использованием показателей, полученных в настоящем исследовании у лиц с сахарным диабетом 1-го типа, составлено уравнение для прoгнoзирования рискa развития ДДЛЖ в зависимости от сывороточной концентрации молекулы межклеточной адгезии sICAM-1 с учетом факта наличия диабетической автономной нейропатии, наличия гомозиготного варианта ТТ гена NOS3.
Длительное повышение уровня глюкозы крови является мощным фактором в развитии значимых биохимических, иммунологических и метаболических нарушений у больных сахарным диабетом. Постоянное воздействие факторов риска при СД способствует развитию эндотелиальной дисфункции, возникновению изменений структуры сосудистой стенки, что имеет большое значение для развития диабетической кардиомиопатии у пациентов с СД 1-го типа. Повреждение эндотелия ведет к стимуляции синтеза факторов роста, цитокинов и вазоактивных агентов другими клетками. Эндотелию принадлежит главная роль в поддержании тонуса сосудов и гемостаза, а также процессов хронического воспаления [9, 11]. Хроническое воспаление способствует активной продукции провоспалительных цитокинов, которые, в свою очередь, приводят к активации клеток эндотелия и выделению сначала E-selectin, который опосредует обратимую адгезию лейкоцитов к эндотелию, а затем интегринов и межклеточных адгезивных молекул (ICAM-1 и VCAM-1). У лиц с сахарным диабетом 1-го типа были определены повышенные сывороточные уровни ICAM-1 [11], что подтверждается данными нашего исследования. Экспрессированные молекулы межклеточной адгезии способствуют процессам агрегации и адгезии активированных форменных элементов крови [8]. При различных воспалительных и тромботических заболеваниях избыточный уровень P-селектина и Е-селектина на поверхности эндотелиоцитов приводит к аккумуляции нейтрофилов [11]. Изучение P-селектина и Е-селектина в крови могло бы дать возможность глубокого рассмотрения патогенеза формирования болезней, связанных со множеством протекающих воспалительных процессов, повреждением при ишемии-реперфузии, тромботических заболеваний, в том числе и при сахарном диабете 1-го типа. Мы опираемся на наше предположение, что в случае повышения уровня молекул межклеточной адгезии образуются нарушения микроциркуляции в миокарде, приводящие в последующем к развитию нарушений тугоэластических свойств миокарда и, как следствие, к нарушениям релаксации левого желудочка. В итоге эта совокупность способствует развитию сердечной недостаточности. В представленной работе показано значительное повышение уровня sICAM-1 и sЕ-селектина в группе больных с диагностированным нарушением диастолической функции миокарда левого желудочка на фоне СД 1-го типа [9].
Согласно литературным данным, уровень NO снижается при мутации гена C(786)T еNOS3 [11, 12]. В настоящее время считается, что полиморфизм Т(-786)С гена эндотелиальной синтазы азота связан с поражением сосудов сердца. У носителей аллеля С имеется риск развития инфаркта миокарда [8]. По данным различных авторов, генетический риск развития диабетических осложнений неоднозначен в различных популяциях. Имеются работы, в которых показан повышенный риск развития нефропатии у больных сахарным диабетом 1-го типа с носительством гомозиготного типа ТТ Т(786)С гена NOS3 по сравнению с носителями генотипов ТС [13, 14]. Имеются данные, что больные диабетом 1-го типа европеоидной расы – носители 786 С/T подвержены развитию ретинопатии на фоне заболевания [15]. Генетический анализ у лиц с сахарным диабетом с предрасположенностью к развитию диабетической нейропатии показал, что взаимосвязь с аллелем С имеется только у больных СД 2-го типа [13]. В нашем исследовании выявлена взаимосвязь гомозиготного варианта ТТ гена NOS3 с развитием диастолической дисфункции левого желудочка, которая является маркером развития диабетической кардиомиопатии у больных СД 1-го типа.
Заключение. На основании метода бинарной логистической регрессии определены значимые факторы в развитии нарушения диастолической функции у лиц с сахарным диабетом 1-го типа, такие как уровень молекулы межклеточной адгезии sICAM-1, наличие диабетической кардиоваскулярной автономной нейропатии, а также гомозиготного варианта ТТ гена Т(786)С NOS3. С учетом полученных результатов можно прогнозировать раннее развитие поражение миокарда у больных СД 1-го типа, своевременно диагностировать его и разрабатывать профилактические мероприятия по предупреждению развития диабетической кардиомиопатии у данной категории больных.



