Вентилятор-ассоциированная пневмония (ВАП) – это поражение легких пневмотропными патогенами, развивающееся через 48 ч с момента начала искусственной вентиляции легких (ИВЛ) [1]. Однако в настоящее время не существует общепринятого золотого стандарта диагностики ВАП. Обсуждаются методы идентификации заболевания. Большинство исследователей считают доказательным признаком ВАП отсутствие пневмонии перед ИВЛ. Однако в настоящее время признаками заболевания являются не только отсутствие пневмонии перед интубацией, но и наличие новых или прогрессирование старых инфильтратов на рентгенограмме органов грудной клетки через 72 ч после интубации трахеи или появление свежих пневмонических очагов на фоне старых при ИВЛ [2, 3, 4]. ВАП развивается у 8–20% тяжелых больных и в 50% случаев является причиной неблагоприятного исхода среди больных в критическом состоянии. Частота развития ВАП связана с продолжительностью нахождения больного на ИВЛ и обусловлена комплексом неблагоприятных экологических риск-факторов [5]. В Кыргызской Республике социально-экономические катаклизмы, развал профилактической медицины, снижение качества медицинского наблюдения за женщинами фертильного возраста и беременными, нарушение программы ВОЗ рационального планирования семьи, ликвидация детских поликлиник, ухудшение мониторинга за состоянием здоровья новорожденных обусловили рост и тяжесть клинического течения пневмоний, особенно у недоношенных детей (РМИЦ МЗ КР, 2020). В силу морфофункциональной незрелости органов и систем новорожденные, особенно недоношенные, наиболее ранимы. Недоношенность является одной из основных причин (неблагоприятным преморбидным фоном), обусловливающих легкость возникновения, тяжесть клинического течения и исхода пневмоний. Особую актуальность представляет изучение этиологической структуры неонатальных пневмоний у детей, подключенных к ИВЛ, с последующим развитием ВАП, отягощающих течение заболевания и исход. Частоту развития и характер ВАП обусловливают инвазивные диагностические, лечебные технологии в неонатологической практике и продолжительность ИВЛ [6]. Следует отметить, что верификация заболевания у новорожденных затруднена, и лечение часто проводится эмпирически, методом «проб и ошибок», с развитием антибиотикорезистентности этиотропных патогенов. В связи с этим требуются расширение и совершенствование методов диагностики заболевания, изучение изменчивости этиологической структуры заболевания в динамике для оценки чувствительности пневмотропных патогенов к антибиотикотерапии, приемлемой в неонатологической практике [7]. Все вышеизложенное обусловило актуальность исследования.
Цель исследования. Выявить изменчивость этиологической структуры ВАП у новорожденных детей в динамике заболевания для совершенствования лечебно-профилактических программ.
Материал и методы исследования. Исследование проводили на базе неонатологического реанимационного отделения Городской детской клинической больницы скорой медицинской помощи (ГДКБСМП) города Бишкека и в отделении реанимации новорожденных в городском перинатальном центре. В соответствии с поставленной целью обследованы 166 новорожденных детей, разделенных на 3 группы:
1-я основная группа – 55 доношенных новорожденных детей с ВАП;
2-я основная группа – 69 недоношенных новорожденных детей с ВАП;
3-я контрольная группа – 42 здоровых новорожденных детей.
Этиология пневмоний изучена различными методами. Микробиологические исследования трахеобронхиального аспирата производились в стерильных условиях после подготовки пробы (в пробирку содержимое с ЭТТ добавляли 5 мл стерильного физиологического раствора, центрифугировали 30 мин, после этого катетер удаляли стерильным пинцетом и встряхивали руками; 500 мкл образца из пробирки переносили в специальные флаконы бактериологического анализатора HB&L LIGHT (ALIFAC, Италия)). Анализатор проводит качественное исследование наличия/отсутствия микробного роста, также количественные результаты в режиме реального времени и параллельно посеяны классическим культуральным методом на твердые и жидкие питательные среды (5%-ный кровяной агар, шоколадный агар, желточно-солевой агар, среда Сабуро, среда Эндо).
Все исследуемые сыворотки пациентов тестировались методом иммуноферментного анализа (ИФА) на определение содержания специфических антител IgM и IgG к Chlamydophila pneumoniae, Mycoplasma pneumoniae, Ureaplasma urealyticum, ВПГ-1/ВПГ-2, ЦМВ с помощью автоматических ИФА-анализаторов Alisei Q.S. (SEAC, Италия) и ROCHEN Cobos (Италия).
Исследования проводились в динамике: в первые сутки взятия на ИВЛ <24 ч, далее – через 48–72 ч и более 72 ч. Для изучения этиологической структуры ВАП проведен 341 микробиологический посев. Данные проведенных исследований были обработаны статистическим программным обеспечением SPSS 16.0.
Результаты исследования и их обсуждение. Гендерный анализ показал, что в обеих группах больных новорожденных с ВАП достоверно преобладали мальчики (р<0,05). В контрольной же группе гендерных различий не выявлено (р>0,05). В реанимации основным исходом ВАП (р<0,05) было выздоровление. Однако в обеих основных группах более чем у половины больных (56,36% и 55,07%, р>0,05) отмечен летальный исход. В контрольной группе случаев летального исхода нет. Не выявлено достоверных различий (р>0,05) по гендерной принадлежности и исходу ВАП между доношенными и недоношенными детьми (рис. 1).
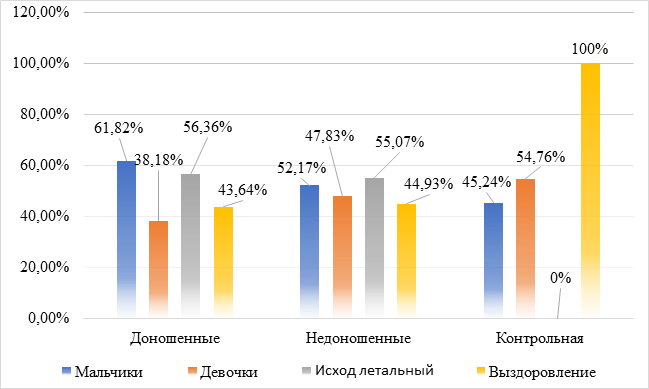
Рис. 1. Гендерное соотношение и исход больных ВАП
При микробиологическом исследовании установлено, что в целом и по группам преобладает высев микробной флоры (р<0,001), в 3–4 раза реже высев грибов или отрицательный посев. В основных группах высевы грамположительной и грамотрицательной флоры отмечаются практических в равных соотношениях (р>0,05). В контрольной группе преобладает (р<0,01) грамположительная флора (табл. 1).
Таблица 1
Этиологическая структура пневмоний у исследованных групп новорожденных
|
Группа |
Доношенные |
Недоношенные |
Контрольная |
Итого |
||||
|
Флора |
Кол |
% |
Кол |
% |
Кол |
% |
Кол |
% |
|
Грамположительная |
76 |
35,35 *** |
78
|
28,36 *** |
62 |
51,67 ** |
216 |
35,41 *** |
|
Грамотрицательная |
108 |
50,23 *** |
153 |
55,64 *** |
7 |
5,83 |
268 |
43,93 *** |
|
Грибы |
17 |
7,91 |
21 |
7,64 |
25 |
20,83 |
63 |
10,33 |
|
Роста микрофлоры нет |
14 |
6,51 |
23 |
8,36 |
26 |
21,67 |
63 |
10,33 |
|
Итого |
215 |
100% |
275 |
100% |
120 |
100% |
610 |
100% |
Примечание * – р <0,05; ** – р <0,01; *** – р <0,001
Не выявлено достоверных различий (р>0,05) при сравнительном анализе этиологической структуры ВАП между доношенными и недоношенными новорожденными (рис. 2).
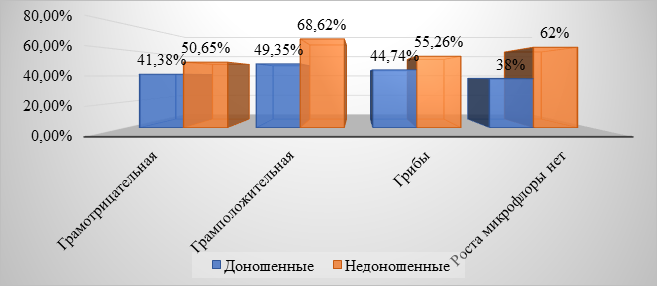
Рис. 2. Сравнительная этиологическая структура пневмоний у доношенных и недоношенных детей
Вышеизложенное позволяет проводить изучение этиологической структуры в объединенной группе новорожденных детей. Всего в динамике проведено 341 бактериологическое исследование.
На первом этапе при взятии детей на ИВЛ (в первые 24 ч) высевается практически в равных соотношениях грамположительная и грамотрицательная микрофлора (р>0,05), в 3–4 раза реже высеваются грибы.
На втором этапе (через48–72 ч ИВЛ) уменьшается высев грамположительной флоры с ростом грамотрицательной флоры. Но эти изменения еще недостоверны (р>0,05). Высев грибов снижается благодаря назначению антимикотической терапии.
На третьем этапе (через 72–96 ч ИВЛ) выражен рост флоры, специфичной для ОРН: идет достоверный рост (р<0,01) госпитальной грамотрицательной флоры на фоне снижения высева (р<0,05) грамположительной флоры (табл. 2).
Таблица 2
Динамика микробной флоры у ВАП больных
|
Флора |
<24 ч |
48–72 ч |
>72 ч |
Всего |
|
Грамположительная |
55 (35,71%) |
47 (30,52%) |
52 (33,77%)* |
154 (100%)* |
|
Грамотрицательная |
41 (15,71%) |
92 (35,25%) |
128 (49,04%) ** |
261 (100%) |
|
Грибы |
18 (47,37%) |
14 (36,84%) |
6 (15,79%) |
38 (100%) |
|
Роста нет |
13 (35,14%) |
10 (27,03%) |
14 (37,84%) |
37 (100%) |
|
ИТОГО |
127 (25,92%) |
163 (33,26%) |
200 (40,82%) |
490 (100%) |
Примечание * – р <0,05; ** – р <0,01; *** – р <0,001
Следовательно, с увеличением срока пребывания детей на аппарате ИВЛ происходят значительные изменения микрофлоры дыхательных путей. Идет рост грамотрицательной флоры контаминационного генеза, требующей антибактериальной терапии, ограниченной в неонатальной практике из-за ряда токсических воздействий. Высев грамположительной флоры снижается к третьему этапу исследования (р<0,05). Высев грибов в динамике снижается благодаря антимикозной терапии. В динамике меняется и структура грамположительной флоры. На первом этапе доминирует высев стафилококков (р<0,05). На втором этапе высев стафилококков сохраняется, но высев стрептококков уменьшается (р>0,05). К третьему этапу преобладает стрептококковая флора. В целом у детей с ВАП, находящихся на лечении в ОРН, преобладает (р<0,01) высев стрептококков (рис. 3) .
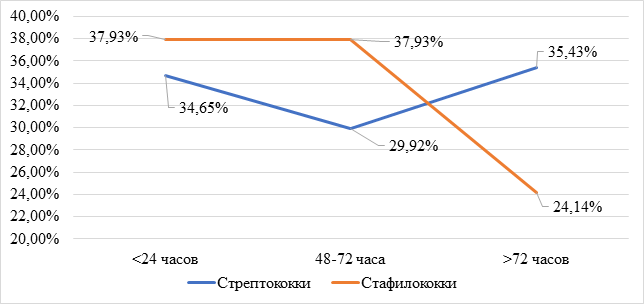
Рис. 3. Динамика структуры грамположительной флоры при ВАП у новорожденных детей
Изучение штаммового состава положительной микрофлоры выявляет полиморфизм штаммов и изменение их соотношений в динамике заболевания. Так, на первом этапе из стрептококков преобладает высев штамма Strepococcus viridans (р<0,01), реже – Strepococcus epidermidis. В динамике высев более патогенного штамма (Strep. Epidermidis) повышается в 2,5 раза (р<0,01), а Strepococcus viridans – снижается. Остальные штаммы стрептококков присутствовали в единичных случаях. Стафилококковая флора в основном представлена штаммом Staphylococcus aureus, который в динамике резко идет на спад (табл. 3).
Таблица 3
Динамика состава штаммов грамположительной микрофлоры
|
Время исследования |
<24 ч |
48–72 ч |
>72 ч |
Итого |
|
Стрептококки |
||||
|
Strepococcus epidermidis |
12 (21,42) |
19 (33,93%) |
25 (44,64%)** |
56 (100%) |
|
Strepococcus viridans |
29 (46,03%)** |
15 (23,81%) |
19 (30,16%) |
63 (100%) |
|
Strepococcus гр «А» |
3 (60%) |
2 (40%) |
0 (0%) |
5 (100%) |
|
Strepococcus pneumonia |
0 (0%) |
2 (66,67%) |
1 (33,33%) |
3 (100%) |
|
Стафилококки |
||||
|
Staphylococcus aureus |
11 (44%) |
7 (28%) |
7 (28%) |
25 (100%) |
|
Staphylococcus haemolyticus |
0 (0%) |
4 (100%) |
0 (0%) |
4 (100%) |
Примечание * – р <0,05; ** – р <0,01; *** – р <0,001
Грамотрицательная флора, которая занимает первое место в этиологической структуре ВАП, чрезвычайно полиморфна, но отмечается преобладание Pseudomonas aeroginosa, высев которой в динамике нарастает в 4 раза (с 9,6% до 64,96%, р<0,001). Как известно, она способна оказывать прямое повреждающее влияние на легочную ткань, что в определенной мере обусловливает ее высокие адгезивные свойства и тропность к эпителию трахеи и бронхов.
Второе место в этиологической структуре занимает Acinitobacter (р<0,001), высев которой в динамике заболевания увеличивается более чем в 2 раза (с 19,35% до 48,39%, р<0,01). Далее по частоте следуют Escherichia coli, высев которой в динамике нарастает (р<0,01), и Enterobacter cloacae (р<0,05), рост в динамике составляет 2 раза. Рост грамотрицательной флоры в динамике является неоспоримым свидетельством контаминационного генеза инфицирования больных в реанимационном отделении (табл. 4).
Таблица 4
Динамика структуры грамотрицательной флоры.
|
Выделенные микроорганизм |
<24 ч |
48–72 ч |
>72 ч |
Итого |
|
Pseudomonas aeroginosa |
9 (9,6%) |
23 (24,47%) |
62 (64,96%)*** |
94 (100%) |
|
Acinitobacter |
12 (19,35%) |
20 32,26%) |
30 (48,39%) ** |
62 (100%) |
|
Enterobacter cloacae |
3 (16,67%) |
5 (27,78%) |
10 (55,56%) |
18 (100%) |
|
Escherichia coli |
7 (18,91%) |
18 (48,65%) |
12 (32,43%) |
37 (100%) |
|
Enterobacter aerogenes |
4 (16%) |
15 (60%) |
6 (24%) |
25 (100%) |
|
Klepsiella Pneumonia |
6 (31,58%) |
8 (42,11%) |
5 (26,31%) |
19 (100%) |
|
Enterococcu |
0 (0%) |
3 (50%) |
3 (50%) |
6 (100%) |
Примечание * – р <0,05; ** – р <0,01; *** – р <0,001
Методом ИФА нами изучена значимость в этиологической структуре ВАП-флоры, типичной для перинатального периода. Это атипичные пневмопатогены: ЦМВ, ВПГ, микоплазмы и хламидии в виде моно- или микст-инфекций. Всего проведено 156 исследований. В основных группах с высокой степенью достоверности (р<0,001) выявлено преобладание микст-инфекций. В структуре микст-инфекций в подавляющем большинстве случаев отмечается сочетание ВПГ+ЦМВ, как у доношенных, так и у недоношенных детей, практически в равных соотношениях (81,48% и 84,21%, р>0,05). Остальные сочетания отмечаются в единичных случаях. Выявляются IgG и IgМ к ЦМВ, ВПГ. Однако IgМ к ЦМВ, свидетельствующий об остром инфицировании, в 2,5 раза чаще выявлен у больных ВАП недоношенных детей, а IgМ к ВПГ – у доношенных детей. Не выявлены Ig к хламидиям и микоплазмам (табл. 5).
Таблица 5
Данные ИФА к атипичным пневмотропным патогенам
|
Наименование |
Доношенные Кол-во, % |
Недоношенные Кол-во, % |
Итого Кол-во, % |
|
CMV IgG |
27 (56,25%) |
21 (43,75%) |
48 (100%) |
|
CMV IgМ |
4 (28,57%) |
10 (71,43%) *** |
14 (100%) |
|
HSV IgG |
26 (55,32%) |
21 (44,68%) |
47 (100%) |
|
HSV Ig М |
29 (78,38%)*** |
8 (21,62%) |
37 (100%) |
|
Chlamydia pneumonia Ig G |
1 (25,0%) |
3 (75,0%) |
4 (100%) |
|
Mycoplasma pneumonia Ig G |
5 (83,33%) |
1 (16,67%) |
6 (100%) |
|
Итого |
92 (58,97%) |
64 (41,03%) |
156 (100%) |
Выводы
1. В этиологической структуре ВАП у новорожденных детей основная роль принадлежит микробной флоре, типичной для ОРН. Выявлена зависимость этиологической структуры ВАП от длительности пребывания больных на ИВЛ. На начальном этапе высевается в равных соотношениях грамположительная и грамотрицательная микрофлора (р>0,05), в 3–4 раза реже высеваются грибы.
2. В динамике отмечается рост контаминационной грамотрицательной пневмопатогенной микрофлоры, в частности Pseudomonas aeroginosa, способной оказывать прямое повреждающее влияние на легочную ткань, высев которой в динамикенарастает в 4 раза (р<0,001). Меняется и структура грамположительной флоры. На первом этапе доминирует высев стафилококков (р<0,05), в частности Staphylococcus aureus, высев которого снижается в 3 раза к третьему этапу исследования. На втором этапе соотношение стафилококков и стрептококков выравнивается (р>0,05). К третьему этапу исследования в 2 раза нарастает высев стрептококков. К третьему этапу исследования наблюдается рост высева наиболее патогенного штамма Strepococcus epidermidis – в 2 раза.
3. В развитии ВАП значимы вирусные пневмопатогены, специфичные для перинатального периода. Выявлено повышенное содержание IgМ к ЦМВ и ВПГ, свидетельствующее об остром инфицировании. У доношенных детей IgМ к ВПГ выявлен в 3 раза чаще, чем у недоношенных детей, а IgМ к ЦМВ – в 2,5 раз чаще у недоношенных детей. Роль микоплазм и хламидий несущественна.



