Увеличение продолжительности жизни населения обусловливает рост частоты переломов проксимального отдела плечевой кости. Так, у пациентов старше 65 лет переломы проксимального отдела плечевой кости занимают третье место по частоте после переломов лучевой кости и шейки бедренной кости [1]. К возникновению дефекта проксимального отдела плечевой кости могут приводить различные последствия травм: несросшийся многооскольчатый перелом проксимального отдела плечевой кости, застарелые переломовывихи, ложные суставы хирургической шейки плечевой кости, несостоятельность остеосинтеза с аваскулярным некрозом головки плечевой кости [2].
Основным методом лечения последствий травматических повреждений с дефектом проксимального отдела плечевой кости является эндопротезирование. Поскольку такие повреждения включают тотальный дефицит ротаторной манжеты плеча, предпочтительным служит выбор реверсивной конструкции эндопротеза, позволяющей добиться улучшения функции плечевого сустава за счет изолированного действия дельтовидной мышцы [3, 4, 5].
Восстановление деформированной проксимальной части плечевой кости в застарелых случаях с помощью реверсивного эндопротеза является первично сложным эндопротезированием и часто требует применения передовых хирургических методов. Результаты эндопротезирования плечевого сустава при наличии дефекта проксимального отдела плечевой кости часто остаются неудовлетворительными, нередко возникают осложнения, которые могут потребовать повторной операции [6, 7]. Наряду с этим в доступной литературе нами не найдено описания каких-либо методик, направленных на снижение риска послеоперационных осложнений при лечении данной патологии.
Цель исследования – оценить результаты эндопротезирования плечевого сустава при тотальном дефекте проксимального отдела плечевой кости с помощью новой методики создания искусственной капсулы эндопротеза (ИКЭ).
Материал и методы исследования
Характеристика пациентов
Проведен анализ результатов лечения 58 пациентов (66 случаев), которым выполнялось эндопротезирование плечевого сустава в ФГБУ «Федеральный центр травматологии, ортопедии и эндопротезирования» Минздрава России (г. Чебоксары, Россия) с 2015 по 2020 гг. по поводу дефекта проксимального отдела плечевой кости (ДПОПК).
Средний возраст пациентов составил 61,6±12,4 года, из них 67,2% были женского пола. Срок давности травмы варьировал от 6 месяцев до 3,9 года. Характер проводившегося ранее лечения переломов ПОПК представлен в таблице 2.
Пациенты были поделены на две группы. В первую, опытную, группу исследования были включены 29 пациентов, которым, помимо установки эндопротеза, выполнялось формирование ИКЭ сустава (проспективный этап исследования). При этом в данную группу включены 8 пациентов из второй группы, которым выполнялось ревизионное эндопротезирование из-за возникших осложнений. Все вывихи в эндопротезе после операции произошли на сроках до 4 месяцев.
Во второй, контрольной, группе производилась ретроспективная оценка результатов эндопротезирования 37 пациентов с дефектом ПОПК, которым выполнялась только стандартная установка реверсивного эндопротеза по методике, описанной в рекомендациях фирмы-производителя. Распределение пациентов по нозологиям представлено в таблице 1.
Таблица 1
Распределение пациентов с дефектами проксимального отдела плечевой кости по нозологическим формам
|
Диагноз: |
Группа I (n=29) |
Группа II (n=37) |
Итого, N (%) |
|
Несросшийся многооскольчатый перелом |
10 |
21 |
31 (47%) |
|
Застарелый переломовывих |
7 |
8 |
15 (22,7%) |
|
Ложный сустав хирургической шейки плеча |
2 |
5 |
7 (10,6%) |
|
Послеоперационный дефект проксимального отдела |
2 |
3 |
5 (7,6%) |
|
Вывих в эндопротезе плечевого сустава |
8 |
– |
8 (12,1%) |
Таблица 2
Распределение пациентов по характеру лечения первичной травмы плечевого сустава
|
Диагноз |
Группа I (n=29) |
Группа II (n=37) |
Итого Итого, N (%) |
|
Гипсовая иммобилизация |
7 |
12 |
19 (28,8%) |
|
Накостный остеосинтез проксимального плеча |
4 |
8 |
12 (18,2%) |
|
Состояние после удаления металлофиксатора |
4 |
5 |
9 (13,6%) |
|
Остеосинтез спицами |
2 |
6 |
8 (12,1%) |
|
Реверсивное эндопротезирование плечевого сустава |
8 |
– |
8 (12,1%) |
|
Артротомия, удаление отломков |
2 |
3 |
5 (7,6%) |
|
Лечение не проводилось |
2 |
3 |
5 (7,6%) |
Хирургическое вмешательство
С учетом наличия признаков необратимого повреждения вращательной манжеты плеча, а также значительных разрушений костно-хрящевых структур плечевого сустава всем пациентам выполнялось тотальное эндопротезирование с использованием реверсивной конструкции эндопротеза. При этом во всех случаях лопаточный компонент имел бесцементную фиксацию, а плечевой компонент (ножка эндопротеза) фиксировался к плечевой кости посредством костного цемента. Для имплантации использовали эндопротезы трех фирм-производителей: Delta Xtend, DePuy, Франция; эндопротез плечевого сустава Anatomical Shoulder™ реверсивный ZIMMER, США; Affinis Inverse, Mathys, Швейцария.
Предпочтительным являлся стандартный дельтопекторальный доступ, который позволяет осуществлять вмешательство с минимальной травматизацией дельтовидной мышцы. Однако при наличии послеоперационного кожного рубца от предыдущих операций осуществляли доступ по старому рубцу с его иссечением.
У пациентов с последствиями переломов ПОПК, как правило, наблюдается выраженный рубцово-спаечный процесс. Поэтому предварительно производили обширную мобилизацию с иссечением фиброзной ткани. Создавали доступ в сустав, обнажали суставную поверхность лопатки при помощи ретракторов (рис. 1а). Оценивали состояния суставной площадки гленоида на предмет наличия дефектов или остеофитов. На поверхность гленоидальной впадины укладывали установочную пластину со смещением ее книзу. В ее центр вводили направляющий штифт на глубину 4 см. По штифту поверхность гленоидальной впадины обрабатывали фрезой, затем формировали отверстия для посадки лопаточного компонента эндопротеза (рис. 1б). Имплантировали лопаточный компонент, который фиксировали к лопаточной кости блокированными и неблокированными винтами. Производили имплантацию гленосферы (рис. 1в).
Далее выводили в рану проксимальный отдел плеча, риммировали костномозговой канал, обрабатывали рашпилями для посадки ножки эндопротеза. Производили тестовое вправление эндопротеза, проверку импланта на стабильность, отсутствие костных конфликтов. На костный цемент устанавливали плечевой компонент эндопротеза. Производили имплантацию вкладыша эндопротеза соответствующего размера, вправление плечевого компонента эндопротеза (рис. 1г). Производили контроль натяжения дельтовидной мышцы, отсутствия сублюксаций и тенденций к вывиху. Учитывая выраженную ретракцию подлопаточной мышцы, ее рефиксацию не осуществляли. Накладывали послойные швы для закрытия раны.
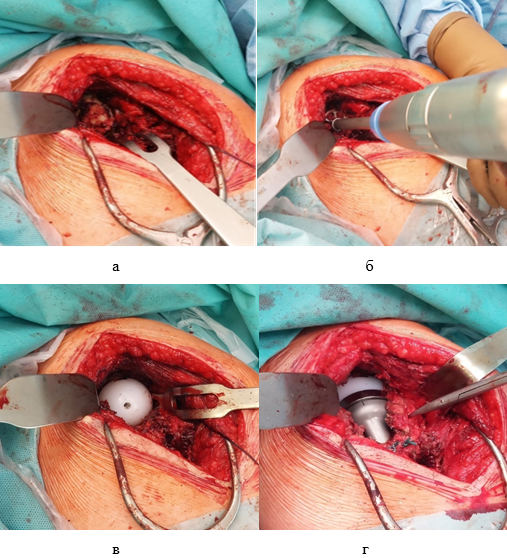
Рис. 1. Этапы имплантации реверсивного эндопротеза: а – обнажение суставной поверхности гленоида; б – обработка суставной поверхности лопатки; в – имплантация лопаточного компонента эндопротеза; г – имплантация и вправление плечевого компонента эндопротеза
У пациентов первой группы для дополнительной стабилизации реверсивного эндопротеза производили формирование искусственной капсулы сустава. Для этого использовали монофиламентную полипропиленовую сетку для реконструкции мягкотканых дефектов (Bard Mesh, США), при помощи которой формировали «футляр» вокруг эндопротеза.
После установки реверсивного эндопротеза производили моделирование капсулы сустава по индивидуальному размеру (рис. 2б), располагали сетку вокруг эндопротеза, фиксировали проксимально в области шейки суставного отростка лопатки посредством якорных фиксаторов и дистально, в области диафиза плечевой кости – при помощи нитей (рис. 2в). Результат представлен на до- и послеоперационных рентгенограммах (рис. 2а, 2г).
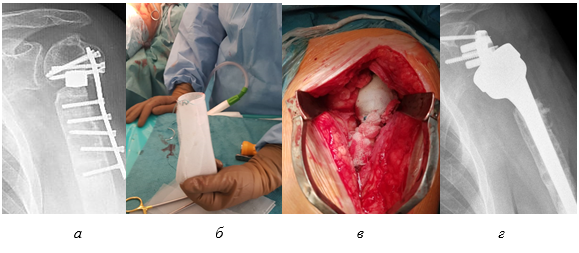
Рис. 2. Методика формирования искусственной капсулы эндопротеза: а – предоперационная рентгенограмма плечевого сустава; б – моделирование капсулы сустава из синтетической сетки; в – интраоперационный результат; г – постоперационная рентгенограмма
Оценка клинических результатов включала измерение углов отведения, сгибания и ротационных движений в плечевом суставе, измерение мышечной силы с заполнением стандартизированных шкал: 1) оценки плеча Калифорнийского университета в Лос-Анджелесе (UCLA, University of California, Los Angeles); 2) американских хирургов плечевого и локтевого суставов (ASES, American Shoulder аnd Elbow Surgeons Assessment). Для оценки болевого синдрома применяли визуально-аналоговую шкалу боли (ВАШ). Были проанализированы данные рентгенографии плечевого сустава в послеоперационном периоде у всех пациентов, где оценивалась стабильность эндопротеза.
Статистическая обработка результатов проводилась с помощью программного обеспечения GraphPad Prism и включала оценку частота развития вывиха в эндопротезе в послеоперационном периоде. В каждой группе данных рассчитывались среднее арифметическое (M) и среднеквадратическое отклонение (SD). Принадлежности выборок к нормальному распределению определялась при помощи критерия Колмогорова–Смирнова, при этом в большинстве групп распределение не соответствовало нормальному. Достоверность данных рассчитывалась с использованием непараметрического критерия Манна–Уитни. Для качественных признаков использовался критерий хи-квадрат (χ2). Значение p≤0,05 принималось как статистически значимое. Для выявления различий по частоте встречаемости признака в опытной и контрольной группах применялся точный критерий Фишера.
Результаты исследования и их обсуждение
Как видно из таблицы 2, по месту жительства наиболее часто выполнялось консервативное лечение, однако были нередки и попытки остеосинтеза. Проведенное оперативное лечение осложнилось развитием несращения переломов, аваскулярного некроза головки плечевой кости, что проявилось болевым синдромом и нарушением функции сустава, побудившими пациентов обратиться повторно.
Результаты лечения оценены у всех пациентов на среднем сроке 36,3±12,6 месяца. При ретроспективном анализе результатов лечения пациентов второй группы с дефектами ПОПК выявлено, что у 12 (32,4%) пациентов эндопротезирование осложнилось вывихами в эндопротезе на среднем сроке 3,3±2,9 недели после операции. Высокая частота вывихов после эндопротезирования у данной группы больных сопоставима с литературными данными. Пациенты с дефектами ПОПК, перенесшие эндопротезирование плечевого сустава, находятся в группе риска развития нестабильности в суставе, частота которого варьирует, по различным данным, от 16,7% до 34% [8, 9]. По данным Fernando SANTANA et al., общая частота осложнений после эндопротезирования у пациентов изучаемого профиля находится в пределах 20–41%, а количество ревизионных вмешательств достигает 9–28% [10].
Столь высокий процент осложнений обусловил поиск путей дополнительной стабилизации эндопротеза. Таким путем была разработана методика стабилизации реверсивного эндопротеза посредством формирования ИКЭ. Для проверки эффективности методики проведена сравнительная оценка результатов лечения 37 пациентов второй группы с 29 пациентами, пролеченными по разработанной методике (первая группа), которая представлена в таблице 3.
Осложнения после эндопротезирования при лечении пациентов с дефектами проксимального отдела плечевой кости
|
Вид осложнения |
Группа I (n=29) |
Группа II (n=37) |
|
Вывих в эндопротезе, N |
0 |
12 |
|
Ранние инфекционные осложнения, N |
1 |
1 |
|
Интраоперационный перелом диафиза, N |
1 |
– |
|
Сосудистые осложнения, N |
– |
1 |
|
Выход костного цемента в мягкие ткани плеча, N |
4 |
8 |
|
Резорбция нижнего края гленоида, N |
4 |
4 |
|
Всего, N |
10 |
26 |
Из таблицы 3 видно, что самым частым осложнением являлись вывихи в эндопротезе, причем в первой группе, где эндопротезирование сочеталось с формированием искусственной капсулы сустава, вывихов в эндопротезе после операции не наблюдалось. Данное наблюдение доказывает эффективность разработанной методики в плане снижения рисков развития вывихов после эндопротезирования у пациентов с дефектами ПОПК.
При проведении патентного поиска была найдена лишь одна методика, направленная на повышение стабильности эндопротеза. Для этого используют удлинение подлопаточной мышцы сухожилием длинной головки двуглавой мышцы плеча (RU 2654404 С1) [11]. Однако данный способ неэффективен при наличии дефекта ПОПК, так как отсутствует костная основа для реконструкции.
Общеизвестно, что стабильность плечевого компонента реверсивного эндопротеза относительно лопаточного в вертикальной плоскости обеспечивается за счет силы действия дельтовидной мышцы. Баланс сил ротаторов плеча обеспечивает стабильность плеча в горизонтальной плоскости. Наличие дефекта ПОПК сочетается с тотальным повреждением коротких ротаторов плеча, а также с отсутствием возможности для их реконструкции. Это приводит к нарушению стабильности плеча в горизонтальной плоскости и обусловливает высокий риск вывиха плечевого компонента эндопротеза, что и наблюдалось у пациентов второй группы.
В своем исследовании E.V. Cheung et al. также указывают на то, что пациенты с посттравматической патологией плечевого сустава, отсутствием проксимального отдела плечевой кости, тотальным повреждением вращательной манжеты плеча находятся в группе риска по нестабильности эндопротеза после операции [12].
Применяемая нами хирургическая тактика позволяет добиться дополнительной стабильности эндопротеза за счет формирования перипротезной капсулы.
Другим частым осложнением явился выход костного цемента в мягкие ткани плеча. Данное осложнение отмечалось у всех пациентов, которым ранее выполнялся накостный остеосинтез ПОПК без последующего удаления фиксирующей пластины. Интраоперационно на первом этапе производилось удаление накостной пластины, после чего в диафизе плечевой кости оставались отверстия от удаленных фиксирующих пластину винтов. После установки дистальной цементной пробки в диафиз плеча вводили костный цемент. Во время имплантации ножки эндопротеза излишки цемента под давлением выходили, в том числе и через отверстия в диафизе плечевой кости, в окружающие мягкие ткани.
Различия в частоте остальных видов осложнений между группами были статистически незначимыми. Таким образом, осложнения после эндопротезирования плечевого сустава разделялись на зависимые от выбранной методики операции (вывихи в эндопротезе) и независимые (все прочие).
Клинико-функциональные показатели в группах исследования до и после эндопротезирования плечевого сустава представлены в таблице 4. Следует отметить, что пациенты второй группы, у которых после операции произошел вывих в эндопротезе, были исключены из сравнения, так как оценка функции сустава в данных условиях некорректна. Результат их лечения оценен как неудовлетворительный.
Статистически значимых различий в клинико-функциональных показателях между группами до операции не выявлено. При поступлении все пациенты предъявляли жалобы на болевой синдром различной степени выраженности, дисфункцию травмированного плечевого сустава, трудности самообслуживания, ограничения в выполнении повседневных и трудовых обязанностей. У пациентов с дефектами ПОПК определялась гипермобильность в травмированном плечевом суставе при исследовании пассивной функции, активные движения резко ограничены. При осмотре кожных покровов пациентов, которым ранее выполнялись оперативные вмешательства, отмечались послеоперационные рубцы.
Проведенное хирургическое лечение (при отсутствии осложнений) позволило улучшить клинико-функциональные показатели у пациентов обеих групп исследования (табл. 4).
Таблица 4
Клинико-функциональные результаты до и после эндопротезирования плечевого сустава
|
Показатели |
Группы: I (n=29) II (n=25) |
До операции |
После операции |
p в группах до vs после операции |
||
|
M (SD) |
p* |
M (SD) |
p* |
|||
|
ВАШ, баллы |
I II |
5,7 (1,0) 5,1 (0,9) |
0,027 |
1,3 (0,9) 2,8 (1,5) |
0,0006 |
<0,0001 <0,0001 |
|
Сгибание, град.1 |
I II |
34,3 (13,3) 29,7 (11,5) |
ns |
94,5 (27,6) 93,0 (35,8) |
ns |
<0,0001 <0,0001 |
|
Отведение, град.1 |
I II |
25,5 (9,4) 21,3 (9,9) |
ns |
74,5 (21,1) 78,4 (36,1) |
ns |
<0,0001 <0,0001 |
|
Наружная ротация, град.1 |
I II |
3,1 (6,0) 1,4 (3,1) |
ns |
12,4 (13,3) 9,6 (12,1) |
ns |
0,0017 0,0007 |
|
UCLA, баллы1 |
I II |
8,7 (2,3) 8,7 (2,0) |
ns |
19,3 (3,8) 18,4 (5,5) |
ns |
<0,0001 <0,0001 |
|
ASES, баллы1 |
I II |
21,1 (6,2) 20,5 (3,9) |
ns |
50,1 (12,5) 50,5 (12,7) |
ns |
<0,0001 <0,0001 |
|
Удовлетворенность, %2 |
I II |
|
|
89,6 64,9 |
<0,05 |
|
*I группа по сравнению со II группой
1Данные представлены в виде M (SD); достоверность отличий оценивалась с помощью критерия U-критерия Манна–Уитни, значения p≤0,05 принимались как достоверные.
2Проценты
Однако достигнутые показатели в большинстве случаях не достигали показателей здорового сустава, что объясняется регионарной мышечной дисфункцией при дефекте ПОПК.
Как видно из таблицы 4, при сравнительной оценке послеоперационных результатов между двумя группами достоверных различий выявлено не было. Однако у пациентов первой группы удовлетворенность лечением была статистически значимо выше по сравнению с пациентами II группы, что объясняется меньшим количеством осложнений (р<0,05).
Таким образом, методика эндопротезирования с формированием искусственной капсулы сустава позволяет повысить стабильность в эндопротезе и снизить послеоперационную боль, однако не улучшает клинико-функциональные показатели в сравнении со стандартным эндопротезированием.
Заключение
Дефект проксимального отдела плечевой кости представляется неблагоприятным фактором в плане прогноза функционального восстановления после эндопротезирования. Наиболее частым осложнением эндопротезирования при наличии дефекта проксимального отдела плечевой кости являются вывихи в эндопротезе после операции (32,4%). Дополнительное формирование искусственной капсулы при эндопротезировании пациентов исследуемого профиля значительно снижает вероятность вывиха в эндопротезе после операции и уменьшает послеоперационную боль.



