Диффузная В-крупноклеточная лимфома (ДВКЛ) – самая распространенная неходжкинская лимфома (НХЛ) во всем мире, составляющая около 30–35% всех НХЛ. ДВКЛ чаще встречается у мужчин, средний возраст на момент постановки диагноза составляет около 70 лет.Однако этот тип лимфомы также может возникнуть у молодых людей и детей. В настоящее время в Европе и США ежегодно диагностируется 3,13 и 5,6 новых случаев на 100 000 жителей в год соответственно [1, 2]. Заболеваемость ДВКЛ обычно увеличивается с возрастом.Выявлено много факторов риска развития ДВКЛ, таких как: семейный анамнез гематологических злокачественных новообразований, аутоиммунные заболевания, ВИЧ и вирус гепатита С, высокий индекс массы тела в молодом возрасте, а также воздействие определенных лекарств или химикатов на рабочем месте и/или в окружающей среде [3, 4].
ДВКЛ – разнородная группа лимфом с различными клиническими, морфологическими, иммуногистохимическими и молекулярно-генетическими особенностями [5]. У 11–25% пациентов встречается поражение костного мозга (КМ) [6].
Диффузная В-крупноклеточная лимфома – это агрессивное заболевание, и для нелеченых пациентов средняя выживаемость обычно составляет менее 1 года [7]. Режим CHOP (циклофосфамид, доксорубицин, винкристин и преднизолон) использовался более 40 лет, а препарат Ритуксимаб (CD20-направленное моноклональное антитело) был одобрен Управлением по контролю за продуктами и лекарствами США (FDA) в 2006 г. для использования в качестве комбинированного лечения пациентов с ДВКЛ вместе со CHOP.После этого режим R-CHOP стал стандартом лечения пациентов с недавно диагностированной ДВКЛ [8]. Таким образом, применение в течение последних 20 лет режимов химиотерапии с высокими дозами в сочетании с Ритуксимабом значительно улучшило результаты лечения пациентов с ДВКЛ в более чем 50% случаев, даже на поздних стадиях [9, 10].Тем не менее около одной трети пациентов после лечения подвержены возникновению рефрактерных и рецидивных форм заболевания.Клинически остаточные опухолевые клетки, которые выживают после терапии, классифицируются как минимально-остаточное заболевание (МОБ). Методы, используемые для идентификации этих клеток, различаются в зависимости от доступности технологий и инвазивности клинической процедуры.При злокачественных гематологических заболеваниях костный мозг является наиболее изученной локализацией, где остаточные опухолевые клетки могут быть обнаружены с помощью минимально инвазивных методов.Следовательно, логично предположить, что резидентные стромальные клетки обеспечивают сигналы для опухолевых клеток, позволяя им выжить при цитотоксической терапии [11, 12]. Злокачественные опухоли и химиотерапия представляют собой своего рода стресс для костного мозга и, как и следовало ожидать, оказывают глубокое влияние на состав и функции стромальных клеток костного мозга [13].
В настоящее время происходят непрерывный поиск прогностических маркеров неблагоприятного течения злокачественных процессов и подбор современного противоопухолевого лечения [14].
Раннее распознавание пациентов с плохим прогнозом очень важно для изучения альтернативных стратегий лечения первой линии. В целях диагностики и прогноза эффективности терапии могут быть использованы цитоморфологический, иммунофенотипический и молекулярный анализы. Однако исходя из особенностей лимфом, включенных в группу ДВКЛ, и доступности клинической процедуры морфологическое исследование костного мозга с анализом миелограмм сохраняет свою диагностическую и прогностическую значимость.
Целью настоящего исследования является изучение состояния костномозгового кроветворения у больных диффузной В-крупноклеточной лимфомой при ее различном клиническом течении.
Материалы и методы исследования. В исследование включены 45 пациентов, проходивших обследование и лечение в отделении онкогематологии ФГБУ «НМИЦ онкологии» Минздрава России в период с 2016 по 2020 гг.
Критериями включения в исследование являлись: 1) морфологически подтвержденный диагноз диффузной В-крупноклеточной лимфомы; 2) возраст пациентов 18 лет и старше; 3) наличие подписанного пациентом информированного добровольного согласия.
Все больные в качестве первой линии терапии получали от 6 до 8 курсов полихимиотерапии по программе R-CHOP.
Ответ на лечение оценивали в соответствии с критериями Международной прогностической группы. В зависимости от ответа на проводимую специфическую терапию пациенты были распределены в 3 группы по 15 человек в каждой: I – пациенты, достигшие объективного ответа, т.е. в состоянии ремиссии, II – пациенты с рецидивом заболевания, III – пациенты с рефрактерной формой заболевания.
У 14 (31,1%) пациентов была установлена лейкемизация процесса: в I группе 1 больной, во II – 6, в III – 7.
Проведено комплексное обследование больных, в том числе морфологическое исследование костного мозга с анализом миелограмм (Bio Vision, Micros, Австрия) на этапах до и через 1 месяц после лечения, иммунофенотипирование (ИФТ) костного мозга методом многоцветной проточной цитофлюориметрии (Navios 10/3, Beckman Coulter, США) через 1 месяц после завершения лечения.
Результаты исследования и их обсуждение. По результатам анализа миелограмм пациентов до лечения данных о вовлечении костного мозга в патологический процесс не выявлено. Содержание лимфоцитов у всех пациентов не выходило за пределы референтного интервала.
После лечения данные морфологического исследования костного мозга пациентов I группы (ремиссия) свидетельствовали об отсутствии инфильтрации костного мозга лимфоидными и бластными элементами. Более того, в большей части наблюдений отмечалось восстановление кроветворной функции костного мозга.
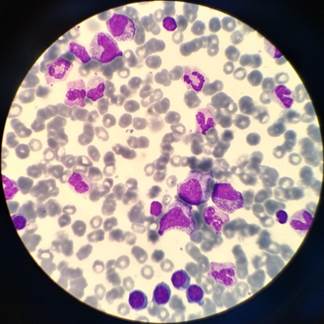 |
По данным миелограмм костномозговой пунктат был клеточным, полиморфным по составу. Гранулоцитарный росток кроветворения без выраженных патологических изменений: пролиферация и созревание клеток внутри нейтрофильного ряда не нарушены. Эритроидный росток сохранен с нормобластическим типом кроветворения. Лейко-эритробластическое соотношение нарушено незначительно. Мегакариоцитарный росток представлен, функционально активен. Содержание лимфоцитов не превышало верхний референтный интервал (рис. 1, табл. 1).
Рис. 1. Костный мозг. Ремиссия, ув. х1000
Результаты морфологического исследования костного мозга у пациентов I группы, на наш взгляд, свидетельствуют о положительном ответе на проведенную терапию и более благоприятном течении заболевания.
У пациентов II группы (рецидивы) костномозговой пунктат гипоклеточный, мономорфный со значительным увеличением количества лимфоцитов до 90%, опухолевая природа которых подтверждена при цитофлюориметрическом исследовании. Обнаружены бластные клетки до 4%. Гранулоцитарный и эритроидный ростки кроветворения редуцированы. Резко повышено лейко-эритробластическое соотношение. Количество мегакариоцитов снижено, однако встречались единичные функционально активные формы (рис. 2, табл. 1).
Таблица 1
Данные миелограмм больных ДВКЛ с различным клиническим течением
|
Показатель |
Результаты в разных группах больных (%) |
||||
|
Норма (%) |
I |
II |
III |
||
|
Бластные клетки |
0,1–1,1 |
|
3,4 |
20,0 |
|
|
Миелобласты |
0,2–1,0 |
0,2 |
|
|
|
|
Нейтрофилы |
промиелоциты |
1,0–4,1 |
0,8 |
|
|
|
миелоциты |
7,0–12,2 |
11,8 |
0,4 |
|
|
|
метамиелоциты |
8,0–15,0 |
8,8 |
|
2,0 |
|
|
палочкоядерные |
12,8–23,7 |
17,0 |
1,8 |
2,0 |
|
|
сегментоядерные |
13,1–24,1 |
27,8 |
0,6 |
2,0 |
|
|
Всего клеток нейтр. ряда |
52,7–68,9 |
66,2 |
2,8 |
6,0 |
|
|
Эозинофилы |
миелоциты |
0–1,0 |
0,2 |
|
|
|
метамиелоциты |
0–1,2 |
0,2 |
|
|
|
|
палочкоядерные |
0,1–1,2 |
|
|
|
|
|
сегментоядерные |
0,4–2,4 |
0,6 |
|
|
|
|
Всего клеток эозин. ряда |
0,5–5,8 |
1,0 |
|
|
|
|
Базофилы |
0,2–1,1 |
0,2 |
0,2 |
|
|
|
Моноциты |
0,7–3,1 |
4,0 |
0,2 |
3,0 |
|
|
Лимфоциты |
4,3–13,7 |
13,4 |
89,0 |
66,2 |
|
|
Плазматические клетки |
0,1–1,8 |
0,2 |
0,4 |
0,8 |
|
|
Ретикулярные клетки |
0,1–1,6 |
|
0,4 |
1,0 |
|
|
Мегакариоциты |
0,2–0,6 |
0,2 |
|
|
|
|
Эритробласты |
0,2–1,1 |
0,2 |
|
|
|
|
Пронормоциты |
0,1–1,2 |
1,0 |
0,2 |
|
|
|
Нормоциты |
базофильные |
1,4–4,6 |
1,4 |
0,6 |
|
|
полихроматофильные |
8,9–16,9 |
8,4 |
1,8 |
2,0 |
|
|
оксифильные |
0,8–5,6 |
3,6 |
1,0 |
1,0 |
|
|
Все клетки эритроидного ростка |
14,5–26,5 |
14,6 |
3,6 |
3,0 |
|
|
Индекс созревания |
эритрокариоцитов |
0,7–0,9 |
0,82 |
0,8 |
1,0 |
|
нейтрофилов |
0,5–0,9 |
0,48 |
0,2 |
0,5 |
|
|
Лейко-эритробластическое отношение |
2,1–4,5 |
5,8 |
26,8 |
32,3 |
|
|
Количество миелокариоцитов (тыс. в 1 мкл, х109/л) |
45,0–250,0 |
50,1 |
32,8 |
2,2 |
|
|
Количество мегакариоцитов (в 1 мкл, х106/л) |
50–150 |
20 |
20 |
не обн. |
|
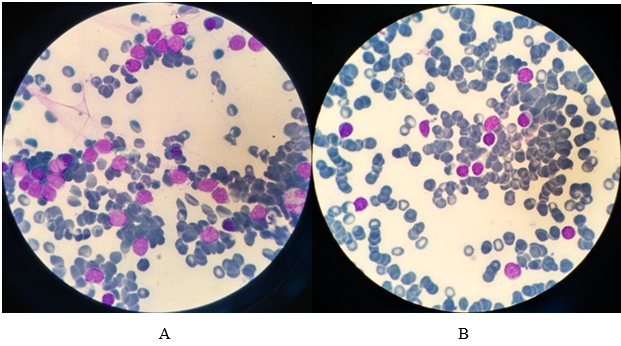
Рис. 2. Костный мозг. Рецидив заболевания. А – лимфоциты; В – лимфоциты и бластные клетки, ув. х1000
Изменения, выявленные при морфологическом исследовании костного мозга у пациентов III группы (с рефрактерной формой заболевания), имели направленность, аналогичную таковой во II группе (с рецидивом), только более выраженную. В большинстве наблюдений это проявлялось значительным, менее 10,0х109/л, снижением клеточности костного мозга за счет угнетения миелоидного и эритроидного ростков кроветворения, представленных единичными клеточными элементами. Мегакариоциты не обнаружены. Отмечались выраженная инфильтрация костного мозга атипичными лимфоцитами и увеличение количества бластных клеток до 30,0% и выше (рис. 3, табл. 1). Аберрантный иммунофенотип опухолевой популяции клеток был подтвержден результатами ИФТ-исследования.
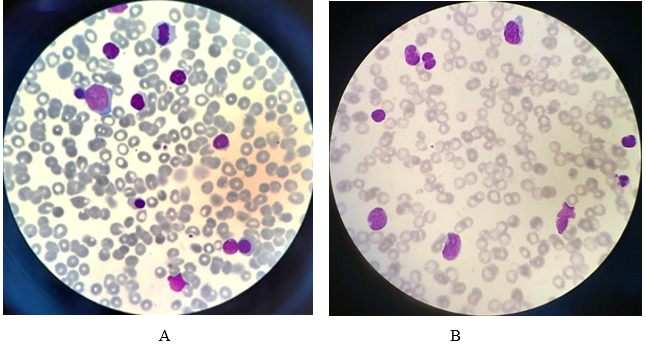
Рис. 3. Костный мозг. Рефрактерная форма. А – бластная клетка, лимфоциты; В – бластные клетки, атипичные лимфоциты, ув. х1000
Согласно полученным данным, более глубокие изменения в костном мозге отмечены у больных с рефрактерным течением диффузной В-крупноклеточной лимфомы.
Заключение. Описанные изменения в миелограмме, такие как: существенное снижение клеточности костного мозга, обусловленное угнетением миелоидного, эритроидного и мегакариоцитарного ростков кроветворения, а также выраженная инфильтрация костного мозга атипичными лимфоцитами и увеличение количества бластных клеток – отражают состояние костно-мозгового кроветворения в ответ на проведенную специфическую терапию и тяжесть течения заболевания. Морфологическое исследование состояния костномозгового кроветворения у пациентов с диффузной В-крупноклеточной лимфомой может быть полезно в оценке риска возникновения рецидивных и рефрактерных форм заболевания.



