Загрязнение окружающей среды многие годы является глобальной проблемой общества, актуальность которой в последние годы только возрастает. Из атмосферы соли тяжелых металлов проникают в организм человека через волосы, участки кожных покровов, слизистые, при дыхании и с пищей. Такие представители тяжелых металлов, как железо, медь, цинк, молибден, кобальт, в малых количествах являются микроэлементами, необходимыми для функционирования организма человека, и принимают участие в биологических процессах [1, 2]. В частности, кобальт является составной частью витамина В12, а также кофактором определенных ферментов и влияет на процессы образования форменных элементов крови, на метаболизм углеводов и липидов. Он участвует в синтезе некоторых аминокислот, имеет большое значение для нормального протекания биохимических процессов [3]. При этом соли тяжелых металлов способны накапливаться в тканях, оказывая токсическое влияние на организм человека, и могут вызывать мутации, аллергические реакции, образование активных форм кислорода (АФК), предполагают развитие онкопатологии [2]. Кобальт, являясь экотоксикантом, проникает в клетки внутренних органов и тканей человека и приводит к патологическим изменениям в сосудистой системе. В больших дозах он остротоксичен, и в тест-системах in vitro у млекопитающих ионы кобальта вызывают структурно-функциональные изменения клеток и апоптоз, а при максимальных концентрациях ‑ воспалительные реакции с последующим некрозом. Накапливается кобальт чаще всего в сердце, печени, почках, поджелудочной железе, и со временем его сравнительное содержание в скелетных мышцах, в скелете растет. Кобальт оказывает токсическое воздействие на клеточный генетический материал, реактивные формы кислорода вызывают окислительное повреждение ДНК, возможно, в сочетании с ингибированием процесса восстановления нативной структуры ДНК [4]. В результате окислительных реакций происходит процесс повреждения клеток организма, приводящий к активации окислительного стресса, при этом продукты метаболизма липопероксидации нарушают функцию эндотелия ‑ выработку оксида азота (NO) и, соответственно, уменьшение концентрации NО ‑ эндогенного релаксирующего фактора. Нарушение функции эндотелия может быть вызвано недостаточным количеством L-аргинина, а также присутствием эндогенных ингибиторов L-аргинина. Эта вероятность дает основание полагать, что поступление L-аргинина может привести к улучшению эндотелиальной функции. Данными исследований доказано, что L-аргинин благотворно действует на тонус кровеносных сосудов, который зависит от функциональной способности эндотелия. Оксид азота играет роль вторичного посредника, является мощной релаксирующей и противовоспалительной сигнализирующей молекулой, которая принимает участие в обеспечении сосудистого гомеостаза. NO, продуцируемый эндотелиальными клетками, служит критическим регулятором этого баланса, так что снижение способности вырабатывать оксид азота и чувствительности к нему проявляется как эндотелиальная дисфункция. Оксид азота вырабатывается эндотелиальными клетками за счет активности конститутивной синтазы оксида азота (cNOS). Клетки гладкой мускулатуры генерируют NO с помощью индуцибельной изоформы NOS (iNOS). NO регулирует тонус сосудов, различные механизмы, участвующие во взаимодействии клеток крови со стенкой сосудов, рост гладкомышечных клеток и синтез белков матрикса. Отсутствие эндотелий-зависимой вазодилататорной реакции было определено как эндотелиальная дисфункция, которая занимает центральное место во многих патофизиологических процессах. Основным фактором в процессе образования NO является окисление аминокислоты L-аргинина под влиянием фермента NO-синтазы с синтезом аминокислоты цитруллина (рис. 1).
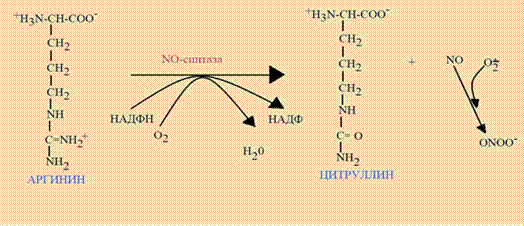
Рис. 1. Синтез оксида азота
Процесс сложен и катализируется NO-синтазой (NOS), кофакторами в реакции выступают НАДФН, тетрагидробиоптерин, ФАД и ФМН. NO, синтезированный из L-аргинина, может влиять на факторы ангиогенеза, проницаемость сосудов, рекрутирование периваскулярных клеток, ремоделирование и созревание сосудов. Кроме того, путь L-аргинин ‑ NO может активировать широкий спектр генов, которые функционально вовлечены в пролиферацию, метастазирование и апоптоз. Нарушение работы эндотелиальной NO-синтазы и, в свою очередь, снижение продукции NO можно рассматривать как дефицит ее важнейшего компонента — L-аргинина. Как известно, эту условно незаменимую аминокислоту организм получает в необходимом количестве; помимо этого, она непосредственно синтезируется в самом организме. «Метаболизм L-аргинина в клетках протекает двумя путями: посредством аргиназы гидролизуется в орнитин и мочевину; в NO и цитруллин катализируется NO-синтазой» [5]. Данными исследований установлено, что «ингибирование аргиназы способствует увеличению продукции NO и предотвращению дисфункциональных нарушений в эндотелии» [5]. «Повышение концентрации L-аргинина в эндотелиальных клетках сопровождается усиленным образованием промежуточного продукта метаболизма аргинина ‑ N-гидрокси-L-аргинина, облегчающего процесс окисления аргинина NO-синтазой, а также тормозящего активность аргиназы» [5]. Поскольку L-аргинин является основным субстратом синтеза NO, то представляется интересным вопрос о его влиянии на продукцию оксида азота.
Цель исследования ‑ в условиях модельного эксперимента с экспозицией хлорида кобальта исследовать действие L-аргинина на функцию эндотелия.
Материалы и методы исследования
Опыты на экспериментальных крысах выполнены в рамках плановой НИР и соответствовали «Правилам проведения работ с использованием экспериментальных животных» (Приложение к приказу МЗ СССР от 12 августа 1977 г. № 755). Объектом проведенного эксперимента были крысы-самцы линии Wistar (возрастная группа 10‑14 месяцев, масса 230‑260 г, n=75). В соответствии с поставленной целью они были распределены по группам:
1) интактные крысы ‑ контрольная группа (n=25);
2) животные, которым хлорид кобальта (CoCl2·6Н2О) вводили парентерально, доза 2 мг/кг веса животного (n=25);
3) животные, которым хлорид кобальта и L-аргинин (Ajinomoto, Япония) вводили внутримышечно в дозе 10 мг/кг (n=25).
Эксперимент продолжался 1 месяц, по окончании в гемолизате эритроцитов для оценки оксидативного стресса исследовали концентрацию малондиальдегида (МДА) по реакции с тиобарбитуровой кислотой, активность супероксиддисмутазы (СОД) ‑ методом измерения количества образующегося адренохрома. По завершении эксперимента в сыворотке крови подопытных животных определяли: каталазную активность методом М.И. Королюка, концентрацию медьсодержащего белка церулоплазмина ‑ методом Равина, уровень суммарных метаболитов NО (NОх) ‑ модифицированным скрининг-методом В.А. Метельской. При проведении исследований использовали цифровой спектрофотометр PD ‑ 303 («Apel Co., Ltd.», Япония).
Для обработки полученных в ходе исследования статистических данных применяли пакет программ Microsoft Excel. Для характеристики показателей вариационных рядов были использованы следующие характеристики: средняя величина (M), стандартная ошибка среднего (SEM). При проверке статистических гипотез уровень значимости (p) составлял менее 0,05. Проверку достоверности различий у сравниваемых показателей между двумя группами животных проводили, используя t-критерий Стьюдента.
Результаты исследования и их обсуждение
Для адекватного функционирования живого организма кобальт необходим как один из важных микроэлементов, он является составным элементом витамина В12, который в многочисленных химических реакциях выполняет функцию кофактора, но даже незначительное повышение его количества оказывает токсическое действие. Токсичность кобальта, прежде всего, определяется наличием неспаренного электрона на внешней орбитали атома, что позволяет реагировать с высокой скоростью с О2, а также с ПНЖК. Образующиеся при этом АФК инициируют окислительный процесс, и происходит угнетение АОС клеток. Экспериментально установлено, что у подопытных животных на фоне введения CoCl2 развился процесс липопероксидации, подтверждением чего явилось повышение концентрации вторичного продукта ПОЛ ‑ МДА ‑ в мембранах эритроцитов. На фоне липопероксидации происходило снижение активности СОД, вместе с тем активность каталазы, разлагающей перекись водорода на молекулу воды и кислород, и концентрация церулоплазмина повышались. «Разнонаправленные изменения активности ферментов АОС СОД и каталазы можно объяснить структурной особенностью молекул. В молекуле каталазы присутствует 4 группы гема, поэтому каталаза оказывается наиболее устойчивой к активным метаболитам кислорода» [6]. «В отличие от этого в структуре СОД имеются восприимчивые к модификации кислородными радикалами остатки таких аминокислот, как гистидин, аргинин и др.» [6].
Можно предположить, что «пероксид водорода в условиях токсического воздействия тяжелыми металлами вызывает частичную инактивацию СОД и снижение активности данного фермента» [6]. Так как тяжелые металлы гидрофобны, они легко всасываются в кровь и, циркулируя в ней, оказывают влияние на эндотелий сосудов. Установлено, что уровень стабильных метаболитов NO по сравнению с исходными данными статистически достоверно оказался ниже. АФК и метаболиты ПОЛ послужили причиной дисфункции эндотелия. В то же время индикаторами патологических нарушений эндотелиальной дисфункции явились повышение показателей концентрации МДА и снижение содержания суммарных метаболитов NO (рис. 2).
Для коррекции выявленных нарушений в системе ПОЛ ‑ АОС и метаболизма NО как показателей эндотелиальной дисфункции экспериментальным животным вводили L-аргинин. В ходе эксперимента установлено, что у подопытных животных в группе 3 с экспозицией хлорида кобальта после введения L-аргинина активность СОД в эритроцитах повысилась, в то время как данные активности каталазы и концентрации ЦП в сыворотке крови понизились, причем в сравнении с контролем активность каталазы осталась все еще повышенной (рис. 2).
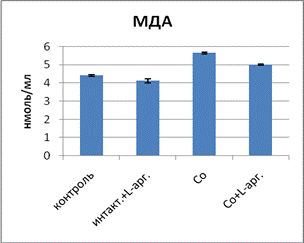
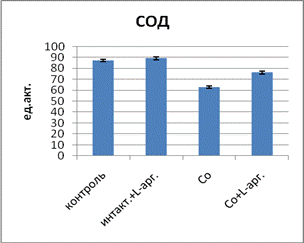
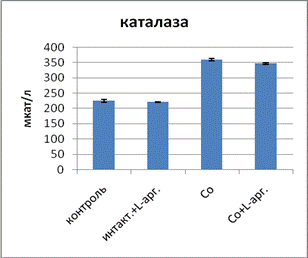
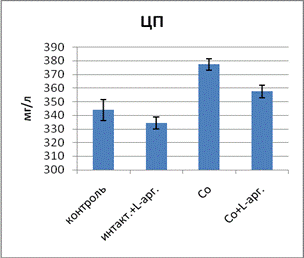
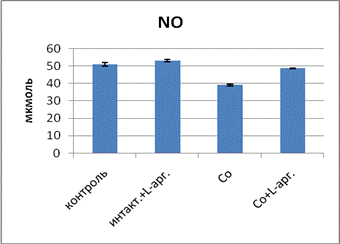
Рис. 2. Влияние L-аргинина на активность ферментов АОС при экспозиции хлорида кобальта
Принимая во внимание, что L-аргинин является предшественником синтеза NO, мы изучили его влияние на колебания концентрации оксида азота. Данные показали, что при применении L-аргинина увеличилась концентрация стабильных метаболитов NO. Эти данные подтверждают исследования ученых [7], что супероксидный анион может не только тормозить экспрессию и активность eNOS, но также связывать и инактивировать NO, превращая его в пероксинитрит. Как отмечают некоторые авторы, в электрон-транспортной цепи присутствует повышенное образование супероксидного радикала, приводящее к дисбалансу в АОС [8, 9], что в дальнейшем вызывает дисфункцию эндотелия сосудов при кобальтовой интоксикации [10]. Наши данные, полученные в ходе модельного эксперимента, наглядно показали, что используемый препарат L-аргинин оказал позитивное влияние на состояние функции эндотелия и таким путем повысил продукцию NO, воздействие которого на клеточные структуры сосудистой стенки, играющие роль в регуляции просвета кровеносных сосудов, осуществляется посредством активации циклического гуанозинмонофосфата, что способствует расслаблению мускулатуры. Следовательно, L-аргинин приводит к увеличению концентрации стабильных метаболитов NO, вместе с тем улучшает циркуляцию крови в тканях и органах. Таким образом, применение L-аргинина оказалось результативным в том плане, что выявлены положительные изменения биохимических показателей, оказывающих существенное влияние на функцию эндотелия. Полученные нами данные продемонстрировали доказательные результаты, подтверждающие внутримембранные изменения внутренних органов на фоне интоксикационного синдрома, а также показана роль систем ПОЛ ‑ АОС, NO-продуцирующей функции в развитии системных и органных нарушений.
Заключение
Результаты исследования показали, что при интоксикации хлоридом кобальта происходят интенсификация общепатологического процесса ПОЛ, образование АФК и метаболитов переокисления липидов, которые, в свою очередь, приводят к повышению концентрации МДА и понижению ферментативной активности СОД в эритроцитах, а в сыворотке крови ‑ к понижению содержания каталазы и концентрации ЦП. Варьирование этих показателей является свидетельством развития дисфункции эндотелия. Выявленное снижение концентрации NO свидетельствует о нарушении NO-продуцирующей функции и вазодилатации. Корригирующая терапия сосудистых осложнений и метаболизма NO на фоне интоксикационного синдрома, вызванного хлоридом кобальта с применением L-аргинина ‑ предшественника оксида азота, ингибирует интенсивность липопероксидации в эритроцитах, что обусловливает нарастание в крови активности ферментов антиоксидантной защиты клеток, в частности СОД, и уровня стабильных метаболитов NO. Таким образом, происходит устранение рассогласования в системе ПОЛ ‑ АОС и L-аргинин положительно влияет на способность эндотелия сосудов продуцировать NO. Такой методологический подход можно использовать для профилактики и коррекции нарушений в условиях действия тяжелых металлов, особенно для людей, работающих во вредных цехах металлургических заводов.



