Хронический лимфолейкоз (ХЛЛ) – один из наиболее часто встречаемых нозологических вариантов лейкозов, «золотым стандартом» лечения которого является применение специфической противоопухолевой терапии [1, 2]. Однако использование цитостатиков в каждой последующей линии противоопухолевой терапии ассоциировано с накоплением мутаций (таких как мутация гена ТР53, делеция локуса хромосомы 17р13, ряд точечных мутаций), что неизбежно приводит к очередной клональной индукции и формированию химиорезистентного варианта течения заболевания [3]. В связи с этим основной целью лечения ХЛЛ является достижение полной ремиссии (ПР) и длительной общей безрецидивной выживаемости (БРВ). Однако даже при достижении ПР в организме может остаться популяция опухолевых клеток, что принято называть термином «минимальная остаточная болезнь» (МОБ) [4].
Наличие у пациента во время лечения или после его завершения МОБ является основной причиной рецидивирования любой злокачественной опухоли, в частности лимфомы [5]. Международная рабочая группа по изучению ХЛЛ (IWCLL) в 2008 г. предложила определять МОБ как состояние организма, при котором опухолевые клетки выявляются в соотношении 1 и более к 10 000 нормальных клеток при достижении полной ремиссии по данным инструментальных методов исследования [6].
Таким образом, несмотря на многообразие активно развивающейся высокоэффективной фармацевтической продукции, у превалирующей массы больных, у которых удалось достичь ПР, развивается рецидив заболевания, а ХЛЛ продолжает считаться неизлечимой патологией. В связи с этим изучение уровня МОБ на разных этапах течения болезни представляется опорным критерием для определения дальнейшей тактики лечения и изучения новых подходов в лечении [7].
Оценка уровня МОБ у больных ХЛЛ в настоящее время в клинической практике активно используется как надежный прогностический маркер продолжительности ответа на специфическое противоопухолевое лечение и в качестве критерия оценки общей выживаемости [8]. Оценка иммунофенотипических показателей при определении МОБ, таких как увеличение экспрессии антигена CD25 на В-клетках, с высокой долей вероятности может свидетельствовать о развитии рефрактерности к проводимому режиму терапии и прогнозах низкого качества ремиссии заболевания [9].
Области применения параметров, отражающих количественное отношение опухолевых клеток к нормальным лимфоцитам, пропорционально накапливаемым знаниям неуклонно растут. С целью создания в перспективе прогностических алгоритмов ведения больных необходим ряд исследований, конкретизирующих диагностические возможности количественного определения опухолевых клеток у больных ХЛЛ.
Цели исследования: оценить взаимосвязь между количественным отношением опухолевых В-лимфоцитов к нормальным лимфоцитам и длительностью безрецидивной выживаемости, а также распространенностью поражения лимфатической системы у больных ХЛЛ перед началом химиотерапевтического лечения и при первом рецидиве заболевания.
Материал и методы исследования. Ретроспективно проанализировано 19 клинических случаев больных ХЛЛ, получавших противоопухолевую лекарственную терапию в условиях отделения онкогематологии ФГБУ «Национальный медицинский исследовательский центр онкологии» с 2014 по 2021 гг. Средний возраст больных на момент выявления основного заболевания составил 60,7±1,9 года, что несколько ниже возрастной медианы в европейских странах. Соотношение мужчин и женщин в выборке 47,4% к 52,6% соответственно. Согласно клиническим рекомендациям, всем больным проводили 4–6 курсов противоопухолевой лекарственной терапии в режиме RB (Ритуксимаб 1 цикл – 375 мг/м2 в/в кап., день 1, последующие циклы – 500 мг/м2 в/в кап., день 1; Бендамустин 90 мг/м2 в/в кап., дни 1, 2) или FCR (Ритуксимаб 1 цикл – 375 мг/м2 в/в кап., день 1, последующие циклы – 500 мг/м2 в/в кап., день 1; Флударабин 25 мг/м2 в/в кап., дни 1-3; Циклофосфамид 250 мг/м2 в/в кап., дни 1–3). Перед началом лечения и при выявлении рецидива всем пациентам выполняли СРКТ органов шеи, грудной клетки, брюшной полости и малого таза с целью оценки распространенности опухолевого процесса, а также производили пункцию костного мозга с последующим его иммунофенотипированием.
Иммунофенотипирование костного мозга выполняли методом многоцветной проточной цитофлюориметрии (Navios 10/3, Beckman Coulter, США). Исследуемая панель включала моноклональные антитела: CD45, CD19, CD20, CD22, CD23, CD43, CD200, CD5, CD3, CD4, CD8, CD56, CD38, kappa, lambda. Экспрессия В-линейно ассоциированных антигенов оценивалась в гейте СD19-позитивных клеток. В-клеточная клональность устанавливалась обнаружением рестрикции легких цепей поверхностных иммуноглобулинов (каппа или лямбда). Количество клеток, экспрессирующих маркеры, определялось в процентах [10, 11].
Подсчет динамики объема поражения лимфатической системы от момента перед началом лечения и до времени развития первого рецидива в процентном соотношении (Vприроста) осуществляли по формуле: Vприроста = ((V1–V2)*100%)/V1, где V1 – объем поражения лимфатической системы перед началом лечения, V2 – объем поражения лимфатической системы на момент появления первого рецидива, при этом V = группа увеличенных лимфоузлов 1 (произведение двух размеров измерений лимфоузлов в мм) + группа увеличенных лимфоузлов 2 (произведение двух размеров измерений лимфоузлов в мм) + группа увеличенных лимфоузлов n (произведение двух размеров измерений лимфоузлов в мм).
Поиск наличия взаимосвязи между объемом поражения лимфатической системы и количественным отношением опухолевых В-лимфоцитов к нормальным лимфоцитам производили при помощи подсчета коэффициента корреляции Пирсона (Rxy) с использованием пакета описательной статистики MS Excel (2016). Интерпретация значений Rxy осуществлялась по общепринятой шкале Чеддока.
Результаты исследования и их обсуждение. На первом этапе нами была произведена оценка возможности прогнозирования длительности БВ на основе измерения первичного количества опухолевых клеток (перед началом противоопухолевого лечения). Средняя длительность БРВ у больных, вошедших в исследование, составила 33,2±4,7 месяца (минимальное время до рецидива составило 8 месяцев, максимальное – 96 месяцев). При оценке тесноты взаимосвязи первично выявленного отношения опухолевых В-лимфоцитов к нормальным лимфоцитам и длительности БРВ Rxy составил –0,09 (рис. 1).
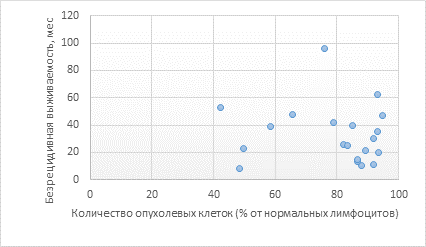
Рис. 1. Зависимость длительности БРВ, мес. (ось ординат), от количества опухолевых В-лимфоцитов, % от нормальных лимфоцитов (ось абсцисс)
Полученные результаты, представленные на рисунке 1, иллюстрируют отсутствие взаимосвязи между двумя сравниваемыми величинами, иначе говоря, измерение количества опухолевых В-лимфоцитов в костном мозге перед началом специфического лечения, к сожалению, не позволяет построить прогностической модели длительности БРВ у больных ХЛЛ после первой линии противоопухолевой терапии.
На втором этапе исследования производили изучение взаимосвязи между объемом поражения лимфатической системы и количественным отношением опухолевых В-лимфоцитов к нормальным лимфоцитам при первом рецидиве. По результатам подсчета у 12 (68,4%) больных объем поражения лимфатической системы при рецидиве был выше, чем перед началом лечения, при этом процент опухолевых В-лимфоцитов заметно превалировал над таковым у остальных 6 (31,6%) больных. В связи с этим целесообразно стратифицировать данных больных на 2 группы исследования. Итак, группу I составили больные с положительным приростом объема поражения лимфатической системы, средний процент прироста составил 107,5±24,9%; группу II составили больные с отрицательным процентом прироста, средний процент убыли составил –21,2±6,7%.
В группе I между объемом поражения лимфатической ткани и количественным отношением опухолевых В-лимфоцитов к нормальным лимфоцитам тесной взаимосвязи не выявлено, Rxy составил 0,25. В группе II при аналогичном исследовании прослеживается заметная теснота корреляционной связи (Rxy составил 0,65), что, вероятно, связано с меньшим числом наблюдений в выборке.
При более детальном анализе при сравнении Vприроста объема лимфатической ткани (%) с количественным отношением опухолевых клеток к нормальным лимфоцитам при рецидиве в группе I выявлена сильная корреляционная взаимосвязь, Rxy равен 0,73 (рис. 2).
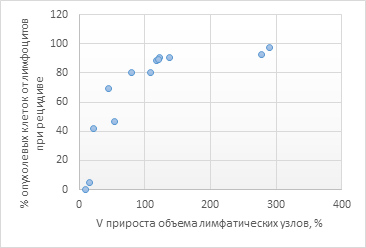
Рис. 2. Зависимость Vприроста объема лимфатических узлов, % (ось абсцисс) от уровня опухолевых В-лимфоцитов (% от нормальных лимфоцитов) при первом рецидиве (ось ординат) в группе I
Согласно полученным данным, представленным на рисунке 2, разница между исходным объемом поражения лимфатических узлов и объемом поражения лимфатических узлов при первом рецидиве (между V1 и V2) была более выражена у больных, у которых при первом рецидиве процентное соотношение опухолевых В-лимфоцитов к нормальным лимфоцитам было выше.
При сравнении Vприроста объема лимфатической ткани (%) с количественным отношением опухолевых В-лимфоцитов к нормальным лимфоцитам в группе II выявлена заметная взаимосвязь по шкале Чеддока, Rxy равен 0,53 (рис. 3).
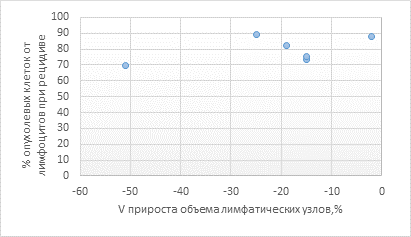
Рис. 3. Зависимость Vприроста объема лимфатических узлов, % (ось абсцисс) от уровня опухолевых В-лимфоцитов (% от нормальных лимфоцитов) при первом рецидиве (ось ординат) в группе II
Таким образом, в нашем исследовании была установлена тесная взаимосвязь между количественным отношением опухолевых В-лимфоцитов к нормальным лимфоцитам, полученным при первом рецидиве, и динамическим показателем прироста объема опухолевого поражения (Vприроста). Возможность практического применения полученных результатов требует дополнительных исследований, тем более что о динамических изменениях объема опухолевого поражения при рецидиве с наибольшей точностью могут сказать инструментальные методы визуализации, входящие в перечень обязательного обследования больных [12].
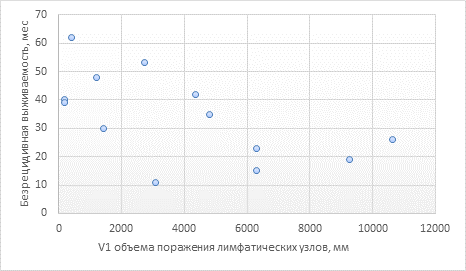
Рис. 4. Зависимость V1 объема поражения лимфатических узлов, мм (ось абсцисс) от длительности ПР, мес. (ось ординат) в группе I
На третьем этапе исследования с целью поиска прогностических маркеров длительности БРВ изучили взаимосвязь между V1 (объемом поражения лимфатической ткани до начала лечения) и временем до первого рецидива в обеих группах. Так, в группе I Rxy составил –0,59, что говорило о наличии заметной по шкале Чеддока обратной зависимости.
Следовательно, чем выше объем поражения лимфатической ткани у больного перед началом лечения, тем короче была БРВ. В группе II взаимосвязь между V1 и длительностью БРВ была умеренной: Rxy составил –0,39. Подобные межгрупповые объяснимы принципом распределения групп по приросту/убыли объема поражения лимфатической системы, при этом среднее значение V1 в группе I (3912±952 мм) было в 3,6 раза ниже, чем в группе II (13925±4032 мм). Иными словами, у большинства больных группы I, несмотря на значительный прирост опухолевого объема ко времени развития первого рецидива, исходно наблюдался меньший объем поражения лимфатической ткани, в отличие от больных группы II. В то же время при сравнении V1 и длительности БРВ у больных обеих групп выявлена умеренная отрицательная взаимосвязь (Rxy= –0,41). Полученные результаты демонстрируют, что исходный объем опухолевого поражения в умеренной степени определяет дальнейшее течение заболевания и данный параметр; при условии выявления остальных формирующих прогноз факторов может быть рекомендован для построения прогностического алгоритма длительности БРВ.
Заключение. Длительность БРВ не зависит от количественного отношения опухолевых В-лимфоцитов к нормальным лимфоцитам, установленного перед началом лечения больных ХЛЛ. В то же время прослеживается заметный уровень зависимости показателей прироста поражения лимфатической ткани от количественного отношения опухолевых В-лимфоцитов к нормальным лимфоцитам, определяемым к моменту первого рецидива. Представляется значимым для клинической практики наличие умеренной зависимости, установленной между исходным объемом поражения лимфатической ткани и длительностью БРВ у больных ХЛЛ в ходе настоящего исследования.



