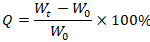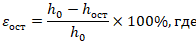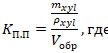Проблема правильно подобранной гемостатической терапии ‑ одна из наиболее актуальных в современной медицине. Особенно остро она прослеживается в различных областях клинической медицины, в первую очередь в абдоминальной хирургии. В связи с этим возникает потребность в разработке новых гемостатических имплантов и методик оценки эффективности их свойств в зависимости от интраоперационной ситуации [1].
Ежегодно проводится много операций на органах печени, и с каждым годом их количество растет, этому способствует рост онкологии печени. Холецистэктомии занимают третье место среди всех операций на органах брюшной полости, и т.д. Установлено, что при различных травмах печени хирург тратит до 85% времени на остановку кровотечения. Применение аппликационных средств в хирургии является бесшовной, мини-инвазивной и перспективной технологией [2, 3].
Анализ литературных данных показал, что в настоящее время существует множество средств местной остановки кровотечения. Но, несмотря на наличие большого количества кровоостанавливающих губок на основе производных целлюлозы, альгинатов, коллагена, хитозана и других вспомогательных веществ, а также клиническую демонстрацию их эффективности и необходимости использования, большинство этих средств не в полной мере отвечают требованиям эффективности и безопасности, что обусловливает необходимость их дальнейшего исследования и доработки [1, 4]. По этой причине поиск идеальной основы для создания универсальной медицинской губки все еще продолжается.
При необходимости внедрения инородных тел в организм человека, будь то шовный материал, эндопротез, гемостатические губки и иное, основными критериями являются максимальная приближенность импланта по физико-механическим свойствам к тканям человека, а также его анатомическая и физиологическая доступность. Следовательно, спустя определенный промежуток времени после имплантации исследуемого образца его физико-механические свойства должны приближаться к свойствам тканей в месте внедрения. Исходя из того, какими свойствами обладает образец, в конечном итоге к нему формулируется перечень требований [3, 5].
В.И. Петлах выделяет следующие требования к местным гемостатическим средствам:
обеспечение в минимальный срок полного прекращения капиллярного и паренхиматозного кровотечения; высокая адгезивность; предотвращение возобновления кровотечения; отсутствие раздражающего действия на окружающие ткани; нетоксичность; отсутствие влияния на функцию гемостаза в кровотоке; удобство в применении, легкое снятие [6].
Контент-анализ литературных источников показал, что имеющиеся сегодня на рынке местные гемостатические губчатые средства не в полной мере удовлетворяют этим критериям. В связи с этим возникает потребность в разработке местного губчатого кровоостанавливающего средства, наиболее соответствующего идеальным требованиям. Для этой цели необходимо использовать алгоритм различных методов исследования их свойств.
Цель исследования: изучить и систематизировать описанные в современной литературе методы исследования кровоостанавливающих имплантов в условиях эксперимента in vitro.
Материалы и методы исследования
В процессе исследования любого аппликационного гемостатического средства первостепенной задачей является определение эффективности и безопасности применения испытуемого образца. Для этого необходимо понимание того, насколько использование исследуемого импланта достигает цели остановки кровотечения, говоря иначе ‑ какой объем крови способен сорбировать образец и какова скорость остановки кровотечения. В основе этих эффектов лежит большое количество физико-механических свойств. Так, например, процесс формирования сгустка, тканевых и сосудистых реакций довольно сложен и имеет комплексный характер. Таким образом, если влиять интегрально на определенные звенья гемостаза, можно получать более эффективные показатели остановки кровотечения. По этой причине для выбора методов исследования физико-механических свойств кровоостанавливающих имплантов необходимо знать, что является точкой приложения их кровоостанавливающего действия: вещество, входящее в состав, оптимальная пористость, сорбционные свойства или адгезивность и т.д. [4, 7]. Существующие на рынке аппликационные гемостатические материалы ‑ достаточно широкий спектр изделий медицинского назначения, которые классифицируются по различным критериям, включая механизм действия, материал изготовления, форма выпуска и т.д. (рисунок) [8‑11].
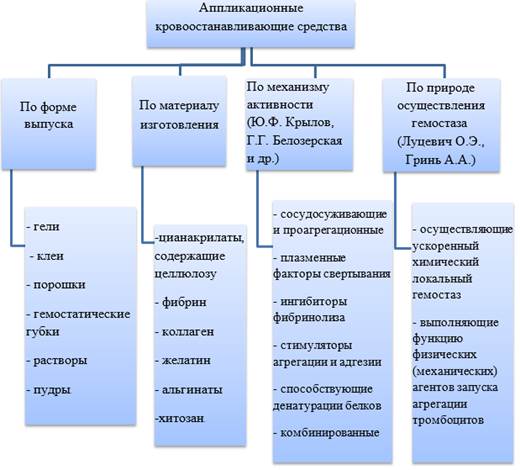
Классификация аппликационных кровоостанавливающих средств
Анализ литературы показал, что описание местных кровоостанавливающих средств чаще всего проводится не по механизму действия, а по принадлежности к группе продукта (материалу изготовления) [12]. В данной статье мы будем отталкиваться от классификации по принципу материала изготовления, так как выбор метода исследования и алгоритм действий могут зависеть от физико-механических и химических свойств основного материала, из которого изготовлен гемостатик. К примеру, коллаген имеет гидрофобные свойства и не растворяется в воде, а губки на основе карбоксиметилцеллюлозы, обладающие гидрофильными свойствами, в этих условиях будут деградировать [13]. При исследовании их сорбционной способности и пористости необходимо использовать среды, в которых они не будут деградировать и терять своих свойств. Так, для импланта на основе коллагена в качестве абсорбируемой жидкости можно применять дистиллированную воду, в то время как для содержащих целлюлозу образцов это недопустимо ввиду потери их структуры. Для исследования свойств гидрофильных веществ необходимо использовать среды, исключающие их растворение, например циклические ароматические углеводороды. Это необходимо учитывать при проведении исследований физико-механических свойств кровоостанавливающих имплантов по традиционным методам исследования (таблица) [13‑ 17].
Методы исследования физико-механических свойств кровоостанавливающих имплантов
|
Физико-механические свойства |
Метод исследования |
|
Сорбционная способность |
Измерить сухой вес образца ( W0 ) объемом 1 см3. Сухой образец погрузить в деионизованную воду при 37°C. Инкубировать в течение 10 мин для достижения им насыщенного водопоглощения. Извлечь образец и осторожно перенести на фильтровальную бумагу для удаления избытка воды с поверхности. Измеритьвлажную массу образца (Wt). Сорбционную способность (Q) рассчитать по формуле:
|
|
Плотность |
Плотность губок рассчитывается по отношению веса лиофилизированного гидрогеля к его объему. Измерение плотности проводится с использованием образцов объемом 1 см³, а конечные плотности получают из среднего значения для трех образцов |
|
Морфология поверхности образцов |
Морфология поверхности губок исследуется с помощью сканирующего электронного микроскопа (СЭМ) после покрытия образцов тонким слоем золота в вакууме при 15 кВ |
|
Остаточная деформация при полном сжатии |
Измерить толщину образцов размером 20х20 мм. Установить образец на стеклянную подложку поднимающейся траверсы разрывного электромеханического стенда. В режиме сжатия со скоростью 2 мм/мин сжать образец с усилием 100 Н. Зафиксировать на 5 мин. Провести повторные замеры толщины исследуемых имплантов сразу после снятия нагрузки и спустя 5 и 30 мин. Остаточную деформацию при полном сжатии определить по формуле для каждого измерения:
ɛост ‑ остаточная деформация сжатия; h0 ‑ толщина образца до сжатия; hост ‑ толщина образца после сжатия |
|
Полная пористость |
Измерить массу специально подготовленной пробирки (на дне пробирки выложить слой металлической стружки на менее 3 см, сверху поместить диск фильтровальной бумаги, вырезанный по сечению пробирки). Измерить массу исследуемого образца объемом 1 см3. Выдержать образец 2 мин в ортоксилоле. Переместить образец в подготовленную пробирку на фильтровальную бумагу. Центрифугировать с ускорением 1500 g в течение 5 мин. Извлечь образец и бумагу из пробирки. Снять образец с фильтровальной бумаги. Вернуть фильтровальную бумагу в пробирку и взвесить. Разницу массы пробирки до помещения образца и после центрифугирования считать массой выделившегося из пор ортоксилола. Коэффициент полной пористости рассчитывать по формуле:
KП.П. ‑ коэффициент полной пористости; mxyl ‑ масса выделившегося из пор ортоксилола; ρxyl ‑ плотность ортоксилола; Vобр ‑ объем образца |
|
Темпы деградации |
Оценить стабильность биоразлагаемого материала путем измерения необходимого времени для полной растворимости образцов губки (1 см³), погрузив их в воду с фосфатным буфером (10 мл, pH 7,4) на 24 ч. Исследование проводить при двух условиях: при комнатной температуре (25±3ºC) и в камере инкубатора (37ºC) с параллельной видеофиксацией в режиме таймлапс и последующим сравнением времени полной деградации |
|
Кислотность |
Определить уровень pH в образцах объемом 1 см3, поместив в дистиллированную воду на 10 секунд. Извлечь образцы и поместить на дно чашек Петри. Получить водную вытяжку из образцов спустя 10 мин. Измерить кислотность полученной вытяжки универсальной индикаторной бумагой с помощью эталонной шкалы pH |
Исследуя физико-механические свойства и эффективность кровоостанавливающих губчатых имплантов, необходимо учитывать, что при оперативных вмешательствах на различных органах они будут отличаться, а также зависеть от характера нанесенной травмы. Общепризнано, что более наглядной моделью кровотечения является кровотечение из паренхиматозных органов, а для того, чтобы исследовать гемостатическую активность кровоостанавливающих губчатых средств в остром периоде при различных паренхиматозно-капиллярных кровотечениях, существует несколько различных моделей формирования раны органов (например, долевая резекция печени, когда край органа выводится в операционную рану и иссекается участок определенного размера [17, 18]). Также возможно нанесение колотой раны печени на определенную глубину с последующим разведением бранши инструмента. В некоторых исследованиях предлагается методика моделирования рваной раны печени, когда в качестве травмирующего агента используется зажим с зубцами [19].
Однако для стандартизации показателей гемостатической эффективности гемостатических имплантов необходима доработка методики. По данным годовых отчетов Министерства здравоохранения, в России ежегодно проводится более 150 000 холецистэктомий, по своему количеству среди всех операций на органах брюшной полости они занимают третье место. Это наталкивает на мысль о том, что в качестве стандартной модели оценки кровоостанавливающей активности губчатых имплантов рационально использовать наиболее часто выполняемую операцию на печени ‑ холецистэктомию ‑ с последующей оценкой эффективности гемостаза по методу Левитэ.
Выводы
1. В настоящее время идет интенсивный процесс разработки новых кровоостанавливающих средств, которые все больше соответствуют требованиям, предъявляемым к идеальным имплантам. Вектором этого прогресса является стремление к максимальной эффективности и безопасности. Это определяет необходимость разработки структурированного алгоритма методик исследования кровоостанавливающих имплантов с учетом свойств материала их изготовления.
2. На сегодняшний день только начинают проявляться первые признаки тенденции отхода от идеи применения одного гемостатика при различных ситуациях, возникающих во время операций. Остается открытым вопрос о выборе кровоостанавливающих имплантов для интраоперационного применения, а также наиболее объективного метода оценки их эффективности в качестве основного критерия выбора. Таким образом, возникает потребность в формировании тактики применения кровоостанавливающего средства в зависимости от клинической ситуации.
3. Поскольку свойства импланта напрямую могут зависеть от материала, имеет смысл продолжать поиск полимера или их комбинаций, позволивших бы вплотную приблизиться к свойствам идеального импланта.