За последние 20 лет внедрение в исследовательскую и диагностическую практику молекулярно-цитогенетических методов сканирования генома в значительной степени увеличило объем наших знаний относительно генетических причин заболеваний, связанных с нарушением развития центральной нервной системы (ЦНС) у детей [1, 2]. В основном дизайн исследований геномных вариаций, вызывающих умственную отсталость, расстройства аутистического спектра, эпилепсию (нервно-психические заболевания) и врожденные пороки развития, базируется на анализе больших когорт и определении механизмов нарушения развития ЦНС как в отдельных случаях, так и непосредственно для заболевания [3–5]. Высокая эффективность поиска генетических причин вышеуказанных форм патологии ЦНС с помощью цитогеномного анализа (анализ генома на хромосомном и молекулярном уровнях) достигается за счет применения разработок в области биологии систем или биоинформатического анализа (системная цитогеномика) [6, 7]. Неоднократно продемонстрировано, что изучение патогенности таких геномных вариаций, как хромосомные аномалии и вариации числа копий последовательности ДНК (copy number variations или CNV), с помощью биоинформатических методов дает возможность определить процессы, лежащие в основе патогенеза болезней мозга [3, 7–10]. Фактически, именно использование биоинформатического анализа массивов больших геномных данных (genome big data) позволяет идентифицировать последствия вариаций генома в виде изменений числа и структуры хромосом в половых и соматических клетках человека [11]. Это также актуально и для определения последствий изменений отдельно взятых генов (генов-кандидатов) нервно-психических заболеваний у детей [12, 13]. В целом, обоснован вывод о том, что цитогеномный анализ когорт детей с нарушением развития ЦНС (умственной отсталостью, расстройствами аутистического спектра, эпилепсией) и врожденными пороками развития с использованием методов системной геномики (биоинформатики) позволяет с высокой эффективностью определять генетические механизмы заболеваний головного мозга. Несмотря на это, остаются открытыми вопросы о степени патогенности тех или иных изменений генома у различных индивидов, а также о механизмах возникновения патологических геномных перестроек (например, за счет взаимодействия окружающей среды с геномом клетки). Вероятно, сравнение массивов цитогеномных данных, полученных при изучении когорт из различных регионов мира и состоящих из представителей разных этнических групп, может дать ответы на поставленные вопросы.
Примечательно, что в литературе имеются описания исследований особенности вариаций генома в виде CNV в зависимости от этнической принадлежности и места проживания испытуемых [14, 15]. Важно отметить, что практически все подобные исследования посвящены исключительно вопросам популяционной генетики без анализа молекулярных и/или клеточных механизмов заболеваний на основе результатов изучения межпопуляционной вариабельности генома. Таким образом, в настоящее время имеются довольно ясные представления о популяционных особенностях геномных вариаций, тогда как подобия и различия вариабельности генома в контексте нарушения развития ЦНС между когортами пациентов с болезнями мозга фактически отсутствуют. Заполнение данного пробела в наших знаниях относительно патогенетического значения соответствующих геномных перестроек в зависимости от этнического происхождения и места жительства выглядит особо ценным с учетом возможности лечения у детей заболеваний ЦНС, обусловленных хромосомной патологией (важно отметить, что хромосомные болезни считаются неизлечимыми большинством специалистов в области медицины) [16], и определения ранее не известных механизмов нарушения психики с помощью оценки функциональных последствий изменений в геноме [7, 17]. Современные биоинформатические методы, основанные на принципах системной биологии, позволяют решить разнообразные задачи при изучении массивов больших геномных данных когорт детей с нервно-психическими заболеваниями [6–8, 10, 11, 17]. Следовательно, подобные исследования должны включать не только полногеномное сканирование на предмет хромосомных аномалий и CNV (молекулярное кариотипирование), но и биоинформатический анализ функциональных последствий изменений последовательности ДНК.
Помимо проблемы отсутствия непосредственного сравнительного анализа когорт детей с нарушением развития ЦНС, межпопуляционные исследования геномных вариаций в подавляющем большинстве случаев игнорируют феномен соматического мозаицизма (наличие двух или более клеточных популяций в организме, отличающихся друг от друга в контексте вариабельности генома). Это значимый недостаток, поскольку соматический мозаицизм (мозаичные хромосомные аномалии) вносит существенный вклад в этиологию заболеваний, ассоциированных с нарушением развития ЦНС у детей [18–20]. Для решения этой проблемы рекомендуется использовать методы, основанные на флуоресцентной гибридизации in situ (FISH), предоставляющей возможность визуализации специфических геномных участков в большом числе отдельно взятых клеток (интерфазных ядер) [1, 18, 20]. Более того, многие работы игнорируют также и цитогенетический анализ (визуальное сканирование генома с помощью микроскопического анализа индивидуальных клеток), несмотря на то, что они посвящены поиску хромосомных аномалий [4, 5, 9, 13–15]. Отсутствие цитогенетического анализа также является серьезным недостатком оценки цитогеномных вариаций в когортах детей с нервно-психическими заболеваниями, поскольку без соответствующих методов нет возможности определить локализацию хромосомных аномалий в клеточном геноме, а также невозможно выявлять хромосомную нестабильность, являющуюся важным элементом патогенетического каскада болезней ЦНС [1, 3, 7, 17, 20]. Принимая во внимание необходимость цитогенетических исследований и молекулярно-цитогенетического анализа методом FISH для изучения цитогеномных вариаций, следует отметить необходимость их включения в алгоритмы поиска хромосомных аномалий и патогенных CNV в когортах детей с нарушением развития ЦНС.
Суммируя характеристики предыдущих цитогеномных исследований, можно предложить подход к анализу хромосомных аномалий и CNV у детей с нарушением развития ЦНС или нервно-психическими заболеваниями. Во-первых, требуется проведение цитогенетического анализа для характеристики хромосомных аномалий и нестабильности в отдельно взятых клетках пациентов [3, 20]. Во-вторых, необходим анализ методом FISH для оценки уровня соматического мозаицизма (определение процентного соотношения популяций клеток с хромосомными аномалиями и без таковых) [12, 17, 18, 20]. В-третьих, непосредственным методом сканирования генома на CNV служит молекулярное кариотипирование, которое также является неотъемлемой частью цитогеномного анализа детей с нервно-психическими заболеваниями [3–5, 12]. Биоинформатический анализ с помощью методов, позволяющих определять функциональные последствия CNV, позволит свести три массива полученных данных: результаты цитогенетического исследования (1), анализа методом FISH (2) и молекулярного кариотипирования (3) [6, 10–12, 16, 17]. На рисунке 1 схематически представлен полноценный цитогеномный анализ когорты детей с заболеваниями развития ЦНС и врожденными пороками развития для получения вышеуказанных массивов данных.
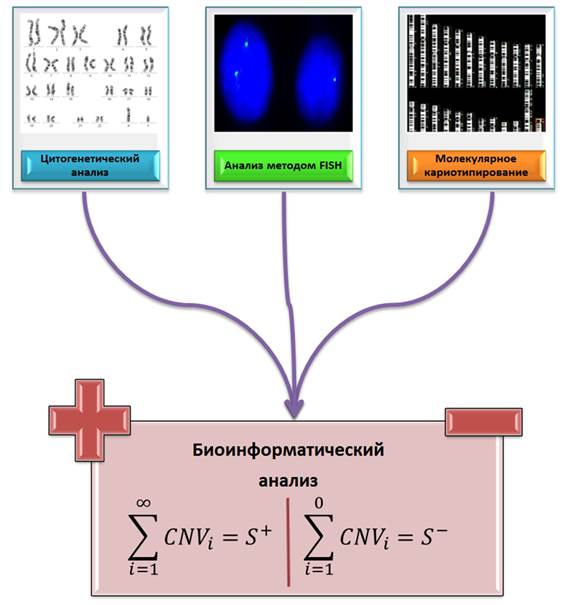
Рис. 1. Схематическое изображение цитогеномного анализа когорты детей с заболеваниями ЦНС и врожденными пороками развития для получения необходимых массивов цитогенетических и молекулярно-цитогенетических данных (включая результаты исследования соматического мозаицизма и молекулярного кариотипирования) в целях биоинформатического определения патогенетического значения цитогеномных вариаций с последующими определением механизма заболевания и возможной тактики индивидуальной терапии по совокупности патогенных (сумма слева) и непатогенных (сумма справа) CNV (в рисунке использованы части иллюстративного материала работы Iourov et al. [12], опубликованной по лицензии открытого доступа)
Методы системной биологии (системной геномики или геномной биоинформатики) продемонстрировали свою высокую эффективность при поиске причин заболеваний и лекарств, а также легли в основу принципов персонализированной медицины. Как следствие, данный подход к решению фундаментальных и диагностических биомедицинских задач стал основой для новейшего направления в области медицины – системной медицины [21]. Примечательно, что данный комплекс методов показал исключительно положительные результаты при анализе когорт индивидуумов с различными заболеваниями, сформированных в разных регионах мира [7, 21]. Таким образом, массивы данных, полученные с помощью вышеуказанной схемы для каждой отдельной когорты детей с заболеваниями развития ЦНС и врожденными пороками развития (рис. 1), возможно сравнить на предмет различия и подобия вариабельности генома с помощью биоинформатического анализа результатов цитогеномых исследований (рис. 2).
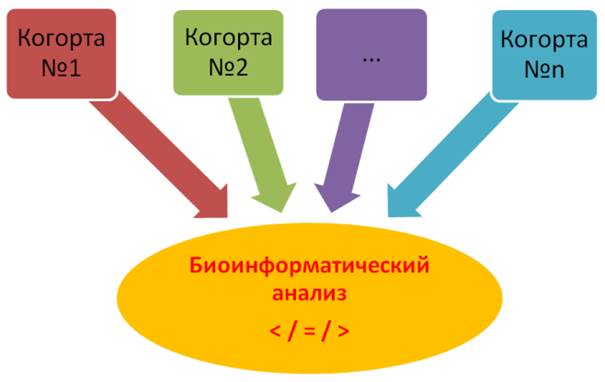
Рис. 2. Сравнительный анализ когорт для определения различий и подобий вариабельности генома при нарушениях развития ЦНС и врожденных пороках развития у детей, который осуществляется с помощью биоинформатического анализа результатов цитогеномых исследований (на основе биоинформатического анализа массивов данных, полученных с помощью методологии, обозначенной на рисунке 1, для каждой изучаемой когорты: когорты № 1, когорты № 2 … когорты № n)
Результаты проведенного сравнительного анализа когорт детей с нарушением развития ЦНС позволят получить знания относительно патогенности тех или иных изменений генома, механизмов возникновения патологических геномных перестроек (изучение особенностей взаимодействия окружающей среды с геномом клетки), этиологии и индивидуальной терапии болезни [4, 6–8, 16, 17]. Определенно, подобные исследования могут быть осуществлены только в рамках масштабного международного сотрудничества коллективов с обширным опытом в области цитогенетических и молекулярно-цитогенетических исследований. Наиболее успешно такое сотрудничество может быть реализовано в рамках международных проектов, сконцентрированных на цитогеномных исследованиях заболеваний ЦНС у детей из разных этнических групп, проживающих в различных регионах (странах) мира. Компетентность исследователей, а также количество и степень этнического и регионального разнообразия соответствующих когорт, по-видимому, являются определяющими для успешной реализации подобных проектов.
Заключение
В заключение следует обозначить три ключевые задачи, которые надо решить для успешной реализации сравнительного цитогеномного анализа когорт детей с нарушением развития ЦНС. Во-первых, анализ каждой когорты должен включать в себя цитогенетическое исследование для визуализации геномных вариаций и нестабильности в отдельных клетках, анализ с помощью метода FISH для точного определения уровней соматического хромосомного мозаицизма, молекулярное кариотипирование, позволяющее высокоразрешающее сканирование генома на предмет CNV (цитогеномное исследование), а также биоинформатический анализ, сводящий эти три массива данных и позволяющий оценить патогенетическое значение геномных вариаций. Во-вторых, массивы данных, полученные в ходе решения первой задачи для каждой изучаемой когорты, необходимо подвергнуть сравнительному биоинформатическому анализу для выделения общих патогенных вариаций и определения их специфического влияния на фенотип пациента(ов). В-третьих, для выполнения исследования, обозначенного при описании второй задачи, требуется международное сотрудничество ведущих национальных коллективов, имеющих реальный опыт проведения цитогенетических и молекулярно-цитогенетических исследований. Реализация проектов, предусматривающих подобное международное сотрудничество, способствует получению новых знаний относительно патогенности изменений генома, механизмов возникновения патологических геномных перестроек, а также относительно этиологии и возможности индивидуальной терапии болезней ЦНС у детей.
Исследования в лабораториях авторов поддерживались грантом РФФИ и CITMA (Ciencia, Tecnología y Medio Ambiente de la República de Cuba) в рамках научного проекта № 18-515-34005, а также Госзаданием Министерства науки и высшего образования России № AAAA-A19-119040490101-6 и Госзаданием Минздрава России № 121031000238-1.



