Глиобластома (ГБ) является наиболее распространенной и злокачественной первичной опухолью головного мозга у взрослых людей со средней выживаемостью всего 14,8 месяца после постановки первичного диагноза, несмотря на стандартный режим лечения, состоящий из хирургического вмешательства, лучевой терапии и химиотерапии [1, 2]. В настоящее время в качестве химиотерапевтического средства часто используют темозоломид, пероральный агент, алкилирующий ДНК, который в сочетании с лучевой терапией после операции увеличивает выживаемость пациентов, которая неэффективна по крайней мере у 50% пациентов с ГБ [3]. Некоторые биологические свойства ГБ делают болезнь устойчивой к лечению. Во-первых, клетки ГБ диффузно прорастают в нормальную мозговую ткань, что делает невозможным полное удаление опухоли хирургическим путем [4]. Во-вторых, большинство химиотерапевтических молекул недостаточно проникают в мозг из-за гематоэнцефалического барьера (ГЭБ) [4]. В-третьих, нацеливание на ключевые молекулярные пути неэффективно из-за высокой клеточной и генетической гетерогенности ГБ. Таким образом, для лечения ГБ необходимы новые эффективные препараты и терапевтические мишени.
В рамках предшествующих научных работ мы показали, что перспективной потенциальной мишенью для разработки средств таргетной терапии является протеинкиназа Mζ (ПК Mζ). Мы выявили, что наименьшая активность экспрессии ПК Mζ выявляется в диффузных астроцитомах, затем она значимо возрастает в анапластических астроцитомах, и наибольшее ее значение наблюдается в глиобластомах [5]. Кроме того, нам удалось показать, что активность экспрессии ПК Mζ значимо влияет на общую выживаемость пациентов с диффузными астроцитомами, анапластическими астроцитомами и глиобластомами и на безрецидивную выживаемость пациентов с диффузными астроцитомами и анапластическими астроцитомами [6]. Также мы показали, что активность экспрессии ПК Mζ статистически значимо выше в диффузных астроцитомах, анапластических астроцитомах и глиобластомах, а также олигодендроглиомах без метилирования промотера гена MGMT по сравнению с опухолями такого же гистогенетического происхождения, но с наличием метилирования промотера гена MGMT [5, 6].
Таким образом, в наших исследованиях мы впервые показали не только высокую значимость ПК Mζ для патогенеза диффузных глиом, но и большой практический потенциал данного молекулярного фактора, в связи с чем мы решили рассмотреть ПК Mζ как мишень для разработки средств терапии.
В рамках настоящего исследования мы изучили противоопухолевые эффекты ингибитора ПК Mζ Zeta-ингибирующего пептида (Zп) на клетки ГБ in vitro и in vivo. Мы продемонстрировали, что Zп вызывает остановку G2/M в клетках ГБ и ингибирует инвазию.
Материалы и методы исследования
Клеточные линии и культуры
Клеточные линии ГБ U251, LN229, A172, U118MG и нормальные человеческие астроциты (НА) были приобретены в банке клеток Берлинского Университета (Берлин, Германия), их молекулярные свойства подтверждены профилированием коротких тандемных повторов (КТП). Среда для НА, U251, LN229, A172 и U118MG была составлена из среды Игла, модифицированной среды Дульбекко (Thermo Fisher Scientific, США), 10%-ной фетальной телячьей сыворотки (Thermo Fisher Scientific, США), стрептомицина (100 Ед/мл) и пенициллина (100 Ед/мл). Клетки культивировали в увлажненном инкубаторе HERAcell 204i (ThermoFisher Scientific, США) при 37°C, 5% CO2.
Клетки P3, используемые в исследовании, были получены из первичных клеток ГБ человека и культивировались в нейробазальной среде NBM 21103-049 (ThermoFisher Scientific, США) с добавлением 2% B27 (ThermoFisher Scientific, США), 1% L-глутамина (BioNordika, Норвегия), 1% пенициллина/стрептомицина (BioNordika, Норвегия), 20 нг/мл EGF (Peprotech, США) и 20 нг/мл bFGF (Peprotech, США) в увлажненном инкубаторе при 37°C, 5% CO2. Клетки субкультивировали каждые 3 дня при соотношении субкультур 1: 3. Для обнаружения контаминации микоплазмой использовался анализ на основе ПЦР.
Анализ жизнеспособности клеток
Аналитический набор Cell Counting Kit-8 (CCK-8; Dojindo, Kumamoto, Japan) использовали для оценки жизнеспособности клеток. 4×103 клеток ГБ высевали в каждую лунку 96-луночных планшетов (Corning, США) и культивировали в увлажненном инкубаторе при 37°C, 5% CO2. Через 24 ч среду заменяли 100 мкл свежей культуральной среды, содержащей различные концентрации Zп или контрольного раствора (ДМСО). Через 24 ч, 48 ч, 72 ч и 96 ч после введения в среду растворов клетки ГБ инкубировали с 10 мкл реагента CCK-8 в 100 мкл бессывороточной среды DMEM при 37°C в течение 1 ч, для измерения оптической плотности использовали многомодовый планшетный ридер EnSight (Corning, США) при 450 нм.
Анализ пролиферации клеток
1×104 клеток ГБ высевали в каждую лунку 24-луночных планшетов (Corning, США) и культивировали в увлажненном инкубаторе при 37°C, 5% CO2. 5-этинил-2'-дезоксиуридин (EdU) разводили 1:1000 в среде DMEM, клетки ГБ обрабатывали смешанной средой EdU в течение 1 ч. EdU был обнаружен посредством катализируемой реакции между флуоресцентными красителями EdU и Apollo, предусмотренными в анализе включения EdU (Corning, США). В каждую лунку добавляли 250 мкл красящего раствора Apollo. Ядра контрастировали с DAPI. EdU-положительные клетки подсчитывали с помощью флуоресцентной микроскопии (Leica, Германия).
Анализ формирования колоний
Подсчитывали клетки U251 и P3, плотность клеток разбавляли до 500 клеток/мл и в каждую лунку 6-луночного планшета (Corning, США) добавляли 2 мл клеточной суспензии. Используемые концентрации веществ: 0 мкМ (ДМСО), 150 мкМ и 300 мкМ, после 7 дней культивирования. Затем среду заменяли свежей средой, клетки продолжали культивировать еще 7 дней. Культуральную среду снимали, каждую лунку 6-луночного планшета промывали 500 мкл PBS (3x) и клетки фиксировали 4%-ным параформальдегидом в течение 15 мин. Каждую лунку 6-луночного планшета промывали 500 мкл PBS (3x), клетки окрашивали в течение 30 мин кристаллическим фиолетовым. Лунки медленно промывали бидистиллированной водой. Клоны подсчитывали после сушки лунок на воздухе. Клоны подсчитывали, если количество клеток было более 50.
Лизаты белков и вестерн-блоттинг
Клетки лизировали буфером для лизиса RIPA (Beyotime, Китай) с добавлением фенилметансульфонилфторида (Beyotime, Китай) в течение 30 мин после 48-часовой обработки. Лизаты центрифугировали при 13000 об/мин в течение 20 мин, концентрации белка оценивали с помощью анализа BCA в соответствии с инструкциями производителя (Beyotime, Китай). Набор для быстрой подготовки геля PAGE использовали для приготовления 10% гелей толщиной 1,5 мм с 15 лунками в соответствии с инструкциями производителя.
Лизаты клеток (20 мкг белка) подвергали вестерн-блоттингу согласно ранее описанным протоколам. Мембраны инкубировали с первичными антителами при 4°C в течение ночи с последующей инкубацией с соответствующими вторичными антителами (1:2000) в течение 1 ч при комнатной температуре. Хемилюминесцентные сигналы регистрировали с помощью Chemiluminescence Imager в соответствии с протоколом производителя. Плотность полос определяли количественно с помощью программного обеспечения ImageJ и нормализовали по GAPDH или актину. Все эксперименты повторяли трижды.
Клеточный цикл
Клетки U251 и P3 разбавляли до 4×105 клеток/мл, 2 мл клеточной суспензии засевали в каждую лунку 6-луночного планшета и культивировали в течение ночи. Zп добавляли к клеткам в концентрациях 0 мкМ (ДМСО), 150 мкМ и 300 мкМ. Через 2 дня клетки промывали и собирали при 4000 об/мин в течение 5 мин, осторожно фиксировали в свежих 300 мкл PBS и 700 мкл 75%-ного этанола. Клетки инкубировали при 4°C в течение ночи, собирали при 4000 об/мин в течение 5 мин, промывали PBS при 4000 об/ мин в течение 5 мин. Осадки клеток окрашивали раствором красителя пропидия иодид (Beyotime, Китай) в течение 20 мин, а затем проводили проточную цитометрию для анализа клеточного цикла. Данные были экспортированы, и программное обеспечение Modifit 2.0 использовалось для определения распределения клеточного цикла.
Луночный анализ инвазии
Клетки U251 и P3 разводили до 4×105 клеток/мл, и 2 мл клеточной суспензии засевали в каждую лунку 6-луночного планшета. Клетки инкубировали в различных условиях в течение 48 ч. Планшеты для транслуночной миграции с размером пор 8 мкм (Sigma-Aldrich, США) покрывали матригелем (Sigma-Aldrich, США) на 4 ч. 20000 клеток в 100 мкл DMEM без FBS высевали в верхнюю камеру транслуночного аппарата, и 600 мкл среды, содержащей 10% FBS, добавляли в нижнюю камеру. После 24 ч инкубации при 37°C оставшиеся клетки удаляли с верхней стороны вставки с помощью ватного тампона, мигрировавшие клетки фиксировали 4%-ным параформальдегидом в течение 15 мин, дважды промывали PBS и окрашивали кристаллическим фиолетовым в течение 30 мин. Краситель удаляли, а клетки промывали бидистиллированной водой. Были получены изображения под световым микроскопом, которые использовали для подсчета мигрировавших клеток.
Клеточная инвазия в 3D-культуре
Колония клеток засевалась в каждую лунку 96-луночных планшетов для формирования сфероидов для формирования 3D-культуры (Sigma-Aldrich, США), со 100 мкл среды и культивировали при 37°C, 5% CO2 в течение 72 ч в увлажненном инкубаторе. Через 72 ч клетки U251 и P3 образовали опухолевые сфероиды. Планшеты помещали на лед на 15 мин, в каждую лунку планшетов добавляли 50 мкл инвазионной матрицы (Sigma-Aldrich, США). Планшеты центрифугировали при 300 × g при 4°C в течение 5 мин и инкубировали при 37°C в течение 1 ч. Кондиционированную среду (100 мкл) с различными концентрациями Zп добавляли в каждую лунку планшетов. Сфероиды опухоли P3 инкубировали в течение 3 дней, а сфероиды опухоли U251 инкубировали в течение 10 дней. Изображения сфероидов получали каждые 24 ч под светлопольной микроскопией с 4-кратным объективом. 192-часовые изображения U251 и 48-часовые изображения P3 были проанализированы с помощью программного обеспечения ImageJ.
Модель ортотопического ксенотрансплантата
Клетки типа P3, экспрессирующие люциферазу-GFP, имплантировали в мозг мышей-nude. Через 7 дней опухоль определяли с помощью биолюминесцентной визуализации, и мышей разделили на следующие 2 группы: контрольная, n=5; Zп, n=5. Мышам внутрибрюшинно вводили только разбавленный ДМСО (контроль) и Zп (50 мг/кг/день) каждый день. Объем опухоли контролировали с использованием биолюминесцентного изображения каждую неделю в течение 3 недель, а вес каждой мыши регистрировали каждую неделю в течение 4 недель. Мышей-nude с опухолью лечили до тех пор, пока не появились серьезные симптомы или неминуемая смерть: масса тела снизилась >10%, и мыши не могли вернуться в вертикальное положение после того, как их толкнули вниз. Выживаемость определялась как количество дней от имплантации до смерти. В конце эксперимента мышей умерщвляли. Иссеченную опухолевую ткань быстро замораживали в жидком азоте или фиксировали формалином для дальнейшего анализа.
Жидкостная хроматография – тандемный масс-спектрометрический анализ
Мышей-nude разделили на группу, обработанную Zп (внутрибрюшинная инъекция, 3 мыши), и контрольную группу (3 мыши). Через 2 ч после инъекции мышей анестезировали раствором хлоралгидрата. PBS перфузировали через сердце. Мышей умерщвляли ингаляцией СО2, собирали образцы мозга и хранили при –80°C. Zп и образцы мозга были дополнительно проанализированы с помощью тандемной жидкостной хроматографии с масс-спектрометрией для изучения распределения Zп в ткани мозга. Вкратце, образцы ткани взвешивали и добавляли соответствующие количества метанола и измельчающих шариков из диоксида циркония. Образцы измельчали в течение 5 мин после встряхивания в течение 10 мин, а затем центрифугировали при 15000 об/мин в течение 10 мин. Супернатант собирали и разбавляли для анализа на приборах UltiMate 3000 RS и TSQ Quantum.
Построение графиков и статистический анализ
Все анализы были выполнены с использованием программного обеспечения SPSS Statistics 23.0. Данные были представлены как среднее значение ± стандартное отклонение. Статистическая значимость данных оценивалась с использованием t-критерия Стьюдента и следующих p-значений: *р<0,05; **р<0,01; ***р<0,001 считались значимыми различиями.
Результаты исследования и их обсуждение
Zп вызывает задержку клеточного цикла в клетках ГБ
Чтобы определить, является ли Zп цитотоксичным для ГБ, мы сначала подвергли клеточные линии ГБ и НА воздействию Zп in vitro. Жизнеспособность всех протестированных клеток, включая P3, U251, LN229, A172, U118MG и НА, снижалась дозозависимым образом с увеличением концентрации Zп (рис. 1). IC50 НА была по крайней мере на 100 мкМ больше, чем для всех других клеточных линий, что указывает на то, что Zп может быть селективным для опухолевых клеток при определенных концентрациях (рис. 1). Затем в функциональных экспериментах мы выбрали P3, представляющий первичную клеточную линию ГБ, и U251, представляющий одну из наиболее распространенных лабораторных клеточных линий ГБ. Было выявлено снижение формирования колоний на 50% для клеток P3 и U251, инкубированных с 150 мкМ Zп, на 90% – для P3 и на 75% – для U251, инкубированных с 300 мкМ Zп. Наконец, жизнеспособность клеток P3 и U251 при обработке различными концентрациями Zп была меньше через 96 ч по сравнению с 48 ч. Эти результаты показали, что Zп сильно снижает жизнеспособность клеток ГБ в зависимости от дозы и времени.
Параметры пролиферации клеток и клеточного цикла также исследовали в клетках P3 и U251 при обработке Zп. В клетках P3 включение EdU было снижено на 70% при использовании 150 мкМ Zп и на 90% – при использовании 300 мкМ Zп. В клеточных линиях U251 включение EdU было снижено на 40% при использовании 150 мкМ Zп и на 70% – при использовании 300 мкМ Zп. Снижение EdU в линиях клеток P3 и U251 происходило дозозависимым образом с увеличением концентраций Zп (0 мкМ, 150 мкМ и 300 мкМ) через 48 ч (рис. 1). Кроме того, анализ клеточного цикла продемонстрировал, что процент клеток ГБ, накопленных в G2/M, увеличивался при обработке Zп дозозависимым образом. Наконец, при вестерн-блоттинге белки, связанные с пролиферацией клеток и контрольной точкой G2/M, включая циклин B1, циклин B2, CDK1 и PCNA, были снижены в клетках, обработанных Zп. Все уровни белка были снижены более чем на 60% при применении 300 мкМ Zп (рис. 1). Эти результаты продемонстрировали, что уровни ключевых белков контрольных точек совпадают с остановкой клеточного цикла, индуцированной Zп в клеточных линиях ГБ.
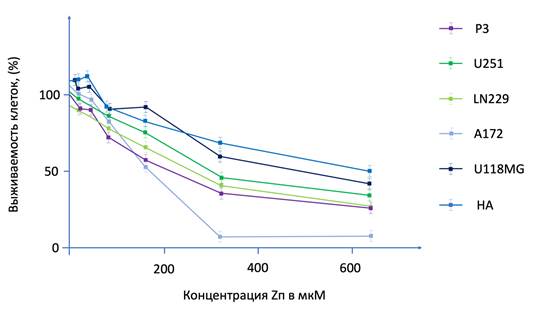
Рис. 1. Снижение выживаемости клеток глиобластомы при применении Zп в разных концентрациях Zп подавляет инвазию клеток ГБ
Чтобы определить, может ли Zп подавлять способность клеток ГБ к инфильтрации мозга, мы исследовали клетки ГБ при обработке Zп в анализах с транс-лунками и матригелем. В транслуночных анализах количество клеток P3, проникающих через мембрану, снизилось с более 250 (0 мкМ Zп) до 130 (150 мкМ Zп) и не более 60 (300 мкМ Zп). Количество инвазивных клеток U251 снизилось с более 250 (0 мкМ Zп) до 100 (150 мкМ Zп) и 35 (300 мкМ Zп). После 48 ч обработки Zп количество клеток в обеих клеточных линиях снижалось дозозависимым образом по сравнению с контролями (0 мкМ; рис. 2). Мы также измерили инвазивную способность сфероидов ГБ, полученных из клеток P3 и U251 в суспензионной культуре. Инвазивные области сфер P3 в матригеле также снизились до 65% (150 мкМ Zп) и 27% (300 мкМ Zп), а инвазивные области U251 снизились до 35% (150 мкМ Zп) и 17% (300 мкМ Zп). Кроме того, увеличение концентрации Zп привело к снижению инвазии (рис. 2б). В вестерн-блоттинге лизатов, полученных из клеток P3 и U251, обработанных Zп, связанные с инвазией белки, такие как N-кадгерин, ZEB1 и MMP2, подавлялись на 30% при 150 мкМ Zп и на 50% при 300 мкМ Zп. Уровни белка снижались в ответ на Zп дозозависимым образом (рис. 2). Эти результаты показали, что Zп подавляет инвазию клеток ГБ и ингибирует экспрессию соответствующих белков.
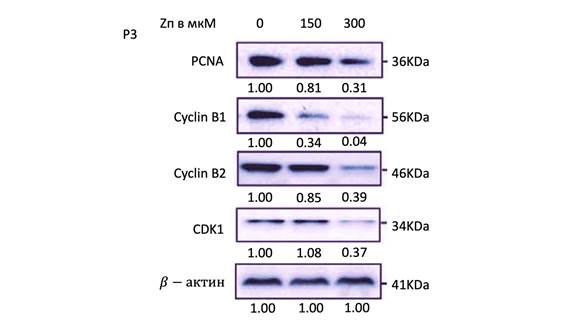
Рис. 2. Влияние на протекание клеточного цикла Zп в разных концентрациях Zп подавляет рост клеток GBM in vivo
Чтобы проверить, подавляет ли Zп рост клеток ГБ in vivo, мы оценили его эффекты в модели ГБ, экспрессирующей Р3-люциферазу, интракраниально имплантированной мышам-nude. Рост опухоли контролировали с помощью биолюминесценции люциферазы. Обработка Zп значительно подавляла рост опухоли по сравнению с контролем, и масса мышей, обработанных Zп, также не уменьшалась так быстро по сравнению с контролем в 2- и 3-недельные моменты времени после лечения. Данные о выживаемости, проанализированные методом Каплана–Мейера, также продемонстрировал статистически значимое различие в пользу группы с применением Zп. Иммуногистохимия, проведенная на срезах ткани из ксенотрансплантатов, продемонстрировала, что Ki67, маркер пролиферации клеток, был снижен на 50% в опухолях, обработанных Zп, по сравнению с контролями. Таким образом, Zп ингибировал рост опухолевых клеток in vivo. Мы также исследовали распределение Zп в ткани мозга голых мышей методом жидкостной хроматографии-тандемной масс-спектрометрии. Мы обнаружили, что образец, обработанный Zп, имел переход m/z 174,53–175,53 для ионного пика при 2,69 мин. Это значение соответствовало значению стандартного раствора Zп, подтверждая, что Zп способен доставляться в область опухоли в головном мозге.
Выявленные ранее фундаментальные закономерности для ПК Mζ действительно нашли свое практическое применение. В рамках настоящей работы мы на примере самых различных экспериментальных клеточных моделей показали, что ингибитор ПК Mζ Zп позволяет эффективно снижать пролиферативную активность клеток ГБ. Полученные нами результаты подтверждают важность первоочередных фундаментальных исследований для поиска наиболее теоретически обоснованных потенциальных мишеней лекарственной терапии. Проведение тщательной предварительной проработки фундаментальных аспектов позволило обнаружить сильные основания для дальнейшей трансляции их в практическую плоскость.
Следует заметить, что полученные результаты крайне многообещающи. Была продемонстрирована не только возможность снизить с помощью блокирования ПК Mζ пролиферативный потенциал глиомы, но также существенно ограничить инвазивную активность, что крайне немаловажно в условиях мозговой ткани, где широкий инфильтративный фронт является одной из важнейших проблем в реализации лечебных стратегий. Подобная диссеминация определяет не только быстрое распространение новообразования на все более широкие зоны мозговой ткани, но также нечувствительность к применяемым средствам химио- и лучевой терапии.
Возможной причиной подобного эффекта и, соответственно, мишенью для применения Zп служат глиомные стволовые клетки, несущие наиболее значимый потенциал для клеточной репопуляции [7, 8]. Более того, ранее мы уже демонстрировали, что именно данная клеточная популяция может быть ключевым местом реализации патогенных эффектов ПК Mζ. Полученные результаты также косвенно демонстрируют близкую взаимосвязь механизмов опухолевой инвазии и нейрональной пластичности, ведь, согласно современному состоянию данной проблемы, последние перестраиваются клетками глиомы под собственные нужды, связанные как раз с повышением ивазивности клеток ГБ [9, 10].
Заключение
Полученные результаты подтверждают потенциальную перспективность применения средств блокирования ПК Mζ для лечения ГБ, в том числе Zп. Следует заметить, что применение селективного ингибирования не только понижает пролиферативную активность, но также существенно ослабляет инвазивную способность глиомы. В целом, мы продемонстрировали потенциальную эффективность блокаторов ПК Mζ в подавлении всех ключевых аспектов опухолевого роста и дальнейшем прогрессировании. Дальнейшие клинические фазы испытаний могут позволить создать мощное средство в борьбе с ГБ.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 18-29-01034 мк.



