Аномальный дренаж легочных вен (АДЛВ) (синдром ятагана, синдром скимитара, венолобулярный синдром) – редкая врожденная аномалия, составляющая 1,5–2% от всех врожденных пороков сердца (ВПС) по данным разных авторов [1–4]. Факторами риска формирования порока являются различные инфекционные заболевания во время беременности, наличие вредных привычек у матери, отягощенный акушерско-гинекологический анамнез, возраст матери старше 40 лет, генетическая предрасположенность [5–8]. В настоящее время существуют два варианта данной аномалии: тотальная (ТАДЛВ), при которой кровь из всех легочных вен поступает в правое предсердие или полые вены, и частичная (ЧАДЛВ) – одна или более (но не все) легочные вены имеют связь с левым предсердием [2, 4–7]. ЧАДЛВ составляет более половины от всех случаев АДЛВ [1]. Также у АДЛВ имеются супракардиальная, интракардиальная, инфракардиальная и смешанная формы в зависимости от места впадения легочных вен [3, 5, 6]. Чаще всего встречается супракардиальная форма, реже всего – смешанная [3]. У ТАДЛВ существуют морфологические критерии, позволяющие дифференцировать диагноз: 1) расширение и гипертрофия правых отделов сердца, дилатация легочной артерии; 2) уменьшение объема левого предсердия до 50% от нормы; 3) при супракардиальной форме ТАДЛВ легочные вены с обеих сторон формируют общий коллектор, расположенный позади левого предсердия; 4) при интракардиальной форме ТАДЛВ место соединения обычно находится в нижнезадней части правого предсердия; 5) при инфракардиальной форме ТАДЛВ дистальное место соединения расположено ниже диафрагмы; 6) аномальная вена соединяется с портальной веной в месте слияния селезеночной и верхней мезентериальной вен; 7) обструкция легочного венозного возврата встречается при соединении аномального ствола с венозным протоком, с одной из печеночных вен или с нижней полой веной [6]. В каждой из форм порока могут присутствовать обструкции легочного венозного возврата, от которых зависят клиника и прогноз порока, но в 80% случаев сопровождает инфракардиальный тип [6, 8]. Они могут иметь место на уровне самих коллекторов, на уровне межпредсердной перегородки или быть связаны с внешним сдавлением: в месте впадения в верхнюю полую вену, при прохождении коллектора между левой легочной артерией и левым бронхом или правой легочной артерией и трахеей, на уровне диафрагмы, печеночных синусоидов или венозного протока [8]. Нередко АДЛВ сопутствует еще какая-либо аномалия правого легкого, например гипоплазия доли или ВПС, обычно дефект межпредсердной перегородки (ДМПП), дефект межжелудочковой перегородки, тетрада Фалло, коарктация аорты и др. [1, 5, 6]. Из клинических симптомов при этом пороке следует обратить внимание на наличие одышки, цианоза, быстрой утомляемости, задержки в физическом развитии [6]. Кроме этого, больные подвержены частым респираторным инфекциям [6]. При физикальной диагностике сердечно-сосудистой системы обычно выявляется мягкий «дующий» систолический на легочной артерии [6]. Чем позже появляются первые симптомы порока, тем лучше прогноз [8]. Инструментальная диагностика АДЛВ основывается на рентгенологическом исследовании, позволяющем выявить симптом ятагана – дугообразную тень, идущую от корня правого легкого к правому кардиодиафрагмальному углу, похожую по форме на турецкий кинжал; ЭхоКГ, ангиографии легочных вен, компьютерной и магнитно-резонансной томографии сердца [1–3, 6]. На ЭхоКГ обычно видны: расширенный правый желудочек и уменьшенный левый, существенное увеличение правого предсердия, у 30% больных есть ДМПП, у 70 % – открытое овальное окно [8]. При супракардиальной форме возможно выявить аномальный кровоток в верхней полой вене, инфракардиальный тип возможно визуализировать из субкостального доступа [8]. Пренатально этот ВПС можно обнаружить с помощью ЭхоКГ с использованием цветового допплеровского картирования (ЦДК), в режиме которого можно увидеть аномальный ток крови в легочных венах с инфра- и супракардиальным типом порока плода [2]. Во внутриутробном периоде порок не имеет большого гемодинамического значения, так как легочный кровоток минимален, оксигенация крови не нарушена, а правый желудочек и в норме играет ведущую роль [8]. Родоразрешение проводится в специализированном стационаре с ближайшей доступностью к кардиохирургическому центру [6]. Летальность при необструктивном ТАДЛВ составляет 50% к 3 месяцам жизни и 80% к 12, а при изолированном ЧАДЛВ половина пациентов доживают до 30–40 лет [6, 7]. Основным методом лечения является хирургическая коррекция порока в зависимости от его формы [4–6]. Оперативное вмешательство подразумевает перемещение общего коллектора легочных вен в левое предсердие [6]. При ЧАДЛВ хирургическое лечение может быть направлено на разобщение, реимплантацию и перемещение общего коллектора легочных вен [7]. Под наблюдением Ж.Б. Козыбаева и соавт. находилась пациентка в возрасте 3 лет 9 месяцев с жалобами на одышку, быструю утомляемость, отставание в физическом развитии и частые простудные заболевания. По ЭхоКГ выявлены вторичный ДМПП, расширение правых отделов сердца, легочная гипертензия – 40 мм рт. ст. На рентгенограмме патологии легких не обнаружено, кардиоторакальный индекс 63% за счет дилатированных правых отделов сердца, кроме этого, определяется симптом ятагана – тень аномально расположенного сосуда [3]. Автор делает вывод о том, что диагностика инфракардиальной формы АДЛВ является затруднительной и основными методами верификации диагноза служат рентгенологический метод, зондирование камер сердца и ангиокардиография [3]. В клиническом примере Н.Л. Павловой и соавт. у беременной П. 26 лет по УЗИ-скринингу на 15-й неделе гестации выявлен комбинированный ВПС плода, в том числе ТАДЛВ, который явился медицинским показанием для прерывания беременности [2]. По мнению автора, исследование сердечно-сосудистой системы плода необходимо выполнять по протоколу Российской ассоциации врачей ультразвуковой диагностики в акушерстве и гинекологии и согласно новым рекомендациям Международного общества ультразвука в акушерстве и гинекологии, которые говорят о том, что в ходе визуализации сердца в четырехкамерном срезе необходимо также оценивать легочные вены, что позволит исключить ТАДЛВ [2].
Цель исследования: описание клинического случая аномального дренажа легочных вен с акцентом на то, что порок обнаружен через месяц после рождения, так как не были использованы разные режимы работы УЗИ-аппарата при проведении ЭхоКГ плода в пренатальном периоде и при выявлении у новорожденного по УЗИ органов брюшной полости расширения воротной вены также не был заподозрен этот порок.
Ребенок Г. от 2-й беременности, протекавшей на фоне анемии, ожирения 2-й степени, угрозы преждевременных родов в 28 и 35 недель, плацентарных нарушений. Роды на сроке в 37 недель путем кесарева сечения. Оценка по шкале APGAR 8/8 баллов. За время наблюдения в первые сутки состояние ребенка с отрицательной динамикой за счет появления признаков церебральной возбудимости: вялое сосание, частые срыгивания, тремор подбородка при плаче. При осмотре кожный покров и видимые слизистые ярко-розовые, чистые, нормальной влажности. Аускультативно дыхание пуэрильное, проводится по всем полям, хрипов нет, ЧД 46 в минуту. Тоны сердца достаточной громкости, ритм правильный, ЧСС 140 уд/мин. Живот мягкий, не вздут. При пальпации печень и селезенка не увеличены. Физиологические отправления не нарушены. Ребенок переведен в отделение патологии новорожденных и недоношенных детей (ОПННД) на дообследование и лечение с предварительным диагнозом: Церебральная возбудимость. В ОПННД был проведен ряд обследований для уточнения диагноза. В общем анализе крови отклонений не выявлено: эритроциты 4,5х1012/л, гемоглобин 128 г/л, лейкоциты 13,2х109/л, нейтрофилы сегментоядерные 53 %, лимфоциты 38%, эозинофилы 2%, моноциты 6%, базофилы 1%, тромбоциты 337х109/л. В биохимическом анализе крови отмечаются: незначительное снижение общего белка – 55,8 г/л (норма 66–88 г/л), повышение уровня АСТ до 50,9 ед/л (норма до 37 ед/л), общего билирубина до 108,53 мкмоль/л (норма 20,5 мкмоль/л), щелочной фосфатазы до 485,19 ед/л (норма 64–306 ед/л). Общий анализ мочи без патологии. По УЗИ органов брюшной полости выявлены расширение воротной вены до 7,2 мм (норма до 4,0 мм) (рис. 1), минимальная реакция сосудов печени, деформация желчного пузыря, повышенное газонаполнение кишечника, пиелоэктозия обеих почек, мочекислый инфаркт обеих почек.
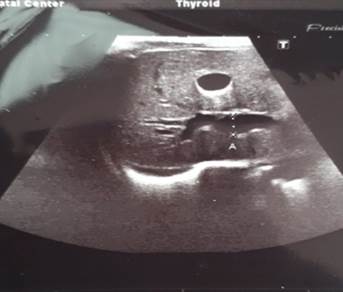
Рис. 1. УЗИ органов брюшной полости: расширение воротной вены до 7,2 мм
На рентгенограмме органов грудной клетки признаков инфильтрации в легких не выявлено. Обогащение сосудистого рисунка. Кардиоторакальный индекс 54% (рис. 2).
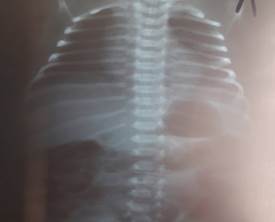
Рис. 2. Рентгенограмма органов грудной клетки: обогащение сосудистого рисунка. Кардиоторакальный индекс 54%
При ЭхоКГ визуализируются открытый артериальный проток (ОАП) 2 мм, открытое овальное окно (ООО) 3 мм, незначительная дилатация полости правого предсердия до 15 мм (норма до 12 мм), фракция выброса (ФВ) 75% (норма 60–80), умеренная легочная гипертензия (55 мм рт. ст.), множественные дополнительные хорды в полости левого желудочка (ДХЛЖ). На ЭКГ регистрируется синусовый ритм, ЧСС 166 уд/мин. ЭОС отклонена вправо. Поскольку на УЗИ органов брюшной полости были обнаружены изменения (расширение воротной вены), ребенок осмотрен детским хирургом. На основании объективных данных и инструментальных обследований ребенку выставлен диагноз: Основной: Врожденная флебэктазия воротной вены. Артерио-портальная фистула. Функционирующие фетальные коммуникации: ОАП, ООО. Умеренная неонатальная легочная гипертензия. Малая аномалия развития сердца: ДХЛЖ. Нарушение кровообращения 0 степени. Сопутствующий: Церебральная возбудимость. На основании данного диагноза консилиум в составе детского хирурга и неонатолога принял решение, что признаков портальной гипертензии на данный момент нет и ребенок в неотложных хирургических пособиях не нуждается. По отказу мамы от стационарного лечения ребенок был выписан домой с рекомендацией повторной госпитализации в детскую республиканскую клиническую больницу (ДРКБ) через месяц.
Через месяц, в возрасте 1 месяца 10 дней ребенок госпитализирован в плановом порядке в ДРКБ с жалобами на эпизоды учащенного дыхания. Объективно состояние оценено как тяжелое за счет симптомов сердечной недостаточности, неврологической симптоматики. Кожный покров бледно-розовый, цианоз носогубного треугольника, акроцианоз. Пастозности и отеков мягких тканей не отмечается. Мышечный тонус снижен. Рефлексы новорожденного вызываются слабо. Аускультативно дыхание пуэрильное, проводится по всем легочным полям, ЧД 50 в минуту. Тоны сердца ясные, ритм правильный. ЧСС 146 уд/мин. При пальпации живот мягкий, не вздут, печень, селезенка не увеличены. Стул самостоятельный. Мочеиспускание не нарушено. Выполнено диагностическое обследование. В общем анализе крови без отклонений: лейкоциты 9,6х109/л, сегментоядерные 23%, лимфоциты 68%, моноциты 9%, эритроциты 4,5х1012/л, гемоглобин 128 г/л, тромбоциты 337х109/л. В биохимическом анализе крови отмечаются: гипопротеинемия – 57,8 г/л (норма 66–88 г/л), повышение уровня АСТ до 48,9 ед/л (норма до 37 ед/л), общего билирубина до 105,53 мкмоль/л (норма 20,5 мкмоль/л), щелочной фосфатазы до 585,19 ед/л (норма 64–306 ед/л). На ЭКГ регистрируются синусовый ритм, отклонение электрической оси сердца вправо, перегрузка правого желудочка (ПЖ) (рис. 3).
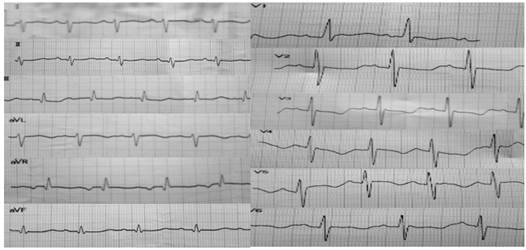
Рис. 3. ЭКГ: синусовый ритм, отклонение электрической оси сердца вправо, перегрузка правого желудочка
По ЭхоКГ визуализируются дилатация правого предсердия до 19 мм (норма до 12 мм), утолщение передней стенки правого желудочка до 16 мм (норма 3–12), конечный диастолический размер 15 мм (норма 15–20), конечный систолический размер 9 мм, конечный диастолический объем 6 мл, конечный систолический объем 2 мл, ударный объем 4 мл, фракция выброса 73% (норма 60–80). Трикуспидальный клапан 10 мм, регургитация 3-й степени, pG 120–130 мм рт. ст. Высокая легочная гипертензия. ОАП. ООО. ДХЛЖ. При проведении УЗИ органов брюшной полости и почек отмечаются признаки расширения вен воротной системы на уровне ствола (6,7–7 см), бифуркации (6 мм) и левой ветви воротной вены (3,7 мм). На уровне ствола воротной вены и впадения нижней полой вены в правый желудочек нечетко визуализируется гипоэхогенное образование (сосуд?) до 5–6 см в диаметре (аномалия расположения сосудов?). На МРТ сердца определяется тотальный аномальный дренаж легочных вен, инфракардиальная форма (рис. 4).
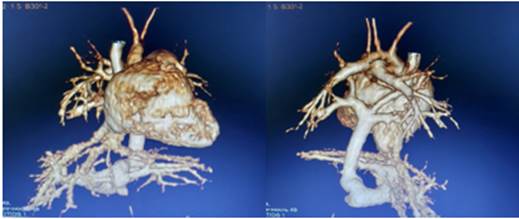
Рис. 4. МРТ сердца: тотальный аномальный дренаж легочных вен, инфракардиальная форма
На основании полученных данных выставлен диагноз: Основной: ВПС: Тотальный аномальный дренаж легочных вен, инфракардиальная форма. Вторичный ДМПП. Выраженная дилатация правых отделов сердца. Высокая легочная гипертензия. Сопутствующий: Церебральная возбудимость. Ребенок получал лечение в соответствии с клиническими рекомендациями по ТАДЛВ – увлажненный кислород со скорость 4 л/мин. Направлен в Федеральный центр сердечно-сосудистой хирургии г. Пензы для хирургической коррекции порока. Послеоперационный период протекал тяжело, с клиникой сердечной недостаточности. Экстубирован на 3-и сутки. Постепенно отменена кардиотоническая и вазопрессорная поддержка.
Заключение
Пренатально данный критический ВПС не был диагностирован на всех 3 скринингах, так как ЭхоКГ плода проводилось только в режиме четырехкамерного среза сердца без визуализации легочных вен и ЦДК. После рождения отсутствовала клиника сердечной недостаточности, в том числе и по ЭхоКГ. Заподозрить этот порок только по результатам УЗИ органов брюшной полости (расширение воротной вены) не представлялось возможным. Клиника, изменения на ЭхоКГ манифистировали в возрасте 1 месяца. Из этого следует вывод о том, что при проведении УЗИ-скрининга плода необходимо полностью оценивать состояние сердечно-сосудистой системы, используя разные режимы работы УЗИ-аппарата. При расширении воротной вены у новорожденного по данным УЗИ органов брюшной полости нужно исключать и такой сложный ВПС, как инфракардиальная форма тотального аномального дренажа легочных артерий.



