Злокачественные новообразования – это одна из основных причин в мире, приводящих к преждевременной смерти. В 2020 г. число новых случаев рака в мире достигло 19,3 млн человек, а умерли за тот же период около 10 млн человек [1]. В связи с этим вопросы, связанные с диагностикой и лечением онкологических заболеваний, не теряют своей актуальности.
Быстрое развитие в конце XX в. и, особенно, в начале XXI в. биотехнологий создало предпосылки для создания новых лекарственных препаратов, которые могут целенаправленно действовать на молекулы, участвующие в канцерогенезе, тем самым уменьшая возможность роста и метастазирования опухоли. Как правило, такие препараты, получившие обобщающее название таргетных препаратов, действуют на факторы роста или на рецепторы факторов роста. Наибольший интерес, в первую очередь, представляют препараты, действующие на рецепторы эпидермального фактора роста (EGF) и фактора роста эндотелия сосудов (VEGF), а также на белки, которые участвуют в проведении митогенных сигналов от рецепторов, нерецепторные тирозинкиназы, белки семейства Ras, циклинзависимые киназы, молекулы, контролирующие апоптоз (Bcl2, p53 и др.) и ангиогенез [2]. Механизм действия таких препаратов, в частности нацеленных на рецепторы эпидермального фактора роста (EGFR), основывается на блокаде передачи митогенных и антиапоптотических сигналов в злокачественной опухоли. При связывании сигнальной молекулы с внеклеточным доменом рецептора происходит объединение двух связанных с сигнальной молекулой рецепторов в единый комплекс (димеризация) с последующим аутофосфорилированием тирозинкиназы внутриклеточного домена рецептора, что обеспечивает передачу сигнала внутрь клетки, а затем и внутриклеточную передачу сигнала к ядру клетки [3]. Примером блокады путем нейтрализации сигнальной молекулы до ее связывания с рецептором является применение бевацизумаба [2].
Бевацизумаб представляет собой рекомбинантное моноклональное антитело, обладающее способностью избирательно связываться с фактором роста эндотелия сосудов (vascular endothelial growth factor – VEGF), вследствие чего подавляется способность фактора роста эндотелия сосудов связываться с его рецепторами (Flt-1, KDR) на поверхности эндотелиальных клеток, что приводит к снижению васкуляризации и угнетению роста опухоли [4]. Бевацизумаб первоначально был одобрен в США для лечения пациентов с метастатическим раком толстого кишечника и немелкоклеточным раком легкого, позднее была обнаружена активность бевацизумаба у пациентов с опухолями мозга, гиперэкспрессирующими VEGF [5]. В России бевацизумаб остается одним из самых закупаемых онкопрепаратов и применяется как препарат первой линии для лечения метастатического колоректального рака.
Современная лекарственная терапия злокачественных новообразований, в том числе и с использованием бевацизумаба, серьезно изменила ожидаемую продолжительность жизни онкологических больных. Но в то же время применение новых и эффективных противоопухолевых препаратов часто связано с риском развития побочных эффектов со стороны сердечно-сосудистой системы, при этом приходится соотносить клиническую пользу и профиль безопасности применяемого препарата. Не исключением является и бевацизумаб. Одним из самых частых побочных эффектов бевацизумаба представляется повышение артериального давления [6, 7]. Отмечается, что на уровень артериального давления при применении бевацизумаба влияет полученная доза препарата, а продолжительность повышения артериального давления зависит от времени ингибирования VEGF, которое часто имеет индивидуальные особенности. Так, в одном из клинических исследований II фазы у больных почечно-клеточным раком артериальная гипертензия на фоне терапии бевацизумабом 10 мг/кг наблюдалась в 36% случаев, а в группе 3 мг/кг – только в 3% случаев, при этом частота и степень артериальной гипертензии на фоне терапии бевацизумабом не зависели от локализации опухоли и составляли от 2,3% до 26% (3–4-я степень – 0,5–17,9%) [7].
Механизмы, которые приводят к развитию артериальной гипертензии на фоне введения ингибиторов VEGF и, в частности, бевацизумаба, пока остаются до конца не ясными. В экспериментальных исследованиях на крысах было показано, что введение четырех различных многоцелевых ингибиторов тирозинкиназы (RTKI) у находящихся в сознании крыс вызывало повышение артериального давления (АД), сопровождающееся значительным сужением сосудов в сосудистом русле брыжейки и задних конечностей, но не в почках [8]. Эти данные подтверждают предыдущие наблюдения о том, что в основе повышения АД, вызванного ингибиторами VEGF, лежит вазоконстрикция, а не кардиосупрессия или почечная дисфункция. Сосудосуживающий ответ на ингибиторы VEGF, вероятно, связан со снижением уровней вазодилататора NO из-за ингибирования индуцированной эндотелиальной синтазой азота (eNOS) продукции NO [9].
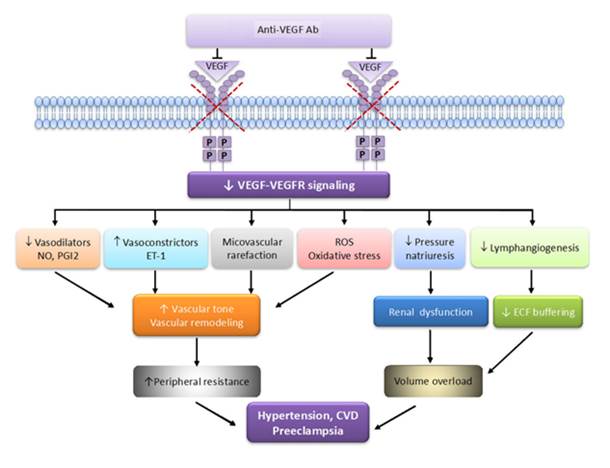
Рис. 1. Возможный механизм влияния ингибиторов фактора роста сосудов на артериальное давление (модифицировано на основании данных Touyz R. at all [9])
Anti-VEGF Ab – антитела к фактору роста эндотелия сосудов; р – место фосфорилирования тирозинкиназы; VEGF-VEGFR signaling – сигнальная система фактора роста эндотелия сосудов и рецепторов к фактору роста эндотелия сосудов; ROS – активные формы кислорода; NO – оксид азота; PGI2 – простагландин I2; ЕТ-1 – эндотелин-1; ECF buffering – задержка (буферизация) внеклеточной жидкости; CVD – сердечно-сосудистые заболевания.
Схема на рисунке 1 иллюстрирует возможные патофизиологические процессы, посредством которых ингибирование VEGF-VEGFR способствует развитию гипертонии. Использование моноклональных антител к VEGF (бевацизумаба) приводит к снижению передачи сигналов VEGFR и, как следствие, к снижению выработки вазодилататоров (NO и PGI2), увеличению выработки вазоконстрикторов (ЕТ-1) и окислительному стрессу. Это, в свою очередь, приводит к повышению тонуса сосудов и ремоделированию артерий. Пониженный натрийурез и нарушение лимфатической функции способствуют перегрузке объемом.
Между тем некоторые исследователи считают, что гипертензия, возникающая у пациентов, получающих лечение моноклональными антителами к VEGF, может являться маркером ингибирования и, следовательно, представлять собой биомаркер эффективности противоопухолевой терапии у пациентов с метастатическим колоректальным раком, получающих химиотерапию и бевацизумаб [10]. Метастатический колоректальный рак, который является основным показанием для назначения бевацизумаба, наиболее часто встречается у пациентов в возрасте 65 лет и старше [11], и развитие гипертензии у пациентов данной возрастной группы может потребовать изменений в схеме проводимой химиотерапии, что, в свою очередь, может отразиться на эффективности лечения. В связи с этим поиск путей коррекции кардиотоксических эффектов бевацизумаба у пожилых пациентов остается актуальной задачей для современной науки.
Цель исследования: изучить влияние бевацизумаба на гемодинамические показатели: артериальное давление и частоту сердечных сокращений – у стареющих нормотензивных ненаркотизированных крыс линии Wistar для определения начала развития и длительности артериальной гипертензии в целях разработки оптимальных схем снижения кардиотоксичности бевацизумаба в эксперименте.
Материал и методы исследования
Гемодинамические показатели изучены у стареющих крыс самцов нормотензивной линии Wistar, возраст крыс на момент начала эксперимента составлял 20 месяцев. Количество животных – 10 особей. В день начала регистрации гемодинамических показателей вес животных находился в диапазоне от 330 до 440 г, в среднем 388±13 г. Животные были получены из медико-биологической клиники Курского государственного медицинского университета Минздрава РФ. На протяжении всего исследования животных в комнате для содержания животных и в манипуляционной температура воздуха находилась в диапазоне +22±2 С°, были обеспечены воздухообмен 10–12 объемов помещения в час и световой режим 12х12. В ходе всего эксперимента животным был предоставлен свободный доступ к пище и воде. Измерение гемодинамических показателей выполнялось в первой половине дня, в одно и то же время для каждого животного. Все манипуляции в ходе эксперимента соответствовали положению Европейской конвенции по защите экспериментальных животных (86/609 EEC).
Артериальная гипертензия у крыс воспроизводилась внутрибрюшинным введением бевацизумаба в дозе 10 мг/кг в неделю [12], были выполнены 2 инъекции, суммарная доза бевацизумаба, введенная внутрибрюшинно каждой крысе, составила 20 мг/кг. В исследовании использовался препарат Авегра®Биокрад (бевацизумаб) концентрат для приготовления раствора для инфузий, серия 89110720.
Систолическое артериальное давление (САД), диастолическое артериальное давление (ДАД) и частоту сердечных сокращений (ЧСС) у крыс регистрировали с помощью аппаратно-программного комплекса для электрофизиологических исследований MP150 производства («Biopac Systems, Inc.», США), включающего в себя базовый блок, блок усилителя UIM100C, блок измерения давления NIBP200A и датчик с манжетой для хвоста RXTCUFFSENSOR-11. Данные были записаны и обработаны при помощи программы «AcqKnowledge 4.4» (рис. 2).
Рис. 2. Регистрация систолического артериального давления на хвосте крысы с помощью аппаратно-программного комплекса для электрофизиологических исследований MP150 с использованием компьютерной программы AcqKnowledge 4.4. (Стрелки – момент регистрации систолического и диастолического давления)
Перед тем как начать процесс регистрации параметров гемодинамики у ненаркотизированных животных при помощи хвостового датчика с манжетой, для уменьшения возможного влияния стресса на животное сначала мы приучали крыс к условиям эксперимента. Животное помещали в специальный пенал, на хвост надевали датчик с манжетой, и в таком состоянии крыса находилась 10 мин ежедневно в течение недели [13].
Динамика гемодинамических показателей оценивалась у ненаркотизированных животных еженедельно в течение 3 недель до инъекции бевацизумаба и в течение 15 недель после 1-й инъекции бевацизумаба. Перед каждой регистрацией гемодинамических параметров крыса предварительно помещалась на 20 мин в специальную вентилируемую камеру с температурой 40°C. После этого выполнялись 10 измерений артериального давления и пульса на хвосте с интервалом между измерениями 30 секунд, а затем рассчитывались их средние арифметические значения.
Цифровые данные, полученные во время выполнения эксперимента, обрабатывались статистически. Так как во всех точках измерения гемодинамических показателей распределение полученных цифровых данных было нормальным, достоверность отличий между результатами в разных временных точках оценивали при помощи t-test для групп с равной дисперсией. Различия между сравниваемыми показателями считались достоверными при p≤0,05.
Результаты исследования и их обсуждение
До начала введения бевацизумаба во время периода адаптации животных к условиям эксперимента давление на хвосте было измерено 3 раза. 1-е измерение давления выполнялось до начала адаптационного периода для того, чтобы иметь начальные значения гемодинамических показателей стареющих крыс в условиях иммобилизационного стресса, далее в течение 1 недели проходил адаптационный период, и по его завершении были измерены гемодинамические показатели животных (табл. 1).
Таблица 1
Гемодинамические показатели стареющих нормотензивных ненаркотизированных крыс во время периода адаптации к условиям эксперимента (М±m, n=10)
|
N п/п |
День измерения |
САД (мм рт. ст.) |
ДАД (мм рт. ст.) |
ЧСС, уд/мин |
|
1 |
14 дней до 1-й инъекции бевацизумаба |
148,8±3,7 |
114,4±3,0* |
346±7,0* |
|
2 |
7 дней до 1-й инъекции бевацизумаба |
142,8±1,8 |
105,5±2,2 |
339±6,0 |
|
3 |
День «0» – день 1-й инъекции бевацизумаба |
143,6±2,6 |
103,7±2,2 |
329±4,0 |
Примечание: * – при р<0,05 по сравнению с показателями в день «0» ** – при р<0,01 по сравнению с показателями в день «0»
Согласно данным, представленным в таблице 1, до начала периода адаптации у нормотензивных стареющих крыс средние показатели давления и ЧСС были относительно высокими: САД 148,8±3,7 мм рт. ст., ДАД 114,4±3,0 мм рт. ст. и ЧСС 346±7 уд/мин. После недельного периода адаптации САД и особенно ДАД заметно снизились, и, если для САД это снижение не было достоверным (р=0,16), то для ДАД снижение было статистически значимым (р<0,05), ЧСС также уменьшилась, но незначительно. При последующем наблюдении через 2 недели после начала периода адаптации мы наблюдали стабилизацию показателей гемодинамики у нормотензивных стареющих крыс – показатели САД, ДАД и ЧСС были практически на одном уровне с показателями, которые были получены через 1 неделю после начала периода адаптации к условиям эксперимента. В связи с этим период адаптации считался оконченным, а показатели гемодинамики, которые были получены через 2 недели после начала периода адаптации к условиям эксперимента, были приняты за базовые значения и получили обозначение «гемодинамические показатели в день “0”».
В день «0» после измерения гемодинамических показателей всем животным была выполнена 1-я внутрибрюшинная инъекция бевацизумаба в дозе 10 мг/кг. Через 1 неделю после выполнения 1-й инъекции бевацизумаба вновь были сняты гемодинамические показатели у всех животных (табл. 2).
Таблица 2
Гемодинамические показатели стареющих нормотензивных ненаркотизированных крыс во время периода нарастания гипертензии, индуцированной бевацизумабом (М±m, n=10)
|
N п/п |
День измерения |
САД, мм рт. ст. |
ДАД, мм рт. ст. |
ЧСС, уд/мин |
|
1 |
День «0» – день 1-й инъекции бевацизумаба |
143,6±2,6 |
103,7±2,2 |
329±4,0 |
|
2 |
+ 7 дней после 1-й инъекции бевацизумаба, день 2-й инъекции бевацизумаба |
147,2±2,1 |
108,4±1,8 |
317±5,0 |
|
3 |
+ 14 дней после 1-й инъекции бевацизумаба |
154,9±3,8* |
118,5±3,5** |
329±11,0 |
|
4 |
+ 21 день после 1-й инъекции бевацизумаба |
161,1±3,6** |
118,4±2,8** |
322±7,0 |
|
5 |
+ 28 дней после 1-й инъекции бевацизумаба
|
162,4±3,5** |
118,8±3,1** |
320±6,0 |
|
6 |
+ 5 недель после 1-й инъекции бевацизумаба
|
158,6±2,7** |
115,1±4,0* |
319±6,0 |
|
7 |
+ 6 недель после 1-й инъекции бевацизумаба (максимальные зафиксированные значения) |
163,9±2,6** |
123,2±3,2** |
322±9,0 |
Примечание: * – при р<0,05 по сравнению с показателями в день «0» ** – при р<0,01 по сравнению с показателями в день «0»
Через 7 дней после 1-й инъекции бевацизумаба у стареющих нормотензивных крыс наблюдалось небольшое повышение САД до 147,2 мм рт. ст. и ДАД до 108 мм рт. ст., но эти изменения не были статистически значимыми. После измерения гемодинамических параметров через 7 дней после 1-й инъекции бевацизумаба была выполнена 2-я инъекция бевацизумаба.
Через 7 дней после 2-й инъекции бевацизумаба мы наблюдали статистически значимое повышение давления у нормотензивных стареющих крыс, САД в среднем повысилось на 7,9% – до 154,9 мм рт. ст. (р<0,05), а ДАД в среднем повысилось на 14,3% – до 118,5 мм рт. ст. (р<0,01), ЧСС существенно не изменилась. При последующих измерениях гемодинамики у экспериментальных животных наблюдалось дальнейшее повышение САД и ДАД без существенного изменения ЧСС; максимальных значений показатели давления у стареющих нормотензивных крыс достигли через 6 недель после й-й инъекции бевацизумаба, превышение базовых исходных значений для САД составило 14,1%, давление в среднем повысилось до 163,9 мм рт. ст. (р<0,01), а превышение базовых исходных значений для ДАД составило уже 18,8%, давление в среднем повысилось до 123,2 мм рт. ст. Частота сердечных сокращений, в свою очередь, практически не изменилась, что может свидетельствовать о ведущем значении в патогенезе развития гипертензии увеличения тонуса периферических сосудов [9].
Дальнейшее еженедельное измерение гемодинамических показателей у нормотензивных стареющих крыс продемонстрировало, что повышение давления, вызванное двумя инъекциями бевацизумаба в дозе 10 мг/кг с недельным интервалом, обусловливает длительное стойкое повышение давления у экспериментальных животных в течение 10 недель (со 2-й по 12-ю неделю после 1-й инъекции бевацизумаба) (табл. 3).
Таблица 3
Гемодинамические показатели стареющих нормотензивных ненаркотизированных крыс во время уменьшения гипертензии, индуцированной бевацизумабом (М±m, n=10)
|
N п/п |
День измерения |
САД, мм рт.ст. |
ДАД, мм рт. ст. |
ЧСС, уд/мин |
|
1 |
День «0» – день 1-й инъекции бевацизумаба |
143,6±2,6 |
103,7±2,2 |
329±4,0 |
|
2 |
+ 6 недель после 1-й инъекции бевацизумаба (максимальные зафиксированные значения) |
163,9±2,6** |
123,2±3,2** |
322±9,0 |
|
3 |
+ 7 недель после 1-й инъекции бевацизумаба
|
161,9±4,6** |
118,1±1,8 |
315±7,0 |
|
4 |
+ 8 недель после 1-й инъекции бевацизумаба
|
159,4±3,1** |
118,7±4,3** |
324±8,0 |
|
5 |
+ 9 недель после 1-й инъекции бевацизумаба
|
160,7±4,2** |
120,6±3,8** |
319±9,0 |
|
6 |
+ 10 недель после 1-й инъекции бевацизумаба
|
157,0±2,5** |
118,0±2,1** |
328±10,0 |
|
7 |
+ 11 недель после 1-й инъекции бевацизумаба
|
157,8±4,1** |
117,8±3,6** |
323±6,0 |
|
8 |
+ 12 недель после 1-й инъекции бевацизумаба
|
155,7±3,9* |
117,9±4,2** |
315±10,0 |
|
9 |
+ 13 недель после 1-й инъекции бевацизумаба
|
149,2±4,3 |
113,6±4,5 |
323±7,0 |
|
10 |
+ 14 недель после 1-й инъекции бевацизумаба
|
150,2±4,6 |
110,6±3,6 |
330±5,0 |
|
11 |
+ 15 недель после 1-й инъекции бевацизумаба
|
143,8±3,3 |
107,2±2,9 |
329±6,0 |
Примечание: * – при р<0,05 по сравнению с показателями в день «0» ** – при р<0,01 по сравнению с показателями в день «0»
САД и ДАД с 13-й недели после 1-й инъекции бевацизумаба достоверно не отличаются от показателей гемодинамики, зафиксированных в день «0» эксперимента (p>0,05). Дальнейшие наблюдения показали, что с 13-й недели после 1-й инъекции бевацизумаба происходит постепенное снижение артериального давления к 15-й неделе, при этом уровень САД в среднем снизился до 143,8 мм рт. ст., а уровень ДАД в среднем снизился до 107,2 мм рт. ст. Эти показатели очень близки к базовым значениям, зафиксированным перед 1-й инъекцией бевацизумаба, что говорит от том, что произошла нормализация артериального давления у крыс, поэтому продолжение эксперимента нерационально.
Таким образом, проведенный эксперимент на нормотензивных стареющих крысах линии Wistar наглядно продемонстрировал, что двукратное внутрибрюшинное введение бевацизумаба, который содержит моноклональные антитела, способные селективно связываться с биологически активным фактором роста эндотелия сосудов и нейтрализовать его, также оказывает влияние на регуляцию сосудистого тонуса. И, что наиболее вероятно, основной точкой приложения действия бевацизумаба в этом случае являются периферические сосуды, о чем может свидетельствовать отсутствие существенных изменений в частоте сердечных сокращений при повышении артериального давления. При этом нарастание артериального давления после инъекции бевацизумаба происходит постепенно, уже через 2 недели после 1-й инъекции бевацизумаба уровень как систолического, так и диастолического давления достоверно отличается от исходных значений. Повышение артериального давления после 2 инъекций бевацизумаба в дозе 10 мг/кг/в неделю достигло максимальных значений через 6 недель после 1-й инъекции и остается на этом уровне еще в течение как минимум 6 недель, и только начиная с 13-й недели после 1-й инъекции бевацизумаба наблюдалось постепенное снижение показателей артериального давления до исходных значений. Полученные результаты, вероятно, обусловлены постепенным снижением передачи сигналов к VEGFR и, как следствие, снижением выработки вазодилататоров (NO и PGI2), увеличением выработки вазоконстрикторов (ЕТ-1). В свою очередь, восстановление активности сигнального пути VEGF-VEGFR у стареющих животных требует достаточно длительного времени, о чем свидетельствует сохранение повышенного артериального давления в течение 10 недель после 2 инъекций моноклональных антител к VEGF. Сохраняющаяся длительное время на стабильно высоком уровне артериальная гипертензия обусловливает поиск фармакологически активных веществ и их комбинаций для наиболее эффективного и безопасного снижения кардиотоксичности бевацизумаба.
Выводы
1. Двукратная внутрибрюшинная инъекция бевацизумаба в дозе 10 мг/кг вызывает развитие артериальной гипертензии у нормотензивных стареющих крыс линии Wistar c максимальными значениями систолического артериального давления 163,9±2,6 мм рт. ст. и диастолического артериального давления 123,2±3,2 мм рт. ст.
2. Гипертензия у нормотензивных стареющих крыс линии Wistar, вызванная двукратной внутрибрюшинной инъекцией бевацизумаба, является обратимой и имеет продолжительность около 10 недель.
3. Данная модель гипертензии у нормотензивных стареющих крыс позволяет осуществлять экспериментальный поиск наиболее оптимальных схем применения фармакологически активных веществ с целью снижения кардиотоксичности бевацизумаба.



