Повышение рождаемости в России является одной из основных медицинских и социальных задач. Во всем мире наблюдается тенденция к снижению показателя рождаемости ввиду неудовлетворительного состояния репродуктивного здоровья населения, увеличения количества бесплодных пар. Для физиологического функционирования репродуктивной системы женщины и метаболизма половых гормонов необходимы витамины, в частности витамин D. Доказано, что 1 млрд человек во всем мире имеют дефицит витамина D или его недостаточность [1]. Его дефицит негативно влияет на фертильность, процессы имплантации и развития беременности. Это связано с тем, что витамин D относится к стероидным гормонам с эндокринным, паракринным и аутокринным эффектом. Он контролирует 3% генома, влияя на различные физиологические процессы, участвует в контроле за процессами инсулинорезистентности и уровнем инсулина в крови [2]. Витамин D является регулятором эндометриальной экспрессии HOXA-10 – гена, критичного для процесса имплантации, участвует во взаимодействии эмбриона и эндометрия, с помощью различных молекулярных и цитокиновых механизмов улучшая имплантацию эмбриона [3]. Наженскую репродуктивную систему витамин D воздействует опосредованно, через стимуляцию синтеза стероидныхгормонов (эстрогенов, прогестерона, тестостерона), которые необходимы для правильного созревания фолликулов иэндометрия, поэтому вероятность наступления беременности естественным способом и при помощи экстракорпорального оплодотворения повышается у женщин с уровнем витамина D ≥30 нг/мл, также у них выше скорость имплантации [4, 5, 6]. Дефицит витамина D, по мнению экспертов Международного эндокринологического общества [7], определяется как уровень 25(OH)D в сыворотке крови менее 20 нг/мл, показатели 20–30 нг/мл должны расцениваться как недостаточность, оптимальные значения – более 30 нг/мл.
Цель исследования. Оценить взаимосвязь гинекологической заболеваемости бесплодных пациенток с уровнем обеспеченности витамином D.
Материалы и методы исследования. Проведено обследование 120 пациенток, в результате чего были выделены 2 группы. В 1-ю группу вошли 70 пациенток, имеющих диагноз «Бесплодие», выставленный согласно общепринятым критериям бесплодия. Все женщины состояли в браке и отмечали наличие регулярной половой жизни без контрацепции. Во 2-ю группу (контрольную) включены 50 женщин, не имеющих проблем с зачатием. Критериями исключения явились: трубно-перитонеальное и неуточненные формы бесплодия, сахарный диабет 1-го и 2-го типа, возраст женщин старше 40 лет. Возраст исследуемых составил от 25 до 40 лет. Всем пациенткам было проведено исследование содержания 25(ОН)D в сыворотке крови методом ИФА. Оценка состояния эндометрия проводилась с использованием пайпель биопсии эндометрия на 7–9-й день менструального цикла с последующим гистологическим и иммуногистохимическим исследованием материала, которое включало в себя определение в эндометрии маркеров иммунокомпетентных клеток, степень присутствия которых коррелирует с наличием и активностью воспалительного процесса. Степень выраженности хронического эндометрита по маркерам иммунокомпетентных клеток оценивалось по количеству позитивных клеток в поле зрения:для CD138 клеток увеличение более 3, дляCD56 – более 20 [8].
Статистический анализ проведен согласно принципам Международного комитета редакторов медицинских журналов (ICMJE) и рекомендациям «Статистический анализ и методы в публикуемой литературе» (SAMPL) [9, 10]. Анализ нормальности распределения признаков с учетом преимущественной численности исследуемых групп, равной 50 женщин и более, проводился путем оценки критерия Колмогорова–Смирнова. Учитывая распределение признаков, отличное от нормального в исследуемых группах, полученные данные представлены в виде медианы, первого и третьего квартилей: Me (Q1; Q3). Попарное сравнение изучаемых независимых групп по одному количественному признаку проводилось с помощью критерия Манна–Уитни. Номинальные данные описывались с указанием абсолютных значений и процентных долей. Сравнение номинальных данных исследования проводилось при помощи критерия χ2 Пирсона, позволяющего оценить значимость различий между фактическим количеством исходов или качественных характеристик выборки, попадающих в каждую категорию, и теоретическим количеством, которое можно ожидать в изучаемых группах при справедливости нулевой гипотезы [11]. Во всех случаях р<0,05 считали статистически значимым. Статистическая обработка результатов исследования осуществлялась с помощью пакета программ «IBM SPSS Statistics Version 25.0» (International Business Machines Corporation, США).
Результаты исследования и их обсуждение. Возраст женщин в группе пациенток с бесплодием составлял 34,0 (32,7; 34,0) лет, в группе контроля – 32,0 (31,7; 33,1) лет (U=1537,0, p=0,26). При этом количество пациенток старше 35 лет в исследуемых группах также статистически значимо не отличалось: в 1-й группе – 42,9% (30/70), во 2-й группе – 38,0% (19/50) (χ2=0,29, p=0,59). Большая часть женщин обеих групп – 74,3% (52/70) и 76,0% (38/50) соответственно – проживали в городе (χ2=0,05, p=0,83). В зарегистрированном браке состояли 60,0% (42/70) и 56,0% (28/50) пациенток в каждой соответствующей группе (χ2=0,19, p=0,66).
При анализе вредных привычек выявлено, что большинство пациенток обеих групп были некурящие: 87,1% (61/70) и 90,0% (45/50) соответственно (χ2=0,23, p=0,63).
Бесплодие у большинства женщин в 1-й группе было вторичным и составило 67,1% (47/70) от общего числа случаев.
Инфекционный пейзаж в обеих группах в большинстве статистически значимо не отличался (χ2=4,44, df=4, p=0,35). Так, в 1-й группе Chlamydiatrachomatis выявлена в 4,3% (3/70) случаев, Ureaplasmaurealyticum/Mycoplasma hominis в титре более 104определялись у 28,6% (20/70) женщин, Mycoplasmagenitalium диагностирована у 2,9% (2/70) пациенток, урогенитальный кандидоз – у 40,0% (28/70) исследуемых. Во 2-й группе данные показатели составили 2,0% (1/50), 24,0% (12/50), 2,0% (1/50) и 48,0% (24/50) соответственно (χ2=1,21, df=3, p=0,75). Исключением явился бактериальный вагиноз, который у пациенток с бесплодием встречался в 35,7% случаев (25/70), в контрольной группе – в 16,0% случаев (8/50) (χ2=5,69, p=0,02).
Женщины 1-й группы по сравнению с группой контроля чаще страдали соматической патологией (χ2=27,26, df=6, p<0,01). Так, алиментарно-конституциональное ожирение диагностировано у 45,7% (32/70) исследуемых в 1-й группе против 10,0% (5/50) – в группе контроля (χ2=17,44, p<0,001); патология щитовидной железы (гипотиреоз) выявлена у 25,7% (18/70) пациенток с бесплодием, у 4,0% (2/50) пациенток 2-й группы (χ2=9,90, p=0,002); заболевания желудочно-кишечного тракта (ЖКТ) имели место у 67,1% (47/70) и 40,0% (20/50) женщин соответственно (χ2=8,71, p=0,004). При подсчете индекса инсулинорезистентности (ИР) выявлено, что HOMA-IR в группе пациенток с бесплодием был повышен у 45,7% (32/70) против 4,0% (2/50) пациенток во 2-й группе с наличием ожирения 1-й степени (χ2=24,99, p<0,001). Различия частоты встречаемости патологии сердечно-сосудистой системы (ССС) у пациенток обеих групп были статистически не значимы: в 1-й группе частота ССС составила 30,0% (21/70), во 2-й группе – 28,0% (14/50) от общего числа случаев (χ2=0,06, p=0,81). Количество женщин с патологией органов дыхательной (ОД) и мочевыделительной систем (МВС) в обеих группах также достоверно не различалось: в 1-й группе частота указанных патологий составила 25,7% (18/70) и 28,0% (14/50), во 2-й группе – 20,0% (10/50) (χ2=0,53, p=0,46) и 30,0% (15/50) (χ2=1,59, p=0,21) соответственно (рис. 1).
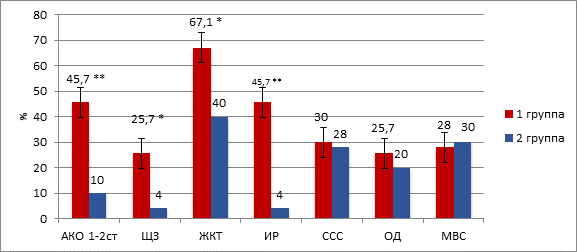
Рис. 1. Структура экстрагенитальной патологии
* – уровень статистической значимости различий p<0,05
** – уровень статистической значимости различий p<0,001
В 1-й группе отягощенный акушерский анамнез выявлен у 95,2% (42/47) пациенток с вторичным бесплодием против 36,0% (18/50) – в группе контроля (χ2=29,24, p<0,001). Так, в 1-й группе аборты имели место у 68,1% (32/47) женщин, во 2-й – у 30,0% (15/50) респонденток (χ2=14,07, p<0,001); на самопроизвольные выкидыши в анамнезе указывали 74,5% (35/47) исследуемых с вторичным бесплодием и 20,0% (10/50) – группы контроля (χ2=28,91, p<0,001); преждевременные роды имели место у 12,8% (6/47) и 2,0% (1/50) пациенток соответственно (χ2=4,19, p=0,04) (рис. 2).

Рис. 2. Отягощенный акушерский анамнез в исследуемых группах
* – уровень статистической значимости различий p<0,05
** – уровень статистической значимости различий p<0,001
Гинекологическая патология достоверно чаще встречалась у пациенток с бесплодием в сравнении с группой контроля (χ2=9,65, df=3, p=0,02). Так, у 58,6% (41/70) женщин с бесплодием были диагностированы хронические воспалительные заболевания (ХВЗ) матки и придатков, в контрольной группе данная патология выявлена у 30,0% (15/50) исследуемых (χ2=9,57, p=0,002); в 1-й группе миома матки имела место в 22,8% (16/70) случаев, во 2-й группе – в 6,0% (3/50) случаев (χ2=6,22, p=0,01); эндометриозом страдали 38,5% (27/70) пациенток с бесплодием и 10,0% (5/50) пациенток группы контроля (χ2=9,35, p=0,003); синдром поликистозных яичников (СПКЯ) выявлен у 37,1% (26/70) пациенток 1-й группы, во 2-й группе данной патологии не зарегистрировано (χ2=20,31, p<0,001) (рис. 3).
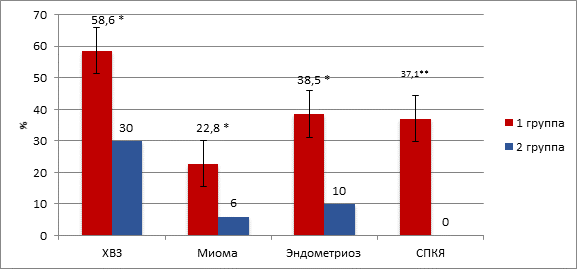
Рис. 3. Структура гинекологической заболеваемости
* – уровень статистической значимости различий p<0,05
** – уровень статистической значимости различий p<0,001
При анализе патологии шейки матки статистически значимых отличий не зарегистрировано (χ2=0,03, df=2, p=0,99). Так, хронический цервицит диагностирован у 28,5% (20/70) женщин с бесплодием против 30,0% (15/50) женщин группы контроля (χ2=0,03, p=0,87); CIN 1–2-й степени у пациенток 1-й группы выявлена в 14,2% (10/70) случаев, 2-й группы – в 14,0% (7/50) случаев (χ2=0,002, p=0,97).
В 1-й группе всем пациенткам с вторичным бесплодием (47 женщинам) проведено исследование состояния эндометрия методом пайпель биопсии с последующим гистологическим и иммуногистохимическим исследованием. В результате в 87,2% (41/47) случаев выявлен хронический эндометрит (ХЭ) в стадии обострения. Гистологическое исследование состояния эндометрия во 2-й группе проводилось у 25 пациенток, имеющих в анамнезе аборты и выкидыши и планирующих беременность, на этапе предгравидарной подготовки. Хронический эндометрит в стадии активного воспаления у данной когорты пациенток подтвержден в 40,0% (10/25) случаев (χ2=17,62, p<0,001).
Дополнительно у всех женщин обеих групп проведена оценка толщины эндометрия. Так, тонкий эндометрий (ТЭ) по данным ультразвукового исследования, диагностируемый на основании М-эхо менее 8 мм на 20-й день менструального цикла, имел место у 30,0% (21/70) женщин 1-й группы, во 2-й группе данный показатель не зарегистрирован (χ2=15,65, p<0,001) (рис. 4).

Рис. 4. Патология эндометрия в исследуемых группах
* – уровень статистической значимости различий p<0,05
Недостаток витамина D выявлен у 90,0% (63/70) пациенток 1-й группы и у 24,0% (12/50) – 2-й группы (χ2=54,21, p<0,001) (табл. 1).
Таблица 1
Содержание витамина D (нг/мл) в крови исследуемых женщин
|
1-я группа |
2-я группа |
|
12,7±1,2* |
35,5±1,1* |
* – уровень статистической значимости различий p<0,001
Уровень витамина D в 1-й группе составил 20,0 (19,5; 21,5) нг/мл, во 2-й группе – 32,3 (31,2; 33,3) нг/мл (U=392,0, p<0,001), что соответствует физиологической норме. Наиболее низкие уровни витамина D (менее 20 нг/мл) выявлены у 76,9% (20/26) пациенток с синдромом поликистозных яичников и у 63,0% (17/27) с маточной формой эндометриоза, в группе контроля данного дефицита не было зарегистрировано (χ2≥40,40, p<0,001) (рис. 5).
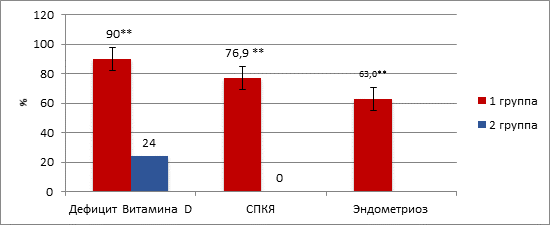
Рис. 5. Недостаток витамина D в исследуемых группах
** – уровень статистической значимости различий p<0,001
Выводы. У женщин с эндокринным бесплодием в среднем в 7 раз чаще диагностируются нарушения углеводного обмена и патологии щитовидной железы, такие как инсулинорезистентность, ожирение, гипотиреоз; в 1,9 раза чаще выявляются заболевания желудочно-кишечного тракта по сравнению с пациентками, не имеющими проблем с зачатием. У пациенток с бесплодием в 2,5 раза чаще имеют место такие гинекологические заболевания, как миома матки, эндометриоз и синдром поликистозных яичников, в сравнении с женщинами без нарушения репродуктивной функции. У женщин с проблемами зачатия в 3,5 раза чаще выявляется дефицит витамина D, особенно при наличии синдрома поликистозных яичников и эндометриоза, что делает обязательными определение его исходного уровня в сыворотке крови и восполнение недостаточности на этапе предгравидарной подготовки в программе лечения бесплодия и при планировании ЭКО.



