Химиотерапия остается одним из важнейших способов лечения онкологических больных; повышение ее эффективности в последнее время связывают с использованием новых таргетных препаратов, а также с усовершенствованием иммунотерапевтических подходов. Тем не менее, в настоящее время до 60% онкологических больных получают антрациклиновые антибиотики [1], использование которых, несмотря на их высокую противоопухолевую активность, сопровождается повышенным риском кардиотоксических проявлений, снижающих продолжительность и качество жизни пациентов. Показано, что сердечно-сосудистые заболевания занимают второе место по эпидемиологии и смертности среди пациентов, перенесших рак, и первое – среди перенесших рак молочной железы [2].
Для антрациклин-опосредованной кардиотоксичности (АОК) характерен широкий спектр клинических проявлений: аритмии, кардиомиопатия, перикардит, дисфункция левого желудочка и сердечная недостаточность [3]. В настоящее время известно, что АОК может быть острой, подострой и хронической, последнюю подразделяют на раннюю и позднюю [4]. Острая АОК, являясь редкой и обратимой, возникает в ходе антрациклиновой терапии или в течение недели после завершения последнего курса. Она проявляется в виде временной аритмии, наджелудочковой тахикардии, миокардита и острой недостаточности левого желудочка. Острая форма АОК характеризуется наличием неспецифического смещения ST-сегмента или аномалией зубца Т на ЭКГ [5]. Подострая АОК, которая, как правило, развивается в течение нескольких дней или недель после завершения последнего курса химиотерапии, протекает в виде острой сердечной недостаточности, миокардита и перикардита [6]. Ранняя хроническая АОК возникает в течение года после завершения антрациклиновой терапии, характеризуется систолической или диастолической желудочковой дисфункцией с развитием дилатационной кардиомиопатии, уменьшением массы и стенки левого желудочка. Кроме того, возможны и другие проявления: нарушения ритма и проводимости сердца, повреждения сердечных клапанов и снижение сократимости [7].
Показано, что клинические симптомы поздней АОК обнаруживаются спустя годы после завершения химиотерапии. Скрытый, бессимптомный характер протекания данной формы АОК приводит к манифестации дилатационной и рестриктивной кардиомиопатии и в итоге – к возникновению застойной сердечной недостаточности. Для поздней АОК характерна высокая смертность пациентов – более 50% [7]. Более того, показано, что после появления симптомов АОК очень трудно получить положительные результаты лечения, и прогноз у пациента ухудшается [8].
Следствием указанных выше особенностей является то, что диагностика АОК существенно осложняется, а использования клинико-инструментальных методов (электро- и эхокардиографии) недостаточно для своевременного выявления кардиотоксических осложнений и коррекции терапевтической стратегии. Длительный бессимптомный период течения АОК и поздняя диагностика посредством известных клинико-инструментальных методов побудили исследователей сосредоточить внимание на поиске маркеров, способных прогнозировать риски и выявить ранние сердечно-сосудистые изменения на фоне проводимой химиотерапии.
На основании проведенного анализа литературы наиболее перспективными маркерами развития АОК в настоящее время являются следующие: галлектин-3 (Gakectin-3), N-концевой фрагмент предшественника мозгового натрийуретического пептида (NTproBNP), параоксоназа 1 (PON1), миелопероксидаза (MPO) [9].
Целями исследования являлись исследование влияния антрациклин-содержащей терапии на содержание выбранных показателей в плазме крови больных раком молочной железы (РМЖ) и поиск маркеров, чувствительных к проявлениям антрациклин-опосредованной кардиотоксичности.
Материал и методы исследования. В исследование вошли 280 пациенток (медиана возраста – 50 лет, размах варьирования – от 22 до 71 года) европеоидного типа с РМЖ без диагностированных сердечно-сосудистых изменений на дохимиотерапевтическом этапе, проходивших лечение на базе ФГБУ «НМИЦ онкологии» в 2019–2020 гг. Всем пациенткам было назначено проведение четырех курсов химиотерапии с антрациклиновыми антибиотиками по схеме АС: доксорубицин 60 мг/м2+ циклофосфамид 600 мг/м2 в/в капельно в 1 день каждые 3 недели. Перед началом проведения курсов химиотерапии на основании результатов обследования (электрокардиографии, эхокардиографии) и с учетом анамнеза были выбраны пациентки без диагностированных сердечно-сосудистых изменений. В дальнейшем пациенток наблюдали в течение как минимум 8 месяцев.
У пациенток до начала химиотерапии и после 4-го курса была забрана кровь из локтевой вены по стандартной методике с дальнейшим получением плазмы крови, в которой методом твердофазного иммуноферментного анализа определяли концентрацию PON1, NT-ProBNP, Galectin 3 и MPO с использованием тест-систем ELISA производства Cloud-Clone Corp. (Wuhan, China/USA) в соответствии с инструкциями фирмы-производителя.
Оценку результатов анализа осуществляли с использованием комплекса, включающего планшетный анализатор иммуноферментных реакций АИФР-01 (УНИПЛАН, Россия); вошер «Аквамарин» (BioSan, Россия), микропланшетный шейкер-термостат StatFax-2200 (Awareness Techology, USA).
Статистический анализ полученных результатов проводили в программной вычислительной среде R 4.0.4 [10]. Анализ предполагал расчет основных статистических характеристик выборок, определение характера распределения определяемых показателей с использованием критерия Шапиро–Уилка. Так как полученные данные имели ненормальное распределение, результаты представлены в виде медианы (Me) и интерквартильного размаха – 25-й и 75-й процентили (Ме [LQ; UQ]). Достоверность отличий между выборками оценивалась с использованием непараметрического критерия Вилкоксона. Результаты считали статистически значимыми при p<0,05.
Проведенные исследования выполняли в соответствии с принципами Хельсинской декларации, разработанной Всемирной медицинской ассоциацией.
Результаты исследования и их обсуждение
На основании результатов обследования (электрокардиографии, эхокардиографии), проведенных до и после четырех курсов химиотерапии, пациентки были разделены на две группы: группа 1 (257 человек) без диагностированных сердечно-сосудистых изменений; группа 2 (23 человека) – пациентки с подострой и ранней хронической формой АОК.
Проведенный ранее обзор имеющихся в настоящее время перспективных маркеров развития кардиологических осложнений у онкологических больных позволил выбрать для исследования показатели, которые отражают изменение антиоксидантного статуса (МРО, PON1), а также структурные изменения сердечной мышцы (Galectin 3, NTproBNP), вызванные применением антрациклиновых антибиотиков.
Результаты определения выбранных маркеров в плазме крови больных РМЖ обеих групп представлены в таблице.
Концентрация маркеров в плазме крови больных РМЖ с и без признаков АОК, Ме [LQ; UQ]
|
|
Группа 1, n=257 |
Группа 2, n=23 |
р, Группа1/Группа 2 |
|||||
|
До химиотерапии |
После химиотерапии |
р |
До химиотерапии |
После химиотерапии |
р |
До химиотерапии |
После химиотерапии |
|
|
Galectin-3, нг/мл |
11,3 (8,7; 15,8) |
9,69 (8,3; 13,4) |
0,181 |
9,77 (7,9; 12,4) |
9,7 (8,5; 15,7) |
0,781 |
0,202 |
0,940 |
|
NTproBNP, пг/мл |
51,7 (25,7; 108) |
61,0 (60,6; 68) |
0,748 |
40,3 (27,4; 87,2) |
30,0 (28,6; 33,3) |
0,392 |
0,825 |
0,149 |
|
MPO, мкг/мл |
13,6 (4,8; 16,3) |
16,5 (3,5; 21,2) |
0,712 |
12,5 (2,5; 20,8) |
2,5 (2,0; 2,72) |
0,179 |
0,654 |
0,124 |
|
PON1, нг/мл |
2,12 (1,24; 2,58) |
2,58* (2; 3,3) |
0,018 |
2,71** (2,5; 3,11) |
3,32* ** (3,3; 4,0) |
0,007 |
0,0002 |
0,026 |
Примечание: * – статистически значимые отличия по сравнению со значением показателя до химиотерапии; ** – статистически значимые отличия по сравнению со значением показателя в группе 1 (до и после химиотерапии).
Из представленных результатов видно, что у обследованных нами пациенток только один показатель – PON1 – имел статистически значимые изменения. Использование в курсе химиотерапии антрациклиновых антибиотиков у пациентов с РМЖ в обеих обследованных группах после 4-го курса терапии сопровождалось статистически значимым увеличением содержания параоксаназы 1. Так, данный показатель у пациенток 1-й группы, без АОК после 4 курсов проведенной терапии был на 22% выше по сравнению с его уровнем до начала терапии, составив 2,58 (2,0; 3,3) против 2,12 (2,54; 3,11), р=0,018. Во 2-й группе, с развившейся далее АОК, концентрация PON1 после лечения в рассматриваемые сроки также была на 23% выше соответствующих значений до начала терапии, составив 3,32 (3,3; 4,0) против исходных 2,71 (2,54; 3,11), р=0,007 (табл., рис. А).
А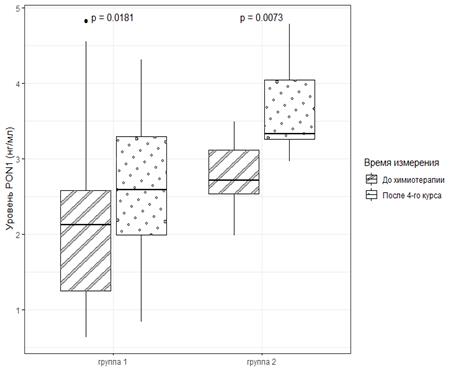
Б 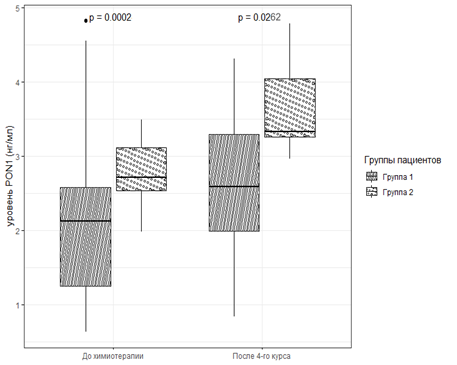
Сравнение уровня PON1 в плазме крови в группе больных без признаков АОК (А) и в группе с диагностированной кардиотоксичностью; (Б) до химиотерапии и после 4-го курса химиотерапии
Проведенные исследования показали, что у пациенток концентрация параоксоназы 1 в плазме крови отличалась между группами как перед началом, так и после проведенных 4 курсов химиотерапии. Так, содержание PON1 оказалось статистически значимо больше (на 28% и 29% соответственно) до и после химиотерапии в группе пациенток с развившейся АОК (группа 2) по сравнению со значением в группе без кардиологических осложнений (табл., рис. Б).
В настоящее время показана особая роль свободно-радикальных процессов как в поддержании нормального функционирования клеток организма, так и в условиях развития функциональных и патологических процессов. Структурно-функциональные изменения кардиомиоцитов и ткани сердца в целом, развивающиеся в условиях нарушения сосудистого русла, сопровождаются закономерными изменениями в интенсивности свободно-радикальных процессов с увеличением образования активных форм кислорода (АФК), нарушением активности компонентов антиоксидантной системы. При этом показано, что окислительный стресс играет ключевую роль в патогенезе АОК и связан с действием использующихся для терапии препаратов на протекающие в миокарде метаболические процессы. Проникающие в миокард антрациклины, такие как доксорубицин, подвергаются трансформации в семихиноны за счет взаимодействия с АФК, продуцируемыми различными прооксидантными ферментами [10], в том числе и НАДФН-оксидазой (NOX).
В нормальных условиях генерация АФК в клетке нивелируется активностью ферментов антиоксидантной линии защиты, в число которых входит широкий спектр биологических катализаторов, в том числе параоксоназы. Это семейство представлено тремя ферментами – PON1, PON2 и PON3. Первая и третья изоформы синтезируются в печени, после чего выделяются в кровоток, где пребывают в связанном с липопротеинами высокой плотности состоянии. Вторая изоформа локализуется в митохондриях дофаминэргических нейронов и астроцитов, в меньшем количестве обнаруживается в митохондриях легких, печени, почек, сердца, тонкого кишечника и других органах [11]. Особенности активного центра параоксоназ обусловливают широкий спектр катализируемых реакций. Следует отметить, что для PON1 показаны все типы активностей, характерных как для PON2 (лактоназная и слабая арилэстеразная активность), так и для PON3, которая проявляет высокие лактоназные, слабые арилэстеразные и параоксоназные свойства [12]. Кроме того, все изоформы участвуют в защите от окислительного стресса за счет реализации пероксидазной активности [13].
M.P. Kasprzak et al. показано, что ишемические изменения, возникающие после стентирования левой главной коронарной артерии, могут вызывать генерацию PON1 и обусловливать повышение уровня данного фермента в сыворотке крови больных со стенозом левой главной коронарной артерии [14]. Можно предположить, что аналогичный механизм реализуется и у больных с кардиотоксическими проявлениями, у которых уровень PON1 повышался в ходе химиотерапевтического лечения и был выше по сравнению с группой без сердечно-сосудистых осложнений.
Таким образом, можно предположить, что увеличение содержания PON1 является одним из универсальных адаптационных механизмов приспосабливания ткани миокарда к ишемическим нарушениям, проявляющимся также в условиях использования антрациклин-содержащих препаратов при лечении пациентов с онкологическими заболеваниями.
Заключение. АОК остается одной из актуальных проблем, в том числе и в онкологической практике, ввиду широкого использования высокоэффективных препаратов данного ряда для лечения основного заболевания. Длительный бессимптомный период, дефицит информативных методов прогнозирования и диагностики развития АОК приводят к необходимости поиска новых подходов, которые снизили бы риски возможных осложнений у онкологических больных. Результаты нашей работы открывают перспективы для дальнейших исследований и разработок в области диагностики сердечно-сосудистых осложнений у онкологических больных на фоне антрациклин-содержащей терапии.
Финансирование осуществлялось в рамках государственного задания «Молекулярно-генетические предикторы сердечно-сосудистых осложнений у больных раком молочной железы, подвергнутых лекарственной терапии».



