На сегодняшний день очевидно, что раздражители, не несущие антигенную информацию, воздействуя на организм, способны изменять функциональную активность его факторов врожденного иммунитета [1, 2]. Также неоднократно в литературе встречаются упоминания об активации факторов врожденного иммунитета, в том числе лизоцима, в течении аутоиммунных заболеваний, а именно при повреждении тканей организма иммунными комплексами, а в дальнейшем – и при высвобождении факторов неспецифической резистентности [3, 4].
Боль в этом отношении не является исключением: во-первых, как субъективное чувство, сопровождающееся реакцией органов и систем, в том числе нервной и эндокринной; во-вторых, в силу причин своего возникновения, значительная часть которых не имеет иммунологической основы. Особенно это касается острой боли.
При общей однонаправленности изменений имеются отличия в конфигурации ответа на острую соматическую, висцеральную и нейропатическую боль. В доступной литературе анализа особенностей изменения лизоцима при различных видах боли нами не выявлено, что позволило обосновать актуальность нашего исследования.
Цель исследования – установить возможность и особенности вовлечения лизоцима в алгогенный процесс.
Задачи исследования:
1. Изучить реакцию лизоцима на острую соматическую боль.
2. Изучить реакцию лизоцима на острую висцеральную боль.
3. Изучить реакцию лизоцима на острую нейропатическую боль.
Материал и методы исследования
В основу работы положен материал экспериментальных исследований. Опыты производились на взрослых белых крысах-самцах. Первую группу составили интактные животные (контрольная группа) (n=20). У животных второй группы воспроизводили острую соматическую боль (n=15). Животным третьей группы наносилось раздражение, вызывающее острую висцеральную боль (n=10). У животных четвертой группы моделировали острую нейропатическую боль (n=10).
В каждой опытной группе животные подвергались алгогенному воздействию с последующим забором у них исследуемой крови через 2, 30, 60, 120 и 180 мин после болевого эксцесса.
Острая боль (ОБ) 3–4-й степени в соответствии с критериями А.В. Вальдмана, Ю.Н.Васильева в модификации В.Г. Овсянникова [5] воспроизводилась нанесением электрораздражения на прикорневую зону хвоста крысы, прямую кишку и отпрепарированный седалищный нерв.
Острая боль одинаковой интенсивности для каждого ее вида достигалась путем эмпирического манипулирования параметрами электротока, генерируемого электростимулятором ЭЧС-2. Критериями достижения боли являлись поведенческие и вегетативные реакции животных.
Пробы крови центрифугировались в течение 20 мин при 1500 об/мин.
Активность лизоцима в сыворотке определялась методом нефелометрии (В.Г.Дорофейчук, 1968) [6].
Критерием активности лизоцима является изменение интенсивности регистрируемого светового потока при прохождении через взвесь микрококка опытной пробы по отношению к исходной. Суточную культуру M. lysodeiticus смывают с агаровой среды, подвергают фильтрации и стандартизируют на фотоэлектрокалориметре (ФЕК-56) в кювете с рабочей длиной 3 мм. В работе используется светофильтр с пропусканием луча длиной 540 мкм. Исследовалась сыворотка в разведении взвесью микрококка 1:50. Смесь термостатируется в течение 1 ч при t=37°C, после чего вновь нефеламетрируется. По разности показателей судят об активности лизоцима.
Содержание животных и манипуляционные действия над ними осуществлялись в соответствии с требованиями Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях.
При исследовании и трактовке цифрового материала применяли статистический анализ данных с помощью пакетов программ Microsoft Office Excel 2010 Pro, STATISTICA 10.0. Для рядов, не включающих нормальные значения, рассчитываются: медиана (Me), квантили (Q0,25 – нижняя квантиль, Q0,75 – верхняя квантиль), интервал определения медианных значений (Me) минимального значения (Min) до максимального (Max). Оценивали нормальность распределения полученных данных по критериям Колмогорова–Смирнова и поправки к ним Лиллиефорса. Сравнение данных, не подчиняющихся нормальному закону, проводили на основе U-критерия Манна–Уитни. Критическое значение уровня значимости (р) будет приниматься равным 0,05.
Результаты исследования и их обсуждение
Исследование активности лизоцима у интактных крыс имеет следующие цифровые характеристики: Мелиз – 0,264 ед [Q0,25 – 0,239 ед; Q0,75 – 0,299 ед], Min – 0,115 ед, Max – 0,307 ед.
Эти результаты приняты нами как контрольные значения, и с ними проводилось сравнение всех последующих экспериментов.
При воспроизведении острой соматической боли активность лизоцима через 2 мин после начала эксперимента: Мелиз=0,473 ед [Q0,25 – 0,396 ед; Q0,75 – 0,485 ед], Min – 0,338 ед, Max – 0,502 ед.
По истечении 30 мин от начала эксперимента Мелиз=0,389 ед [Q0,25 – 0,371 ед; Q0,75 – 0,4812 ед], Min – 0,309 ед, Max – 0,426 ед.
Через 1 ч Мелиз=0,175 ед [Q0,25 – 0,134 ед; Q0,75 – 0,273 ед], Min – 0,101 ед, Max – 0,322 ед.
Спустя 2 ч от момента болевого раздражения Мелиз=0,102 ед [Q0,25 – 0,085 ед; Q0,75 – 0,188 ед], Min – 0,031 ед, Max – 0,375 ед.
По завершении эксперимента Мелиз=0,106 ед [Q0,25 – 0,091 ед; Q0,75 – 0,131 ед], Min – 0,076 ед, Max – 0,208 ед.
На представленном графике (рис. 1) видно, что алгогенное воздействие вызвало рост активности лизоцима, она сохранялась в течение получаса, показатели имеют статистически высокозначимое различие по сравнению с контролем.
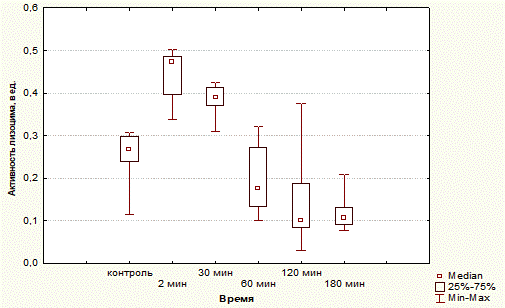 |
Выявленная реакция не носит стойкого характера. Уже через 1 ч активность лизоцима падает, а в последующие 2 ч становится ниже исходной, и это падение по сравнению с контролем статистически высокозначимо.
Таким образом, острая соматическая боль сопровождается резким ростом активности лизоцима, реакция непродолжительна и быстро сменяется депрессией.
При изучении эффектов острой висцеральной боли через 2 мин после болевого раздражения Мелиз=0,263ед, [Q0,25 – 0,229 ед; Q0,75 – 0,284 ед] Min – 0,183 ед, Max – 0,305.
По истечении 30 мин после алгогенного воздействия Мелиз=0,333ед [Q0,25 – 0,310 ед; Q0,75 – 0,380 ед] Min – 0,285 ед, Max – 0,0,410 ед.
Спустя 1 ч Мелиз=0,299 ед [Q0,25 – 0,280 ед;Q0,75 – 0,304 ед] Min – 0,251 ед, Max – 0,310 ед.
Через 2 ч активность лизоцима характеризуется следующими значениями: Мелиз=0,275 ед [ Q0,25 – 0,233 ед; Q0,75 – 0,290 ед] Min – 0,185 ед, Max – 0,301 ед.
В конце эксперимента, т.е. через 3 ч, Мелиз=0,259 ед [Q0,25 – 0,231 ед ;Q0,75 – 0,291 ед] Min – 0,181 ед, Max – 0,320 ед. Результаты представлены на рисунке 2.
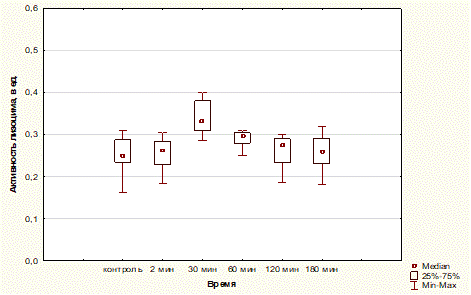 |
Таким образом, анализ цифрового материала наглядно демонстрирует, что возникшее через 30 мин увеличение активности лизоцима статистически высокозначимо отличается от исходного уровня, и только через 1 ч наблюдается легкая тенденция снижения активности почти до исходного уровня, а далее показатели не имеют статистически значимых отклонений от контрольных значений.
При воспроизведении острой нейропатической боли через 2 мин после электрораздражения седалищного нерва Мелиз=0,498 ед [Q0,25 – 0,489 ед; Q0,75 – 0,522 ед] Min – 0,483 ед, Max – 0,534 ед. Резкое повышение активности лизоцима сохраняется в течение 2 ч.
Через 30 мин Мелиз=0,504 ед [Q0,25 – 0,496 ед; Q0,75 – 0,520 ед] Min – 0,484 ед, Max – 0,531 ед.
Через 60 мин Мелиз=0,491 ед [Q0,25 – 0,489 ед; Q0,75 – 0,505 ед] Min – 0,422 ед, Max – 0,597 ед.
Через 2 ч после болевого воздействия
Мелиз=0,487 ед [Q0,25 – 0,478 ед; Q0,75 – 0,501 ед] Min – 0,430 ед, Max – 0,507 ед.
В течение 3-го ч наблюдается критическое снижение активности фермента Мелиз=0,299 ед [Q0,25 – 0,284 ед; Q0,75 – 0,318 ед] Min – 0,257 ед, Max – 0,332 ед.
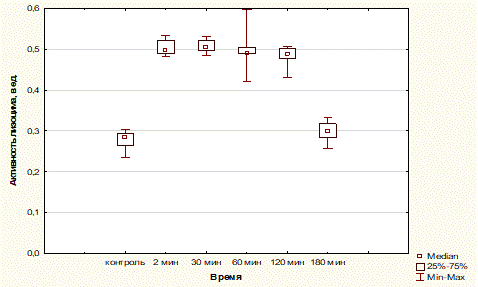 |
Статистический анализ выявил высокозначимое отличие значений, характеризующих активность лизоцима через 2 мин, 30 мин, 60 мин и 120 мин, от контрольных значений.
Казалось бы, изменения активности лизоцима должны иметь одинаковую конфигурацию независимо от вида боли, поскольку уровень ее интенсивности в каждой серии экспериментов достигал 3–4 баллов по избранной шкале.
Сопоставление результатов свидетельствует о том, что следствием каждого вида боли является неодинаковый характер изменения активности лизоцима.
При соматической боли возникает стремительное и непродолжительное повышение активности исследуемого субстрата, уже через 30 мин отмечается выраженная тенденция падения активности ниже контрольных значений. В последующие 2 ч понижение активности принимает стойкий характер и сохраняется на низких цифрах до конца эксперимента.
При формировании висцеральной боли реакция носит инертный характер. Через 2 мин активность лизоцима не меняется, через 30 мин повышается, однако по своим значениям это увеличение ниже, чем при соматической боли. Через 1 ч уровень активности фермента приближается к исходному, а в последующие 2 ч не имеет существенных отличий от контрольных значений.
Острая нейропатическая боль характеризуется стремительным, выраженным и стойким повышением активности исследуемого субстрата, которая сохраняется в течение 2 ч и далее по завершении 3-го ч возвращается к исходным значениям.
Острая соматическая боль вызывает активацию симпатоадреналового звена управления [7]. По данным Ю.И. Шилова, катехоламины, раздражая α-адренорецепторы нейтрофилов, изначально мобилизуют их функциональную активность [2]. Надо полагать, что следствием этого являются усиленная выработка и сброс ими лизоцима. Повышение концентрации катехоламинов в динамике эксперимента достигает порога чувствительности β-адренорецепторов, последние тормозят активность нейтрофилов [8]. Дальнейшая наработка субстрата становится ограниченной, а так как лизоцим быстро разрушается в крови ферментами, его уровень падает ниже контрольных цифр.
Сложнее объяснить динамику изменения активности лизоцима при висцеральной боли. Ранее нами было показано, что после острого болевого эксцесса уровень нейтрофилов резко падает. Очевидно, это связано с маргинальным смещением форменных элементов к стенке сосудов, их фиксацией и готовностью к выходу за ее пределы [9]. Однако висцеральная боль сопровождается вагусными эффектами по определению.
Считается установленным, что на нейтрофилах имеются H-холинорецепторы. В пользу этого говорят следующие факты: ссылаясь на труды Fujii T. с соавт. (2017) [10] и M.J.Mulcahy с соавт. (2017) [11], свидетельствующие о наличии холинорецепторов, коллектив исследователей показал, что воздействием на нейтрофилы агонистами и антогонистами ацетилхолина достигается изменение их функциональной активности [12]. По данным этих авторов, в процесс вовлекаются α7-, α3β2- или α6-холинорецепторы.
Показано также, что стимуляция H-холинорецепторов клеток фагоцитарно-моноцитарной системы приводит к редукции их функции [13].
Раздражение холинорецепторов нейтрофилов и, видимо, других лейкоцитов – продуцентов лизоцима медиаторами парасимпатической нервной системы вызывает торможение их функции. Очевидно, этот фактор не позволяет развернуться реакции так масштабно, как при соматической боли: реакция запаздывает и менее выражена, следует думать, что полностью депрессия продукции лизоцима не наступает, а сохраняется ее базальный уровень.
Резкое повышение активности лизоцима и стойкий характер этой реакции при нейропатической боли могут быть связаны с непосредственным раздражением нерва и направлением движения боли непосредственно в структуры мозга, запуском симпатоадреналового звена управления и, как следствие, мобилизацией биосинтеза лизоцима.
В завершение стоит отметить, что понимание различий механизмов активации факторов врожденного иммунитета, в частности лизоцима, предполагает более персонализированный подход к медикаментозному лечению боли различного генеза. Также не стоит забывать про существенную роль лизоцима в контексте дифференциальной диагностики боли: подразумевается, что он может выступать в роли маркера наличия сильной боли в организме, к тому же сочетание с повышенной его концентрацией с определением различных типов рецепторов нейтрофилов в равной мере подразумевает индивидуальный подход к дальнейшему лечению пациентов с разными видами боли.
Выводы
1. Острая боль независимо от ее природы вызывает повышение активности лизоцима в периферической крови.
2. Соматическая боль сопровождается резкой и быстро истощаемой реакцией активации лизоцима за счет раздражения α-адренорецепторов нейтрофилов.
3. Висцеральная боль сопровождается инертным типом реакции повышения активности лизоцима, основополагающей в данных реакциях можно считать роль Н-холинорецепторов нейтрофилов за счет торможения их функции медиаторами парасимпатической системы.
4. Нейропатическая боль сопровождается выраженной и стойкой реакцией повышения активности лизоцима благодаря активации симпатоадреналовой системы.
5. На основе изучения различий механизмов активации боли можно рассматривать белее персонализированный подход в диагностике и лечении боли различного генеза.



