Рак пищевода остается одним из самых распространенных онкозаболеваний и занимает шестую позицию в структуре смертности в мире [1]. Химиолучевая терапия в сочетании с хирургическим вмешательством является основным стандартом лечения пациентов с местнораспространенным заболеванием, однако пятилетняя выживаемость остается на уровне 20% по причине рецидива и метастазирования после терапии. Увеличение дозы облучения не повышает эффективность и приводит к высокой токсичности нормальной ткани [2]. Улучшить терапевтический эффект может позволить таргетная регуляция сигнальных путей, участвующих в онкогенезе рака пищевода.
Сигнальный путь Hedgehog (Hh) играет фундаментальную роль в эмбриональном развитии, формировании тканевого паттерна и заживлении ран [3]. Дисрегуляция данного пути может являться причиной онкозаболеваний различной локализации. Канонический Hh инициируется высвобождением трех лигандов: Sonic Hedgehog (SHH), Desert Hedgehog (DHH) и Indian Hedgehog (IHH). В отсутствии данных лигандов трансмембранный рецептор Patched1 (PTCH1) оказывает ингибирующее действие на белок Smoothened (SMO). Связывание лигандов с PTCH1 приводит к активации SMO и его транслокации к первичной ресничке. Первичная ресничка представляет собой покрытый мембраной выступ, обычно описываемый как одиночная неподвижная ресничка, присутствующая во множестве клеток позвоночных. Транслокация SMO инициирует внутриклеточный сигнальный каскад, который способствует активации факторов транскрипции глиома-ассоциированного онкогена (GLI). После активации в первичной ресничке GLI отделяется от SUFU (suppressor of fused) и перемещается в ядро, чтобы запустить программу транскрипции, связанную с Hh [4]. Известно, что сверхэкспрессия GLI сопряжена с метастазированием и негативным прогнозом при плоскоклеточном раке пищевода [5]. В доклинических исследованиях было показано, что экспрессия GLI была повышена в опухолевых клетках, устойчивых к ингибиторам EGFR и лучевой терапии [3; 6].
Цель нашей работы - выбор оптимальной дозы облучения и поиск генов-мишеней сигнального пути Hh, которые могли бы лечь в основу таргетной терапии и повысить эффективность лучевого лечения плоскоклеточного рака пищевода.
Материал и методы исследования
Ортотопические ксенографты плоскоклеточного рака пищевода
В качестве объекта исследования использовали ортотопические мышиные PDX-модели плоскоклеточного рака пищевода. Способ получения таких моделей описан в работе C.О. Кит и др. [7] и, возможно, их применение для обеспечения объективной оценки эффективности противоопухолевых средств и технологий в отношении конкретных пациентов [8]. Для создания ортотопической PDX-модели плоскоклеточного рака пищевода была выбрана умереннодифференцированная опухоль без ороговения. Для исследования лучевого воздействия использовали 6-ю генерацию PDX-модели плоскоклеточного рака пищевода на 25 самках мышей линии Balb/c Nude, разделенных на 5 групп, n=5 (табл. 1). Время наблюдения составило 15 суток.
Таблица 1
Распределение мышей по группам в соответствии с режимами облучения
|
№ группы |
Количество мышей в группе |
Разовая доза облучения, Гр |
Суммарная доза облучения, Гр |
|
(контроль) |
5 |
0 |
0 |
|
1 |
5 |
4 |
16 |
|
2 |
5 |
6 |
24 |
|
3 |
5 |
8 |
32 |
|
4 |
5 |
10 |
40 |
Облучение животных проводили при помощи аппарата Xstrahl 150 с фильтром 1 (Al 0,2) и аппликаторами 1,5 и 2 см. Объем опухолевых узлов рассчитывали по формуле Шрека для эллипсоида V=а×в×с×p/6, где V – объем опухоли (мм3), а, в, с – максимальные диаметры эллипсоида в трех плоскостях (мм).
Выделение РНК и определение экспрессии генов сигнального пути Hh
В исследовании проводили измерение экспрессии 6 генов (SHH, IHH, PTCH1, PTCH2 GLI1 и SMO), регулирующих сигнальный путь Hh, после каждого применения разовой дозы облучения. Экспрессию генов определяли в опухолевой РНК, предварительно экстрагированной согласно рекомендациям производителя TRIzol. Дополнительно очистку препаратов РНК проводили с помощью набора miRNAminiKit (Qiagen, Германия). Полученные образцы суммарной РНК обрабатывали препаратами ДНК-азы 1 (ThermoFisher, США) для удаления геномной ДНК. Концентрацию нуклеиновых кислот оценивали на флуориметре Qubit (Thermo Fisher, США) согласно инструкции производителя. Синтез кДНК на РНК-матрице проводили с использованием набора MMLV Reverta («Синтол», Россия). Методом RT-qPCR определяли величины относительной экспрессии 8 генетических локусов: SHH, IHH, PTCH1, PTCH2, GLI1 и SMO. В качестве референсных, после серии предварительных экспериментов, использовали гены PSMC, TBP и RPLO. Стабильность экспрессии для подбора референсных генов оценивали с помощью программы geNorm [9].
Дизайн специфичных олигонуклеотидных праймеров осуществляли с использованием референсных последовательностей NCBI GenBank и программы Primer-BLAST. Последовательности праймеров представлены таблице 2.
Таблица 2
Последовательности праймеров, используемых в RT-qPCR
|
Ген |
Последовательность прямого праймера |
Последовательность обратного праймера |
|
SHH |
CACTATGAGGGTCGAGCAGTG |
GTGGATGTGAGCTTTGGATTC |
|
IHH |
GCATTGCTCTGTCAAGTCTGA |
TCTCCTGGCTTTACAGCTGAC |
|
PTCH1 |
CTGCTGGGTGTACTGATGCTT |
AGCAGAACCAGTCCATTGAGA |
|
PTCH2 |
CTCCGCTCAGGTCATTCAGAT |
GGAGGCAAAATGGTGACTACA |
|
GLI |
TCCTCTCATTCCACAGGACAG |
CTGGTATGGGAGTTCCTGGTT |
|
SMO |
AGATTGTTTGCCGAGCAGAT |
CCACGAACCAGACTACTCCAG |
Статистический анализ
Статистический анализ результатов выполняли с использованием вычислительной программной среды R 4.0.4 и пакета Heatmaps. Статистическую достоверность отличий уровня экспрессии генов в исследуемых группах по сравнению с контрольной определяли с помощью непараметрического критерия Манна-Уитни для порогового уровня статистической значимости p<0,05. Нулевую статистическую гипотезу об отсутствии различий отвергали при пороговом уровне p<0,05.
Результаты исследования и их обсуждение
В исследовании дозозависимое влияние радиации на PDX-модели плоскоклеточного рака пищевода оценивалось в 5 группах. Контрольная группа включала 5 PDX-моделей без облучения. Четыре группы подвергались разовому и суммарному облучению в соответствии с таблицей 1.
Радиация значительно задерживала рост, что демонстрирует рисунок 1А – торможение роста опухоли в зависимости от дозы и 1Б – изменение объема опухоли во времени в зависимости от условий.
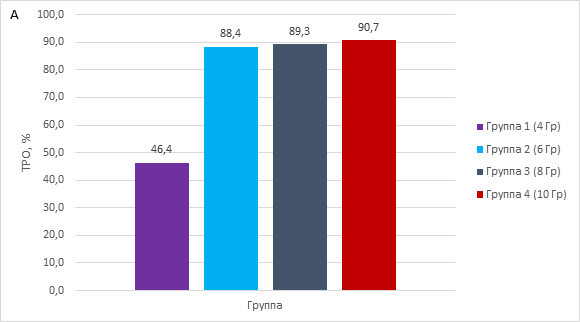
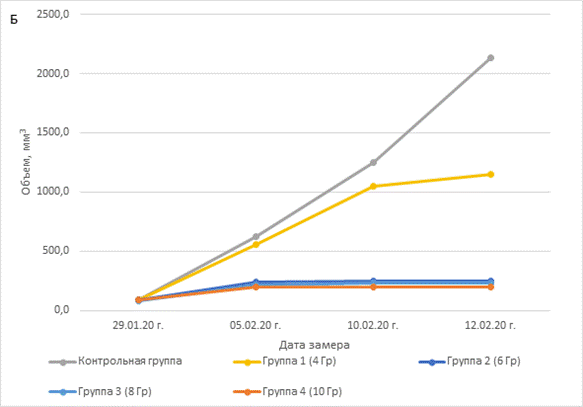
Рис. 1. A – влияние доз радиации на торможение роста опухоли. Б – влияние доз радиации на объем опухоли
Наименьший противоопухолевый эффект радиационного воздействия демонстрировала группа PDX-моделей, получавших разовое облучение 4 Гр, но после накопления суммарной дозы в 16 Гр объемы опухолей отличались от контрольной группы. Выраженный эффект влияния радиации на рост опухоли наблюдался уже при 6 Гр (суммарная доза 24 Гр) и более, эти группы демонстрировали процент торможения роста опухоли от 88,4 и более. Статистически достоверное отличие в росте опухоли экспериментальных PDX-групп от контрольной наблюдалось при воздействии 8 Гр (суммарная доза 32 Гр, p=0.0127) и 10 Гр (суммарная доза 40 Гр, p=0,0001). Здесь наблюдался объем опухоли не более 250 мм3, этот объем фиксировался уже после второго воздействия (рис. 1Б). Полученные данные свидетельствуют, что минимальной эффективной суммарной дозой радиационного воздействия против PDX-модели плоскоклеточного рака пищевода является доза в 16 Гр.
Все модели демонстрировали схожие ответы участников сигналлинга на радиационное воздействие. Уровни SHH, GLI1 и IHH в опухолевой повышались в 1,1–5,5 раза после облучения (p <0,05) без дозозависимого эффекта. В противоположность этому PTCH1, PTCH2 и SMO не демонстрировали статистически достоверных изменений (табл. 3, рис. 3).
Таблица 3
Изменение транскрипционной активности сигнального пути Hh под воздействием радиации
|
Группа/доза |
PTCH1 |
GLI1 |
SMO |
SHH |
PTCH2 |
IHH |
|
Группа 1 (4 Гр) |
2,28 |
2,90 |
3,25 |
1,71 |
0,77 |
2,60 |
|
Группа 2 (6 Гр) |
1,67 |
1,53 |
3,91 |
1,20 |
1,74 |
1,81 |
|
Группа 3 (8 Гр) |
1,40 |
3,47 |
3,97 |
1,12 |
2,73 |
3,63 |
|
Группа 4 (10 Гр) |
1,73 |
2,18 |
2,78 |
1,21 |
0,69 |
2,95 |
Примечание. Серым цветом выделены ячейки со статистически значимыми значениями (p<0.05).
Транскрипционная активность исследуемых генов (рис. 2) демонстрирует более высокие уровни в опухолевой ткани пищевода без воздействия радиации относительно нормальной ткани пищевода [10]. После воздействия радиационного облучения происходит еще большее увеличение транскрипционной активности генов сигнального пути Hh (табл. 3, рис. 3).
Рис. 2. Взаимодействие белков исследуемых генов
Активация сигнального пути Hh представляется потенциальным ответом на облучение. Экспериментальные исследования по ингибированию генов-компонентов сигнального пути демонстрируют повышение радиосенсибилизации на мышиных моделях плоскоклеточного рака пищевода в зависимости от уровней экспрессии данных генетических локусов [11]. Канцерогенез рассматривается как неправильная реализация гомеостатических механизмов, участвующих в восстановлении тканей и самообновлении стволовых клеток. Такая модель очень удобна для характеристики плоскоклеточного рака пищевода, поскольку многие случаи развиваются из пищевода Барретта - вызванное рефлюксом воспаление и повреждение эпителия пищевода [12]. В более широком смысле, облучение опухолей пищевода может вызывать те же ответы, которые используются во время нормального восстановления, включая активацию Hh. Сигнальный путь Hh нивелирует контрольные точки клеточного цикла и способствует пролиферации, несмотря на радиационно-индуцированное повреждение ДНК [13].
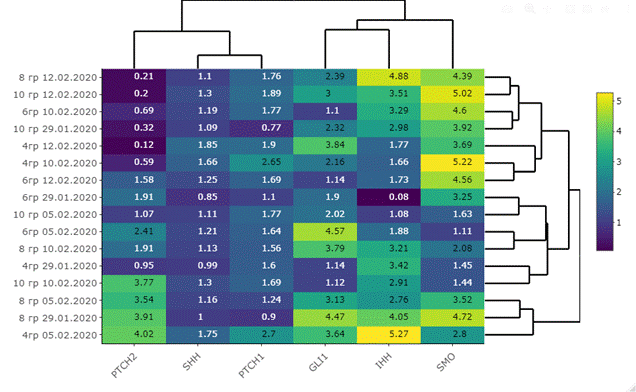
Рис. 3. Тепловая карта дифференциальной экспрессии исследуемых генов в облученной опухолевой ткани относительно не облученной
Существует множество клинических испытаний с участием только ингибиторов сигнального пути Hh или в комбинации со стандартной терапией рака аэродигестивного тракта. Эффективность ингибиторов Hh может зависеть от их интеграции с другими методами лечения или от выбора пациентов с Hh-зависимыми опухолями [14]. В исследовании Jennifer Teichman, показано, что совместное воздействие радиации с ингибиторами HH, 5E1 или LDE225 демонстрирует лучшие результаты в моделях с активированным сигнальным путем Hh, что может способствовать ответу на радиационное воздействие [11].
Заключение
В исследовании выявлено, что для достижения задержки роста опухоли плоскоклеточного рака пищевода достаточно воздействия радиационного излучения в 6 Гр (суммарное значение - 24 Гр). Установлено, что транскрипционная активность генов-компонентов сигнального пути HH повышается под воздействием радиации (выявлены достоверные изменения для генов GLI1, SHH и IHH) вне зависимости от дозы облучения. Соответственно, интеграция ингибиторов SHH, IHH или GLI1 после лучевой терапии может повысить радиосенсибилизацию у пациентов при плоскоклеточном раке пищевода. Необходимы дальнейшие исследования для демонстрации клинического потенциала данных мишеней во время радиотерапии.



