Рак тела матки (РТМ) является наиболее распространенным онкогинекологическим заболеванием, имеющим постоянную тенденцию к прогрессирующему росту [1, 2]. За последние 20 лет стандартизированный показатель заболеваемости карциномой эндометрия вырос на 55,2%. Наивысший показатель заболеваемости наблюдается в возрастной группе 65–69 лет, за ней следует группа больных в возрасте 50–59 лет, что подтверждает догму о том, что рак тела матки – болезнь менопаузальных женщин [3]. Неоспоримым является факт гормональной зависимости карциномы эндометрия от гиперэстрогении. Патогенез злокачественной трансформации эндометрия связан с преимущественным локальным синтезом стероидов, в частности эстрогенов, гиперпродукция которых усиливает процессы пролиферации и влияет на апоптоз. Оба патогенетических варианта развития рака эндометрия являются гормонозависимыми, но в разной степени, что клинически отражается на симптоматике процесса, характере коморбидной патологии, особенностях морфологической структуры карциномы и степени ее злокачественности. Особой пластичностью в подобных изменениях отличаются эндометриоидная аденокарцинома с плоскоклеточной дифференцировкой и плоскоклеточная карцинома эндометрия. Оба морфологических варианта рака тела матки первого патогенетического типа развиваются на фоне гиперэстрогении, характерной для плоскоклеточной злокачественной трансформации эпителия под влиянием ВПЧ-инфекции [4]. По данным систематических зарубежных обзоров, распространенность ВПЧ в опухолях эндометрия I патогенетического варианта с плоскоклеточной дифференцировкой составила 12,4%, а в карциномах эндометрия без плоскоклеточной дифференцировки – от 0% до 61,1% [5, 6]. Следует отметить, что ПЦР-исследование ВПЧ-инфекции в ткани опухоли эндометрия не дает однозначно достоверного показателя инфицированности [7]. По собственным данным [8], ВПЧ 16-го и 18-го типов в ткани карциномы эндометрия в послеоперационном материале после сплошной выборки были обнаружены в 53,8% случаев. В то же время образцы опухоли эндометрия с плоскоклеточной дифференцировкой в 1,8 раза чаще были ВПЧ-положительными, чем ткани аденокарциномы без нее: 83,3% против 46,7% соответственно. Известно, что интеграция генома ВПЧ в геном инфицированной клетки является пусковым механизмом ее злокачественной трансформации, которая сопровождается потерей значительной части вирусного генома при сохранении генов Е6 и Е7 [4]. ВПЧ представляет собой двухцепочечный ДНК-вирус, геном которого кодирует 8 белков, включая онкогенные белки E6 и E7, которые обладают способностью восстанавливать функции подавления p53 и pRB. Состояние физической формы вируса в исследовании [9, 10] было обнаружено только в тест-системах с мишенью в области гена Е6 при 16-м типе ВПЧ в 100% случаев, а при ВПЧ-18-го типа – в 87,5% случаев [8]. Таким образом, экспрессия белка Е6 является надежным детектором ВПЧ-поражения в интегрированном варианте вирусной инфекции в карциноме эндометрия с плоскоклеточной дифференцировкой. ВПЧ считается одной из причин малигнизации клеток, и, несмотря на это, известно, что заражения этим вирусом недостаточно для развития этого заболевания.Следовательно, необходимы другие факторы, в том числе гормональные, которые взаимодействуют, для их постоянства и начала злокачественной трансформации.
Большинство факторов риска развития рака эндометрия могут быть объяснены гипотезой несостоятельности эстрогенов, согласно которой воздействие эндогенных или экзогенных эстрогенов в отсутствие прогестерона или синтетических прогестинов увеличивает пролиферацию клеток эндометрия и одновременно вызывает ошибки репликации ДНК, что приводит к соматическим мутациям и злокачественным перерождениям [11, 12]. Прогестерон противодействует эстрогенам и стимулирует дифференцировку, что подтверждается ассоциацией генетических вариаций генов, которые кодируют рецепторы прогестерона PRA и PRB, их содержание коррелирует с повышенным риском развития рака эндометрия [13, 14]. Повышенный уровень андрогенов в крови, включая тестостерон, андростендион и дегидроэпиандростерон сульфат (DHEA-S), связан с большим риском развития рака эндометрия [15]. Доказано, что ВПЧ-зависимая патологическая пролиферация в тканях шейки матки, как и аномальная гиперпролиферация в других эстрогензависимых тканях, в значительной степени определяется нарушением метаболизма эстрогенов [16].
Целью работы явилось исследование влияния локального изменения содержания половых стероидов и белка Е6 на прогноз эндометриоидного рака тела матки с плоскоклеточной дифференцировкой.
Материалы и методы исследования. В исследование были включены клинические и лабораторные данные больных раком тела матки, находившихся на лечении в гинекологическом отделении Ростовского НМИЦ онкологии в 2019–2020 гг. Во всех случаях получено письменное добровольное информированное согласие больных. За указанный период пролечены 490 больных раком тела матки, из них у 96 пациенток после морфологического исследования послеоперационного материала была обнаружена эндометриоидная аденокарцинома с плоскоклеточной дифференцировкой. Средний возраст больных 60,4±3,2 года. Степень распространения процесса – Т1-2N0M0. Все больные находились в состоянии менопаузы от 2 до 18 лет; имели в анамнезе от 1 до 7 беременностей. По соматической сопутствующей патологии отнести больных с плоскоклеточной дифференцировкой опухоли эндометрия к определенному патогенетическому варианту рака тела матки не представилось возможным. Однако с определенностью следует отметить, что у всех 96 больных аденокарцинома с плоскоклеточной метаплазией развивалась на фоне коморбидного аденомиоза или аденомиоматоза разной степени выраженности. Всем больным была выполнена операция в объеме стандартной нервосберегающей пангистерэктомии с тазовой лимфаденэктомией. При установлении морфологического диагноза «железисто-плоскоклеточный рак» степень дифференцировки устанавливали по железистому компоненту, который и определяет поведение опухоли.
В образцах опухолевой ткани эндометрия, полученных при оперативном лечении методом ИФА с использованием стандартных тест-систем, определяли содержание онкобелка Е6 и половых стероидов – эстрадиола (Е2), эстрона (Е1), тестостерона (Т) и прогестерона (Р4) («Хема», «Алкор-Био», Россия; Эстрамет ВСМ Diagnostics, США; DBC, Канада). В качестве интактной ткани использовали неизмененный эндометрий, полученный при хирургическом лечении миомы матки. Рассчитывали коэффициент соотношения половых стероидов по формуле К=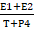 , где Е1 – содержание эстрона, Е2 – содержание эстрадиола, Т – содержание тестостерона, Р4 – содержание прогестерона. Статистический анализ результатов проводили с помощью пакета Statistica 6,0. Для оценки значимости различия показателей в группах предварительно определяли соответствие полученных выборок нормальному закону распределения по методу Шапиро–Уилка. В случае нормального распределения значимость различий средних показателей оценивалась по методу t-критерия Стьюдента, в случае ненормального распределения – с помощью критерия суммы рангов Вилкоксона. Существенными считали различия при p<0,05.
, где Е1 – содержание эстрона, Е2 – содержание эстрадиола, Т – содержание тестостерона, Р4 – содержание прогестерона. Статистический анализ результатов проводили с помощью пакета Statistica 6,0. Для оценки значимости различия показателей в группах предварительно определяли соответствие полученных выборок нормальному закону распределения по методу Шапиро–Уилка. В случае нормального распределения значимость различий средних показателей оценивалась по методу t-критерия Стьюдента, в случае ненормального распределения – с помощью критерия суммы рангов Вилкоксона. Существенными считали различия при p<0,05.
Результаты исследования и их обсуждение
У всех больных раком тела матки (табл. 1) установлено локальное повышение уровня эстрона по сравнению с интактным эндометрием, однако в зависимости от исхода лечения установлены различия в интенсивности изменения содержания гормона. Так, у больных без рецидивов и у пациенток с рецидивами, возникшими в срок более 12 месяцев, уровень эстрона превышал показатели в неизмененном эндометрии в 2,1–2,3 раза.
Таблица 1
Содержание половых гормонов и прогестерона в опухолевой ткани при раке тела матки в зависимости от наличия или отсутствия рецидивов заболевания
|
образцы |
Эстрон Пг/гтк |
Эстрадиол Пг/гтк |
Тестостерон Пг/гтк |
Прогестерон Пг/гтк |
|
|
Интактный эндометрий |
144,8±11,5 |
2,3±0,18 |
70,45±6,4 |
54,0±4,1 |
|
|
Рак эндометрия |
Без рецидивов |
326,6±31,31 |
2,35±0,22 |
103,8±9,51 |
35,1±2,71 |
|
Рецидивы через 12 месяцев |
317,0±29,81 |
2,41±0,23 |
49,6±4,71 |
18,9±1,61 |
|
|
Рецидивы через 6 месяцев |
855,7±76,21 |
2,99±0,30 |
32,14±3,01 |
14,92±1,41 |
|
Примечание: 1 – статистически значимые отличия от показателей в интактном эндометрии (р<0,05)
У пациенток с рецидивами, возникшими в сроки до 6 месяцев, содержание эстрона в опухоли превышало показатели в интактном эндометрии в 5,9 раза (р<0,05).
У всех пациенток независимо от исхода лечения содержание эстрадиола в ткани опухоли не отличалось от показателей интактного эндометрия.
Нами была прослежена четкая зависимость содержания тестостерона у больных от наличия рецидивов. Так, уровень андрогена в опухоли у больной без рецидивов заболевания оказался в 1,5 раза выше (р<0,05), чем в интактном эндометрии, тогда как у больных с наличием рецидивов, напротив, ниже: в подгруппе с рецидивами через 1 год – в 1,4 раза (р<0,05), а через 6 месяцев – в 2,2 раза. Следовательно, у больных без рецидивов уровень тестостерона в опухоли превышал показатели больных с рецидивами в 2,1 раза и в 3,2 раза соответственно.
Содержание прогестерона в опухоли у всех больных оказалось ниже, чем в интактном эндометрии, однако у пациенток без рецидивов – в 1,5 раза (р<0,05), а у больных с рецидивом в зависимости от сроков выявления – в 2,9 раза и в 3,6 раза. В результате у больных с рецидивами уровень прогестерона оказался значимо ниже (в 1,9–2,4 раза) по сравнению с больными, у которых рецидивы не были выявлены.
Известно, что локальный синтез и метаболизм стероидов представляют собой способ, которым опухоли могут контролировать уровни гормонов и их воздействие вмикроокружении, что, соответственно, может сказываться на развитии рецидивов заболевания [17]. Из полученных данных следует, что у всех женщин, больных раком тела матки, опухолевая ткань имела признаки гиперэстрогении за счет возрастания уровня эстрона и снижения содержания прогестерона; к тому же у части больных выявлено снижение уровня тестостерона.
Известно, что эстрогены индуцируют экспрессию онкогенов E6 / E7 в клетках HeLa и SiHa.При этом Онкогены E6 и E7 HPV16 /18 значительно увеличивают экспрессию белков рецепторов эстрогенов [18].Учитывая выявленную локальную гиперэстрогенемию, далее провели исследование ткани опухоли на наличие белка Е6. Оказалось, что у 35 (36,45%) больных из 96 пациенток, больных раком эндометрия, в опухолевой ткани выявляли наличие онкобелка Е6 от 24,1 нг/г ткани до 455,8 нг/г ткани, у всех женщин установлены рецидивы заболевания в разные сроки – до 6 месяцев и от 6 месяцев до 1 года.
Как было показано, у всех больных в опухолевой ткани установлены повышение уровня эстрона без изменения показателей эстрадиола, а также падение содержания прогестерона. Расчет коэффициента соотношения эстрогенов к сумме тестостерона и прогестерона – К=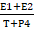 продемонстрировал его возрастание у 61 больной в 1,3 раза (р<0,05), у 23 пациенток – в 2,7 раза, а у 12 женщин – в 8,2 раза (р<0,05) (табл. 2). У 35 пациенток с высокими показателями коэффициента соотношения эстрогенов к андрогенам и прогестинам в ткани опухоли определялся белок Е6. Последующее динамическое наблюдение за больными позволило выяснить, что у 12 женщин с К, равным 24,54±2,4, а Е6 – 420±32 нг/г тк, в течение 6 месяцев развился рецидив заболевания, у 23 пациенток с К 8,15±1,2 и Е6 28±2,1 нг/г тк развились рецидивы заболевания в сроки от 6 месяцев до 1 года. У группы женщин с К 4,04±0,39 и отсутствием белка Е6 в ткани опухоли определяли безрецидивный период сроком более 1 года после хирургического лечения.
продемонстрировал его возрастание у 61 больной в 1,3 раза (р<0,05), у 23 пациенток – в 2,7 раза, а у 12 женщин – в 8,2 раза (р<0,05) (табл. 2). У 35 пациенток с высокими показателями коэффициента соотношения эстрогенов к андрогенам и прогестинам в ткани опухоли определялся белок Е6. Последующее динамическое наблюдение за больными позволило выяснить, что у 12 женщин с К, равным 24,54±2,4, а Е6 – 420±32 нг/г тк, в течение 6 месяцев развился рецидив заболевания, у 23 пациенток с К 8,15±1,2 и Е6 28±2,1 нг/г тк развились рецидивы заболевания в сроки от 6 месяцев до 1 года. У группы женщин с К 4,04±0,39 и отсутствием белка Е6 в ткани опухоли определяли безрецидивный период сроком более 1 года после хирургического лечения.
Таблица 2
Содержание онкобелка Е6 и значения коэффициента соотношения половых стероидов у больных раком тела матки
|
Группы больных |
Онкобелок Е6 (нг/г тк) |
Коэффициент соотношения половых стероидов К |
|
Интактная ткань матки |
0 |
3,0±0,25 |
|
Больные РТМ без рецидивов (n=61) |
0 |
4,04±0,391 |
|
Больные РТМ, у которых рецидивы развились в срок от 6 месяцев до 1 года (n=23) |
28±2,11 |
8,15±1,21 |
|
Больные РТМ, у которых рецидивы развились в срок до 6 месяцев (n=12) |
420±321 |
24,54±4,11 |
Примечание: 1 – статистически значимые отличия от показателей в интактном эндометрии (р<0,05)
Ведущие факторы риска развития рака эндометрия связаны с длительным воздействием эстрогенов, что встречается в случае ожирения, раннего менархе, поздней менопаузы (>55 лет), синдрома поликистозных яичников, бесплодия и лечения тамоксифеном [17]. Полученные результаты свидетельствуют о том, что дисбаланс в насыщенности ткани эндометрия половыми стероидами является одним из важных факторов, связанных с повышением агрессивности злокачественных опухолей и возможностью неблагоприятного течения заболевания после радикального удаления опухоли. Ранее было установлено модифицирующее влияние на синтез стероидных гормонов опухолевой тканью больных раком тела матки инфекционных агентов, не обладающих выраженным онкогенным потенциалом, таких как вирус простого герпеса 1-го и 2-го типов и хламидийная инфекция. В ткани злокачественных опухолей выявляли дисбаланс андрогенов, эстрогенов и прогестинов, а также изменение соотношения метаболитов эстрогенов и гиперпролактинемию, что ухудшало течение заболевания [19]. Известно, что онкобелок Е6 ВПЧ является показателем высокого риска малигнизации, а основными точками его воздействия считают: влияние на активность белка р53, формирование локальной иммуносупрессии и увеличение агрессивных 16ОН метаболитов эстрогенов [20, 21, 22].
Установлено, что вирусные онкобелки играют важную роль в регуляции сигнальных каскадов, которые инициируют ответы, определяющие выживаемость клеток и способствующие развитию рака.Недавние исследования показали, что онкопротеины E6 и E7 способствуют накоплению β-катенина в ядре, что приводит к активации сигнального каскада Wnt / β-catenin и ускорению канцерогенеза шейки матки путем активации генов, которые вызывают увеличение пролиферации клеток [18].Несмотря на то что ВПЧ-зависимая патологическая пролиферация является одним из звеньев, стимулирующих канцерогенез, одной инфекции недостаточно для перехода к раку, а это означает, что другие факторы важны для взаимодействия и индукции злокачественной трансформации клеток.
Известно, что патофизиологические механизмы в эндометрии регулируются половыми стероидами, поэтому изменения в их соотношении могут привести к различным расстройствам,таким как бесплодие, эндометриоз и раки эндометрия [17]. Кроме того, было показано, что эстрогены способны регулировать экспрессию онкогенов E6 и E7 в клетках SiHa, поскольку HPV16 содержит последовательности, подобные таковым в промоторной области рецепторов эстрогенов [18]. В нашем исследовании показано, что сочетание высокой экспрессии белка Е6 с нарушениями интракринного баланса половых стероидов, возможно, является таким пусковым механизмом для малигнизации клеток.
Таким образом, в ходе проведенного исследования было установлено, что экспрессия белка Е6 в эндометриоидной опухоли РТМ с плоскоклеточной метаплазией способствовала нарушению локального гормоногенеза в сторону гиперэстрогении за счет эстрона, усилению прогестеронового и андрогенового дефицита, что и являлось одним из факторов, влияющих на неблагоприятное течение заболевания и повышающих риск возникновения рецидивов. Исследование локального стероидного баланса в комплексе с определением онкобелка Е6 в операционном материале может способствовать выделению пациенток высокого риска неблагоприятного прогноза и осуществлению персонифицированного подхода к проведению адекватных лечебных мероприятий, не предусмотренных стандартами лечения для больных раком тела матки.



