Мультипараметрическое ультразвуковое исследование (УЗИ) является на сегодняшний день перспективным методом лучевой диагностики фолликулярных новообразований щитовидной железы (ФНО ЩЖ), включающим в себя, кроме традиционного В-режима, инновационные опции метода, а также использование систем стратификации риска рака щитовидной железы (ЩЖ) [1‑4].
Радионуклидная сцинтиграфия (РНС) ЩЖ по-прежнему занимает важное место в диагностике узловых заболеваний ЩЖ, особенно в регионах с известным сниженным дефицитом йода. Многие ученые считают, что сцинтиграфия при узловой патологии ЩЖ должна применяться так же широко, как и УЗИ [5‑7]. Были даже предложения включения сцинтиграфии в протоколы TIRADS [8]. Однако до настоящего времени не сформированы критерии, по которым отдельные категории TIRADS могли бы быть основанием для выполнения сцинтиграфии. Остается открытым вопрос, насколько сцинтиграфия ЩЖ способна улучшить специфичность существующих стратификационных систем [9‑10].
Цель исследования – выявление взаимосвязи показателей систем стратификации риска с функциональным статусом новообразований ЩЖ, оцениваемых с помощью радионуклидной сцинтиграфии.
Материалы и методы исследования
В ходе исследования было проведено нерандомизированное ретроспективное когортное прямое исследование. Нами изучены истории болезней 67 пациентов, оперированных по поводу узловых образований ЩЖ. У 15 пациентов был коллоидно-паренхиматозный зоб, у 52 пациентов ‑ подтвержденные ФНО ЩЖ (37 ФАЩЖ и 15 ФРЩЖ). Среди больных с ФНО ЩЖ средний возраст составил 51,3±10,7 года, женщин было 46 (88,5%), мужчин ‑ 6 (11,5%). Среди пациентов с ФНО ЩЖ гипертиреоз был у 12 человек, из них у 11 были выявлены ФАЩЖ.
Всем пациентам были проведены УЗИ и РНС ЩЖ.Ультразвуковая диагностика включала исследование пациентов с узловыми образованиями ЩЖ в стандартном В-режиме, цветовом допплеровском картировании (ЦДК) и энергетическом допплеровском картировании (ЭДК). Узловые образования ЩЖ были распределены в соответствии с категориями систем стратификации риска: EU-TIRADS, TLA и TI-RADS.
РНС проводилась с помощью комбинированной ОФЭКТ/КТ системы Precedence от компании Philips, состоящей из двух гамма-детекторов и компьютерной 16-слойной томографической приставки. Пациенту вводится внутривенно радиофармпрепарат 99mTc-пертехнетат, и через 15‑20 мин проводится исследование. Ионизирующее излучение выходит из тела пациента и регистрируется детекторами гамма-камеры. Данные передаются на компьютер и преобразовываются в изображение. Результаты накопления радиофармпрепарата в исследуемых зонах оценивались количественно и визуально. Сцинтиграфия с 99mTc-пертехнетатом выполнялась для дифференциальной диагностики причин тиреотоксикоза и оценки функционального состояния узловых образований ЩЖ.
При выполнении УЗИ у пациентов были выявлены 98 узлов ЩЖ, из них была проведена оценка 67 узлов, размер которых был более 10 мм, в том числе 55 узлов более 15 мм.
Проводилась оценка корреляции данных УЗИ (EU-TIRADS, TLA и TI-RADS) с функциональным статусом, оцененнымс помощью сцинтиграфиис 99mTc-пертехнетатом.
Оценка гормонального статуса, проведенная до операции, показала, что медиана ТТГ составляла 1,72 мЕд/л (диапазон 0,04‑6,16 мЕд/л), у 12 пациентов (17,9%) были клинические и лабораторные признаки гипертиреоза (уровень ТТГ ниже нормативных показателей (0,4‑4,0 мЕд/л)).
Статистический анализ при диагностике новообразований ЩЖ оценивали на основании ROC-анализа с определением площади под кривой (AUC), индекса Юдена, чувствительности, специфичности и других параметров. Математическая обработка и анализ материалов исследования осуществлялись с использованием программных пакетов StatSoft STATISTICA 10.0 и Microsoft Office Excel 2016.
Результаты исследования и их обсуждение
По результатам нашего исследования выявленные узловые образования имели следующие характерные ультразвуковые признаки: ровные границы (60 узлов; 89,6%), четкие контуры (63 узла; 94%), наличие гипоэхогенного ободка Halo (54 узла; 80,6%), «высота» образования была больше «ширины» у 2 узлов (97,0%). В 40 (59,7%) случаях узлы были пониженной эхогенности, в 25 (37,3%) ‑ изоэхогенными, в 2 (3,0%) ‑ анэхогенными. Однородная эхоструктура была у 44 узлов (65,7%), солидное строение ‑ у 63 узлов (94%), кистозно-солидное ‑ у 6 (9,0%). Жидкостный компонент установлен в 6 узлах (9,0%). Кальцинаты выявлены в 22 узлах (32,8%) (преимущественно микрокальцинаты). Кровоток в узлах преобладал в основном смешанный и периферический: усиленный (42 узла; 62,7%), ослабленный (5 узлов; 7,5%), умеренный (20 узлов; 29,8%). Увеличение лимфоузлов шеи выявлено в 14 случаях (20,9%), специфические изменения в лимфоузлах отсутствовали. Также отсутствовали периферическое обызвествление и внетиреоидное распространение.
По вышеперечисленным ультразвуковым признакам проведено распределение узлов по системам EU-TIRADS, TLA, TI-RADS. Выявлено, что по системе EU-TIRADS 16 случаев (23,9%) были расценены как EU-TIRADS2, 2 (3,0%) ‑ как EU-TIRADS3, 32 (47,8%) ‑ как EU-TIRADS4, а 17 (25,4%) изображений отнесены к градации EU-TIRADS5 (рис. 1). При использовании системы TI-RADS по оценке изображений морфологически подтвержденных ФАЩЖ в 17 случаях (25,4%) паттерн был расценен как TI-RADS2, в 4 (13,4%) ‑ как TI-RADS3, в 29 (43,3%) ‑ как TI-RADS4, в 17 (25,4%) ‑ как TI-RADS5. По системе TLA 13 узлов (19,4%) были отнесены к TLA1 (высокая вероятность доброкачественного процесса), а 54 (70,6%) ‑ к TLA2 (высокий риск наличия опухоли).
|
|
|
|
|
|
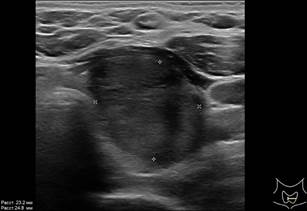
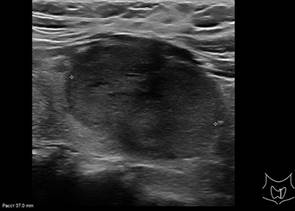
Рис. 1. Больная С. УЗИ ЩЖ: В-режим и ЦДК (поперечное и продольное сканирование). В среднем сегменте левой доли ЩЖ однородное гипоэхогенное образование 37х24х23 мм с четкими, неровными контурами, с умеренным смешанным кровотоком. EU-TIRADS4
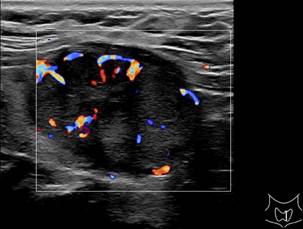
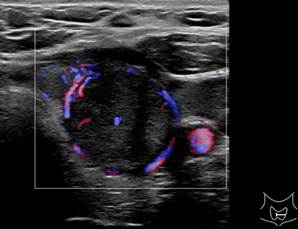
По результатам РНС 29 узлов ЩЖ (42,6%) были гиперфункциональными, а 38 (57,4%) ‑ гипофункциональными или неопределенными. При оценке распределения гиперфункциональных узлов ЩЖ (29 случаев) по градациям систем стратификации риска установлено, что чаще такие узлы относились к категориям EU-TIRADS4, TLA2 и TI-RADS4 (рис. 2), т.е. к категориям со средним риском злокачественности (6‑17% по EU-TIRADS и TI-RADS), при которых выполнение ТАПБ является обязательным (табл. 1).
Таблица 1
Распределение гиперфункциональных и гипофункциональных узлов ЩЖ по системам стратификации
|
Системы стратификации |
Узлы щитовидной железы |
|||
|
Гипофункциональные |
Гиперфункциональные |
Всего |
||
|
EU-TIRADS |
2 |
10 (14,9%) |
6 (9,0%) |
16 (23,9%) |
|
3 |
2 (3,0%) |
0 (0,0%) |
2 (3,0%) |
|
|
4 |
10 (14,9%) |
22 (32,8%) |
32 (47,7%) |
|
|
5 |
16 (23,9%) |
1 (1,5%) |
17 (25,4%) |
|
|
TLA |
1 |
9 (13,4%) |
4 (6,0%) |
13 (19,4%) |
|
2 |
29 (43,3%) |
25 (37,3%) |
54 (80,6%) |
|
|
TI-RADS |
2 |
13 (19,4%) |
4 (6,0%) |
17 (25,4%) |
|
3 |
2 (3,0%) |
2 (3,0%) |
4 (6,0%) |
|
|
4 |
8 (11,9%) |
21 (31,3%) |
29 (43,2%) |
|
|
5 |
15 (22,4%) |
2 (3,0%) |
17 (25,4%) |
|
|
ВСЕГО |
|
38 (56,7%) |
29 (43,3%) |
67 (100%) |
|
|
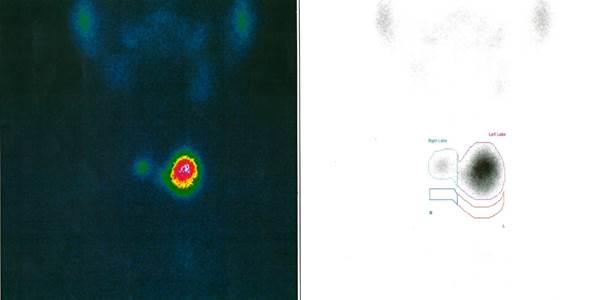
Рис. 2. Сцинтиграфия с 99м-Тс-пертехнетатом щитовидной железы у пациентки С. «Горячий» узел в левой доле. Диагноз: фолликулярная аденома щитовидной железы
Из имеющихся гиперфункциональных узлов ЩЖ 22 (75,9%) узла оказались опухолями: 20 ‑ ФАЩЖ и 2 ‑ ФРЩЖ. Таким образом, можно предположить хорошие возможности сцинтиграфии при диагностике ФНО. Однако при проведении расчетов чувствительность сцинтиграфии в дифференциальной диагностике неопухолевых заболеваний ЩЖ и ФНО составила 53,33% (95%CI: 26,59% to 78,73%), специфичность ‑ 42,31% (95%CI: 28,73% to 56,80%), точность ‑ 44,78% (95%CI: 32,60% to 57,42%), положительная прогностическая ценность ‑ 21,05% (95%CI: 13,60% to 31,13%), отрицательная прогностическая ценность ‑ 75,86% (95%CI: 62,67% to 85,48%), положительное отношение правдоподобия ‑ 0,92 (95%CI: 0,55 to 1,57), отрицательное отношение правдоподобия ‑ 1,10 (95%CI: 0,59 to 2,07). Показатель AUC составил 0,532, что говорит о небольших диагностических возможностях сцинтиграфии в дифференциальной диагностике очаговой патологии ЩЖ (рис. 3), значительно уступающих УЗИ.
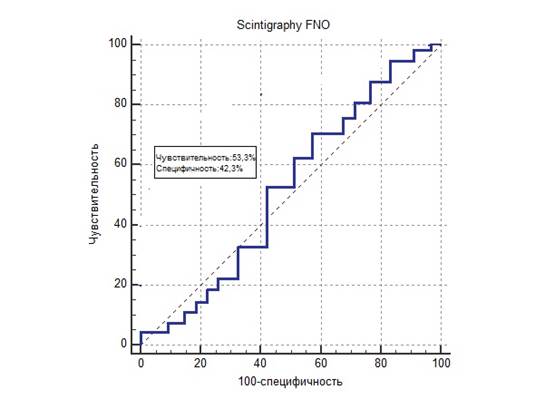
Рис. 3. ROC-кривая, отражающая прогностические возможности сцинтиграфии при дифференциальной диагностике доброкачественных заболеваний и опухолей щитовидной железы
Можно предположить, что полученные характеристики метода связаны с ограниченностью размера выборки. Вместе с тем при исследовании было установлено, что значительное число гиперфункциональных узлов ЩЖ относились к градациям, не угрожаемым по наличию опухоли.
Установлено, что при оценке данных сцинтиграфии ФНО ЩЖ результаты отличны при ФАЩЖ и ФРЩЖ. Так, чувствительность сцинтиграфии в дифференциальной диагностике ФНО ЩЖ составила 86,67% (95%CI: 59,54% to 98,34%), специфичность ‑ 48,08% (95%CI: 34,01% to 62,37%), точность ‑ 56,72% (95%CI: 44,04% to 68,78%), положительная прогностическая ценность ‑ 32,50% (95%CI: 25,75% to 40,07%), отрицательная прогностическая ценность ‑ 92,59% (95%CI: 76,94% to 97,91%), положительное отношение правдоподобия ‑ 1,67 (95%CI: 1,20 to 2,32), отрицательное отношение правдоподобия ‑ 0,28 (95%CI: 0,07 to 1,04). Показатель AUC (0,617) говорит о средних возможностях сцинтиграфии в дифференциальной диагностике ФНО (рис. 4).
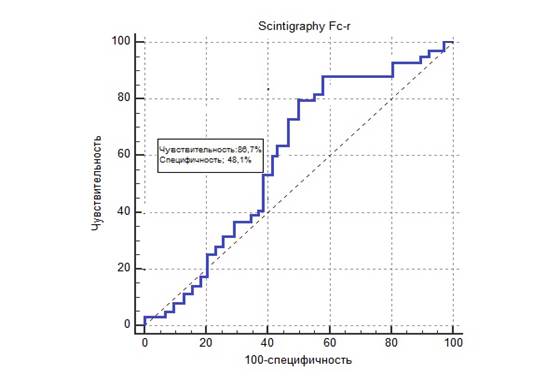
Рис. 4. ROC-кривая, отражающая прогностические возможности сцинтиграфии при дифференциальной диагностике доброкачественных заболеваний и опухолей щитовидной железы
Выводы
При формировании тактики лечения гиперфункциональных узлов ЩЖ сцинтиграфия может применяться у пациентов с категориями EU-TIRADS2-4, TLA2 и TI-RADS2-4. Это особенно важно, если цитологическое заключение узла ЩЖ по результатам тонкоигольной аспирационной пункционной биопсии соответствует категориям «неопределенных» образований: Bethesda III и Bethesda IV.
В связи с тем, что РНС не позволяет получить объемное представление о локализации ФНО и не имеет специфических признаков, позволяющих формировать представление о характере патологического процесса, использование сцинтиграфии на начальном этапе диагностики нецелесообразно. Таким образом, сцинтиграфия в диагностике ФНО ЩЖ применяется в случае затруднения с конкретной оценкой узлов ЩЖ при УЗИ и в морфологическом исследовании.