Согласно современным представлениям, избыточная масса тела и ожирение являются главными триггерами патологических изменений поджелудочной железы (ПЖ), сопоставимых с изменениями при неалкогольной жировой болезни печени [1]. Прогрессирующей стадией течения неалкогольной жировой болезни поджелудочной железы (НЖБ ПЖ) является хронический неалкогольный стеатопанкреатит (НСП), характеризующийся лимфомоноцитарно-плазмоцитарной инфильтрацией ткани ПЖ, некрозом и фиброзом [2]. Среди диффузных заболеваний пищеварительной железы НСП является одним из менее изученных патологических состояний [3; 4]. Деструкция клеток ПЖ при ожирении в первую очередь происходит в результате повышенного синтеза высокоцитотоксичных окисленных липидных продуктов [5]. Гиперактивация процессов пероксидации липидов сопровождается значительным изменением молекулярного состава и степени окисленности макромолекул липидов. Изменение липидного состава паренхиматозных органов пищеварительной системы при ожирении может являться одним из механизмов формирования хронических заболеваний ПЖ. Исследований, посвященных изучению роли модификации липидов ПЖ и переэстерификации их ацильных заместителей (жирных кислот) в патогенезе хронических заболеваний пищеварительной системы, очень мало. Вместе с тем большую информативную ценность с точки зрения механизма формирования НСП ПЖ может дать изучение спецификации молекулярных видов полярных и нейтральных липидов как индикаторов нарушения липидного обмена и органного патогенеза [6].
Целью исследования явилось изучение особенностей состава ацильных заместителей глицерофосфолипидов, триацилглицеролов, эфиров стеролов ткани поджелудочной железы на разных стадиях развития экспериментальной неалкогольной жировой болезни ПЖ.
Материал и методы исследования
Экспериментальные исследования были проведены на 35 белых крысах-самцах линии Вистар с начальной массой 172,0±5,6 г в возрасте 3 месяцев. Ожирение и последующее повреждение ПЖ у крыс вызывали экспериментальным высокожировым и высокохолестериновым рационом. Прототипом выбора модели и сроков эксперимента явилась мультипатологическая модель развития метаболического синдрома по Fraulob, характеризующаяся формированием ожирения, стеатогепатита и стеатопанкреатита [7]. Животные были разделены на 3 группы: интактная группа крыс находилась на стандартном рационе питания; опытная группа 1 - крысы содержались на экспериментальном рационе в течение 12 недель и опытная группа 2 – 24 недели соответственно. Эвтаназию животных проводили путем декапитации под эфирным наркозом согласно требованиям Европейской конвенции по защите экспериментальных животных 86/609 ЕЕС. После вскрытия животных поджелудочная железа сразу же извлекалась, взвешивалась и один фрагмент органа погружался в раствор Фолча (хлороформ+метанол в соотношении 2:1) для липидомного анализа, другой фрагмент - в раствор нейтрального забуференного 10% формалина для гистологического исследования. Для гистологических исследований кусочки ткани ПЖ заливались в парапласт (Histomix) и готовились срезы тканей толщиной 7 мкм, которые окрашивались гематоксилином-эозином по Романовскому [8]. Гистологические препараты исследовали при помощи микроскопа AxioScope A.1 и камеры Axiocam 506 color «Carl Zeiss» (Германия).
Экстракцию липидов из ткани ПЖ проводили по методу Блайя и Дайера [9]. Разделение нейтральных и полярных липидов ткани ПЖ осуществляли методом одномерной микротонкослойной хроматографии на пластинках с закрепленным слоем силикагеля (Sorbfil). В качестве системы растворителей использовали смесь гексана, диэтилового эфира и уксусной кислоты (80:20:1, по объему). Зоны силикагеля, содержащие глицерофосфолипиды (ГФЛ), триацилглицеролы (ТАГ) и эфиры стеролов (ЭС), собирали шпателем, ТАГ и ЭС элюировали хлороформом, ГФЛ – метанолом. Метиловые эфиры ЖК получали по методу Каро и Дубака [10], анализировали на газожидкостном хроматографе Shimadzu GC-2010 (Япония) с пламенно-ионизационным детектором. Идентификацию пиков проводили по значениям эквивалентной длины цепи [11]. Результаты выражали в относительных процентах от суммы ЖК. Статистическую обработку результатов исследования проводили, вычисляя среднее арифметическое значение (М), ошибку среднего арифметического значения (m), и представляли в виде M±m. Статистическую значимость различий средних величин определяли с помощью критерия Стьюдента после проверки на нормальность распределения.
Результаты исследования и их обсуждение. Результаты гистологического исследования показали, что в группе интактных животных структура ткани соответствовала структуре здорового органа. Через 12 недель эксперимента у крыс опытной группы 1 наблюдались признаки жировой инфильтрации панкреатических клеток, что характеризовало формирование стеатоза поджелудочной железы (рис. 1а). Исследование морфологии тканей поджелудочной железы крыс опытной группы 2 через 24 недели эксперимента выявило очаги некроза с воспалительно-клеточной инфильтрацией и нарушение дольчатого строения тканей, формирования фиброзной трансформации (рис. 1 б, в). Следовательно, 12-недельное жировое повреждение поджелудочной железы у крыс соответствует характеру развития НЖБ ПЖ, тогда как через 24 недели формируется прогрессирующая стадия данного заболевания – неалкогольный стеатопанкреатит.
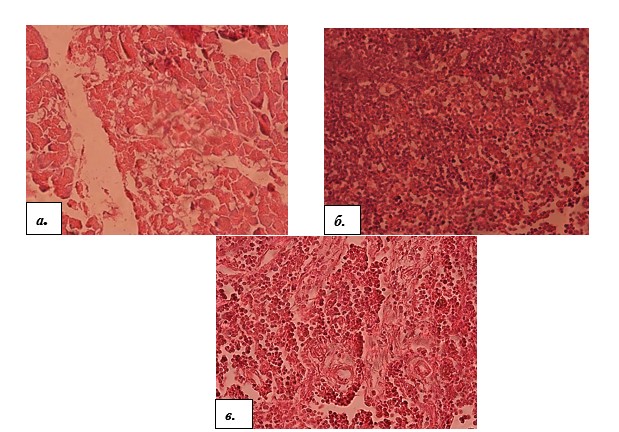
Рис. 1. Гистологическое строение поджелудочной железы у крыс, находившихся на экспериментальном рационе: а) 12-недельная опытная группа. Липидные включения в панкреатических клетках; б) 24-недельная опытная группа. Обширные поля некротизированных клеток и воспалительной инфильтрации; в) 24-недельная опытная группа. Разрастание соединительной ткани в паренхиме органа. Окраска гематоксилин-эозин. Увеличение 40×15
Липидомный анализ ацильных заместителей глицерофосфолипидов (ГФЛ), триацилглицеролов (ТАГ) и молекулярных видов эфиров стеролов (ЭС) ткани поджелудочной железы крыс представлен в таблице. Специфической особенностью молекулярной структуры глицерофосфолипидов ткани поджелудочной железы крыс опытной группы 1 (12 недель жирового повреждения ПЖ) стало увеличение в их составе доли миристиновой (14:0), стеариновой (18:0), олеиновой (18:1n9) кислот по сравнению с интактной группой крыс. Среди полиненасыщенных жирных кислот (ПНЖК) отмечалось повышение эстерификации в ГФЛ линолевой (18:2n6) кислоты и кислоты Мида (20:3n9). Модификация длинноцепочечных ПНЖК молекул ГФЛ в ткани ПЖ характеризовалась двукратным уменьшением эйкозапентаеновой (20:5n3) и гамма-линоленовой (18:3n6) кислот. Через 24 недели развития модели НСП направленность изменений ацильных заместителей в молекулах ГФЛ была идентично изменениям 12-недельной модели. У крыс опытной группы 2 (24 недели развития НСП) в глицерофосфолипидах ПЖ отмечалось значительное увеличение доли олеиновой кислоты при уменьшении концентрации гамма-линоленовой, арахидоновой и докозатетраеновой кислот по сравнению как с интактной группой, так и с 12-недельной опытной группой крыс.
Состав ацильных заместителей липидных фракций поджелудочной железы крыс M±m
|
Ацильный заместитель, % |
Фракция липидов |
Интактная группа, n=15 |
12-недельная группа НЖБ ПЖ, n=10 |
24-недельная группа НЖБ ПЖ, n=10 |
|
14:0 |
ГФЛ |
0,78±0,04 |
***1,22±0,05 |
0,69±0,04 |
|
ТАГ |
2,26±0,01 |
***1,10±0,15 |
***1,53±0,11 |
|
|
ЭС |
0,35±0,06 |
***0,84±0,06 |
***0,92±0,05 |
|
|
16:0 |
ГФЛ |
24,00±0,33 |
23,88±0,83 |
*21,02±0,36 |
|
ТАГ |
25,61±2,24 |
*20,23±1,66 |
**20,5±0,52 |
|
|
ЭС |
17,32±3,49 |
***11,47±143 |
***11,32±0,12 |
|
|
18:0 |
ГФЛ |
14,80±0,37 |
**16,92±0,14 |
**16,97±0,72 |
|
ТАГ |
4,87±0,03 |
***7,35±0,91 |
*6,27±0,34 |
|
|
ЭС |
3,75±0,54 |
***6,35±0,22 |
***6,15±0,56 |
|
|
18:1n9 |
ГФЛ |
10,77±0,41 |
*13,28±0,19 |
***16,52±0,34 |
|
ТАГ |
32,27±2,26 |
***48,66±1,87 |
***43,55±1,14 |
|
|
ЭС |
22,3±3,7 |
***36,8±2,7 |
***46,57±0,82 |
|
|
18:2n6 |
ГФЛ |
13,9±0,6 |
***17,75±1,21 |
***17,3±0,2 |
|
ТАГ |
18,62±2,86 |
**13,23±1,40 |
**15,12±0,16 |
|
|
ЭС |
19,25±1,19 |
21,08±0,96 |
***13,12±0,23 |
|
|
18:3n6 |
ГФЛ |
0,42±0,01 |
*0,3±0,02 |
***0,10±0,01 |
|
ТАГ |
0,46±0,16 |
0,42±0,01 |
**0,26±0,06 |
|
|
ЭС |
0,56±0,12 |
*0,28±0,02 |
*0,26±0,09 |
|
|
18:3n3 |
ГФЛ |
0,18±0,01 |
0,20±0,05 |
**0,26±0,01 |
|
ТАГ |
0,68±0,03 |
*0,57±0,18 |
*0,55±0,04 |
|
|
ЭС |
0,46±0,06 |
***0,21±0,10 |
**0,82±0,11 |
|
|
20:3n9 |
ГФЛ |
0,33±0,02 |
***1,53±0,09 |
0,31±0,02 |
|
ТАГ |
- |
- |
- |
|
|
ЭС |
0,96±0,17 |
***0,45±0,05 |
*0,75±0,17 |
|
|
20:4n6 |
ГФЛ |
16,53±0,72 |
*14,44±0,72 |
**13,1±0,6 |
|
ТАГ |
0,27±0,65 |
*0,15±0,05 |
*0,18±0,02 |
|
|
ЭС |
28,73±7,34 |
***10,96±0,86 |
***10,55±0,90 |
|
|
20:5n3 |
ГФЛ |
0,95±0,13 |
***0,46±0,11 |
**0,63±0,01 |
|
ТАГ |
0,70±0,03 |
*0,92±0,13 |
- |
|
|
ЭС |
0,7±0,2 |
***0,24±0,12 |
***0,25±0,11 |
|
|
22:4n6 |
ГФЛ |
1,15±0,05 |
***0,9±0,06 |
***0,78±0,04 |
|
ТАГ |
0,30±0,01 |
- |
***0,61±0,02 |
|
|
ЭС |
0,54±0,04 |
- |
- |
|
|
22:5n3 |
ГФЛ |
0,62±0,13 |
0,57±0,08 |
0,55±0,06 |
|
ТАГ |
0,32±0,02 |
***0,12±0,01 |
***0,10±0,07 |
|
|
ЭС |
0,36±0,05 |
***0,26±0,09 |
***0,17±0,02 |
|
|
22:6n3 |
ГФЛ |
2,43±0,47 |
2,07±0,24 |
2,10±0,35 |
|
ТАГ |
0,32±0,13 |
***0,16±0,33 |
***0,21±0,32 |
|
|
ЭС |
1,65±0,38 |
**1,14±0,12 |
***0,87±0,14 |
Примечание: (*) – статистическая значимость различий относительно контрольной группы: * – р< 0,05; ** – р < 0,01; *** – р < 0,001.
Состав ацильных фрагментов молекул ТАГ поджелудочной железы у крыс опытных групп характеризовался снижением миристиновой и пальмитиновой кислот и замещением на стеариновую и олеиновые кислоты, содержание которых значительно повышалось по сравнению с интактной группой. У крыс опытной группы 1 химическая структура ТАГ пищеварительной железы имела пониженное содержание арахидоновой кислоты, в том числе доля ее метаболита - докозатетраеновой кислоты не идентифицировалась на спектрах при ГЖ/МС анализе. Относительное содержание n-3 ПНЖК, таких как 18:3n3, 20:5n3, 22:5n3, 22:6n3, уменьшалось в ТАГ поджелудочной железы на протяжении всего эксперимента.
Развитие неалкогольного стеатопанкреатита значительным образом сказалось на молекулярной структуре эфиров стеролов (ЭС). Среди молекулярных видов ЭС в ткани поджелудочной железы опытных крыс преобладали молекулы с 14:0, 18:0, 18:1n9 ацильными заместителями. У крыс с 12-недельной НЖБ ПЖ в ЭС снижалась эстерификация 16:0, 18:3n6, 18:3n3, 20:3n9, 20:4n6, 22:6n3 и ее предшественника 22:5n3. Логичным итогом уменьшения доли молекул ЭС с арахидоновой кислотой (20:4n6) стало отсутствие эфиров стеролов с ацильным заместителем в виде докозатетраеновой кислоты (22:4n6). Через 24 недели развития неалкогольного стеатопанкреатита доля ЭС с эссенциальной линолевой кислотой (18:2n6) снижалась в 1,5 раза по сравнению с интактной группой, что, соответственно, сказалось на уменьшении уровня всех n-6 ПНЖК данного метаболического ряда, эстерифицированных в стеролы.
Обобщая результаты исследования состава ацильных заместителей липидных фракций поджелудочной железы крыс при НЖБ ПЖ, можно выделить ключевые особенности молекулярной структуры ГФЛ, ТАГ и ЭС. Установлено, что уже на начальных этапах жирового повреждения ПЖ происходит существенная перестройка химической структуры всех субклассов липидов с последующим прогрессированием нарушения липидома ткани поджелудочной железы. Во всех исследуемых полярных и нейтральных липидах ПЖ происходит преимущественная эстерификация стеариновой и олеиновой кислот, тогда как доля большинства ПНЖК уменьшалась. Доля миристиновой кислоты значительно возрастала в ЭС на всех этапах эксперимента и в ГФЛ через 12 недель развития НЖБ ПЖ. Интересно, что в ТАГ доля всех исследуемых насыщенных ЖК значительно уменьшалась. В ГФЛ происходила переэстерификация n-3 и n-6 ПНЖК на кислоты из семейства n-9 ЖК. Перенагрузка глицерофосфолипидов и эфиров стеролов насыщенными жирными кислотами создает основу для липоэндотоксинемии, панкреонекроза и воспалительной инфильтрации. Известно, что в норме основными носителями насыщенных и моноеновых кислот являются ТАГ, тогда как ГФЛ и ЭС преимущественно эстерифицируются ПНЖК [12; 13]. При этом в формировании молекулярной структуры сложных липидов играют роль не только экзогенные, алиментарные факторы, но и эндогенные факторы, такие как активность ферментов синтеза жирных кислот и липидных макромолекул [14].
Заключение. Анализ результатов исследования показал, что развитие экспериментального хронического стеатопанкреатита характеризуется нарушением процессов эстерификации и синтеза ацильных фрагментов, что приводит к изменению молекулярной структуры основных липидных макромолекул, способствуя тем самым дестабилизации клеточных мембран и формированию некротического повреждения. Причем патологические изменения молекулярной структуры полярных и нейтральных липидов проявляются на ранней стадии развития жировой болезни ПЖ и прогрессируют при стеатопанкреатите. Таким образом, нарушение гомеостаза ацильных заместителей в основных субклассах липидов может являться одной из причиной деструктивно-патологических механизмов развития стеатопанкреатита.



