Травмы и их последствия являются важной проблемой медицины, поскольку количество травмированных пациентов не поддается точному подсчету и может сравниться с общим народонаселением стран. Пациенты, которые выживают в течение первых 48 ч после получения травмы, остаются подверженными риску множественных осложнений сердечно-сосудистой системы, в их числе снижение фракции выброса левого желудочка, ишемическая болезнь сердца в острой и хронической форме, аритмии, повреждения клапанов и регургитация, аномалии циклов сокращения и расслабления миокарда, разрыв стенок миокарда и потенциально отсроченная смерть [1-4]. Исследования, связанные с воздействием травмы на миокард, в основном сосредоточены на оценке патологического повреждения из-за прямой травмы сердца, поэтому работы, связанные с опосредованным влиянием травматических повреждений, в частности опорно-двигательного аппарата, немногочисленны.
Не менее важным является поиск эффективных цитопротекторов и биологически активных веществ, стимулирующих регенераторные процессы, снижающих выраженность воспалительных реакций, способствующих развитию посттравматических осложнений [5-7]. На основе клинических и экспериментальных наблюдений сформулирована концепция системного воспалительного ответа, в которой обосновываются причины полиорганной недостаточности у пациентов в посттравматическом периоде. Согласно этой концепции системный воспалительный ответ обусловлен местным разрушением тканей и накоплением в периферическом кровотоке токсичных побочных продуктов окислительного стресса, приводящим к высвобождению медиаторов воспаления [8]. В последнее время большое внимание уделяется использованию клеточных технологий, в том числе основанных на применении экзосом мультипотентных стромальных клеток (ЭМСК), для стимуляции регенераторных процессов [9, 10]. Однако практически неизученными остаются вопросы влияния ЭМСК на мышцу сердца при их дистантном введении для терапии повреждений костной ткани.
Цель исследования – оценка характера и выраженности структурной реорганизации миокарда при отдаленном повреждении костной ткани проксимального мыщелка большеберцовой кости (ПМБК) и применении ЭМСК как потенциального регенеративного компонента.
Материал и методы исследования
Эксперименты проведены на беспородных кроликах обоего пола возрастом 4–6 месяцев и массой 3–4 кг. Все манипуляции с животными выполняли в соответствии с ГОСТ 33215-2014 (Руководство по содержанию и уходу за лабораторными животными. Правила оборудования помещений и организации процедур) и ГОСТ 33216-2014 (Руководство по содержанию и уходу за лабораторными животными. Правила содержания и ухода за лабораторными грызунами и кроликами).
На начальном этапе проводили внутривенную премедикацию (атропина сульфат 0,1% – 0,22–0,27 мг/кг; димедрол 1% – 4,6–5,2 мг/кг; дроперидол 0,25% – 1,25 мг; кеторолака триметамин 1% – 10 мг). В качестве индукции анестезии использовали пропофол (1% – 15 мг/кг внутривенно), для поддержания анестезии также применяли пропофол (1% – 25–30 мг/кг/час внутривенно). Инфузионную терапию осуществляли 0,9%-ным раствором натрия хлорида 15–25 мл/кг, в зависимости от выраженности кровопотери. Респираторную поддержку при необходимости проводили масочным способом с инсуфляцией 100%-ного кислорода. Под общей анестезией ножницами проводили удаление волосяного покрова в месте предполагаемого хирургического вмешательства на обеих конечностях в области коленных суставов.
В условиях асептики и антисептики при использовании тотальной внутривенной анестезии пропофолом в ПМБК правой и левой конечностей кроликов стоматологическим бором диаметром 2 мм с охлаждением стерильным физиологическим раствором создавали стандартизованное отверстие глубиной 4 мм. Животные были разделены на две группы: 1-я группа – дефекты ПМБК заполняли инсулиновым шприцем теплым физиологическим раствором на фосфатном буфере (27 кроликов); 2-я группа – в дефекты вводили 39 мкг ЭМСК на животное (или 19,5 мкг на одну конечность) в этом буфере (30 животных). Операционную рану ушивали послойно без натяжения. Через 3, 7 и 10 суток после операции животных выводили из эксперимента дислокацией шейных позвонков. В качестве контроля использованы интактные кролики (5 особей), которых содержали в таких же условиях вивария.
ЭМСК получали из мультипотентных стромальных клеток, выделенных из костного мозга крыс-самцов инбредной линии Wag (массой 180 г, в возрасте 6 месяцев), характеризовали и культивировали в соответствии с рекомендациями литературы [11]. Кондиционную среду для выделения ЭМСК собирали на стадии стационарного роста стабильной культуры 3-го пассажа предифференцированных в костном направлении МСК (0,1 мкмM раствора дезоксиметазона, 50 мкмM раствора аскорбиновой кислоты и 10 мM раствора β-глицерофосфата, все реактивы производства «Sigma», США) [11, 12] при достижении конфлюэнтности клеточного монослоя 80–90%, согласно указаниям [13, 14].
Для удаления клеток, их остатков, апоптозных телец и крупных везикул кондиционную среду после культивирования МСК последовательно центрифугировали: 10 мин при 300 g, 10 мин при 2000 g, 30 мин при 12000 g. ЭМСК осаждали, центрифугируя супернатант 2 ч при 100000 g, ресуспендировали в 200 мкл физиологического раствора на фосфатном буфере и повторно центрифугировали при 100 000 g в течение 2 ч. Выделенные ЭМСК ресуспендировали в 200 мкл забуференного физиологического раствора, пропускали через фильтр с порами 0,22 мкм. Количество ЭМСК определяли по содержанию белка в осадке, использовали коммерческий набор «Qubit protein assay kit» (Thermo Fisher Scientific, USA) и флюориметр «Qubit® 3.0».
Для морфологического исследования из сердец кроликов вырезали образцы толщиной около 5 мм так, чтобы в образце оказались правые и левые предсердия и желудочки с максимальной площадью полостей. Затем по перегородке разделяли правые и левые отделы, которые обрабатывали отдельно. Образцы фиксировали в 4%-ном растворе параформальдегида на фосфатном буфере (рН 7,4) не менее суток, обезвоживали и просветляли в реактиве «Изопреп» («БиоВитрум», Россия), заключали в гистопласт. Гистологические срезы правых и левых отделов сердца толщиной 5 мкм окрашивали гематоксилином и эозином, исследовали при увеличении до 1200 раз на световом микроскопе Axioimager M1 (Carl Zeiss, Germany).
Стереологический анализ миокарда правого и левого желудочков сердца проводили на микрофото, сделанных при увеличении в 200 раз (тестовая площадь 3,5х105 мкм2) с помощью цифровой фотокамеры и программного обеспечения Axiovision (Zeiss, Германия). Оценивали объемную плотность кардиомиоцитов, кровеносных капилляров, соединительной ткани (суммарно клетки, волокна и основное вещество). Рассчитывали также объемные отношения капилляров к кардиомиоцитам и соединительной ткани к кардиомиоцитам. Объем выборки составил 25 неперекрывающихся полей зрения как для правого, так и для левого желудочков сердца каждого животного.
Статистический анализ полученных данных осуществляли с использованием программы MS Excel 7.0 (Microsoft, США); вычисляли среднее арифметическое и его стандартное отклонение. Значимость различий параметров оценивали с использованием критерия Стьюдента; различия считали статистически значимыми при p<0,05.
Результаты исследования и их обсуждение
В миокарде левого и правого желудочков интактных кроликов наблюдали умеренно выраженные явления полнокровия сосудов и мононуклеарной инфильтрации (рис. 1а), что, скорее всего, было связано со стрессированием животных во время выведения из эксперимента, премедикацией и наркозом. Через 3 суток после повреждения ПМБК в миокарде обоих желудочков отмечались дистрофические изменения кардиомиоцитов, более заметные в левом желудочке, которые выражались в разреженности их саркоплазмы, особенно в перинуклеарной зоне (рис. 1б). Наблюдались выраженные расширения интерстициальных пространств и лимфатических сосудов. Появлялась мононуклеарная инфильтрация (диффузная и периваскулярная), встречались единичные нейтрофилы (рис. 1б).
У одного животного через 3 суток после повреждения трубчатых костей нижних конечностей в правых полостях сердца были найдены фибриновые тромбы, обильно инфильтрированные гемопоэтическими клетками, происходящими, скорее всего, из красного костного мозга (рис. 1в). Возможно, что при массивном повреждении костной ткани, в которой находятся кроветворные структуры красного костного мозга, при создании дефекта ПМБК происходит попадание клеток костного мозга в кровь. Сначала они попадают в правое предсердие и правый желудочек, где остаются до полного лизиса или организации, затем могут мигрировать далее – в легочные артерии с вероятностью их эмболии.
Через 3 суток после повреждения ПМБК с последующим введением ЭМСК в миокарде левого желудочка кроликов были отмечены еще более выраженные дистрофические изменения кардиомиоцитов и явления отека на фоне очень значительного расширения кровеносных капилляров. В некоторых случаях миокард вследствие выраженного полнокровия был имбибирован форменными элементами крови (рис. 1г). Присутствовала умеренная лимфоцитарно-макрофагальная инфильтрация с небольшой примесью нейтрофилов. Клетки костного мозга в сердце не обнаружены ни в одном случае, однако у 2 животных в полостях желудочков были найдены тромбы, иногда морфологически напоминающие таковые при эндокардите.
К 7-м суткам после создания дефектов ПМБК значительно усиливались дистрофические изменения кардиомиоцитов (их саркоплазма становилась более разреженной, литически измененной) (рис. 2а). Сохранялись интерстициальный отек и лимфостаз. К этим изменениям присоединилась дилатация кровеносных сосудов, обусловленная их полнокровием. Характер воспалительноклеточной инфильтрации существенно не менялся, по-прежнему преобладали лимфоциты, присутствовали единичные нейтрофилы.
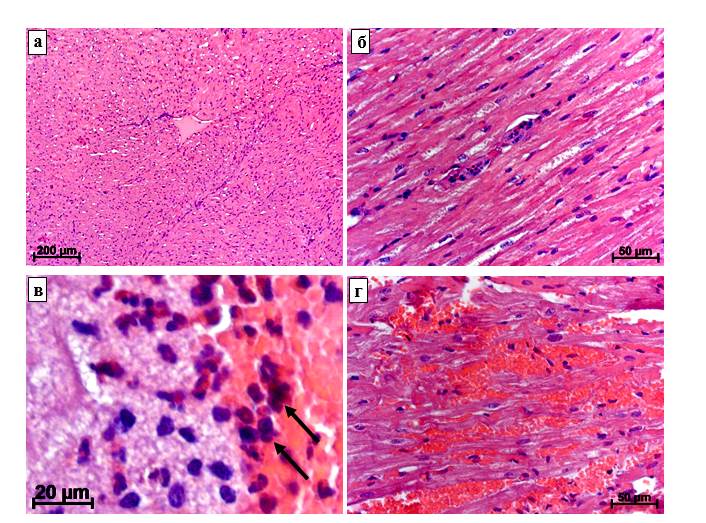
Рис. 1. Миокард кроликов. Окраска гематоксилином и эозином.
а – интактное животное, умеренное венозное полнокровие; б – дистрофические изменения кардиомиоцитов, мононуклеарная инфильтрация через 3 суток после повреждения ПМБК;в – клетки миелоидного ряда (стрелки) в сгустках крови и фибрина через 3 суток эксперимента; г – выраженное полнокровие с диапедезом эритроцитов через 3 суток после повреждения и введения ЭМСК
У животных с дефектами ПМБК и введением ЭМСК в данный срок эксперимента отмечались менее выраженные дистрофические изменения кардиомиоцитов (рис. 2 б), чем в группе без использования данной клеточной технологии. В то же время введение ЭМСК не оказывало существенного влияния на состояние микроциркуляторного русла и выраженность мононуклеарной инфильтрации. Вместе с этим необходимо отметить развитие умеренного периваскулярного склероза, тромбоз и облитерацию просвета некоторых сосудов.
Через 10 суток после создания дефекта ПМБК миокард был компактным. В кардиомиоцитах сохранялись литические изменения, но они были менее выраженными, чем в предыдущий срок (рис. 2в); присутствовало небольшое количество кардиомиоцитов с кариорексисом и кариопикнозом (некробиотически измененных кардиомиоцитов). Снижалась также интенсивность отека, но сохранялась на том же уровне диффузная мононуклеарная инфильтрация миокарда. Следовательно, по мере нарастания репаративной регенерации поврежденных тканей задних конечностей кроликов и стихания воспаления снижались поступление в кровь и транспортировка к сердцу продуктов распада, что обусловливало постепенную нормализацию миокарда.
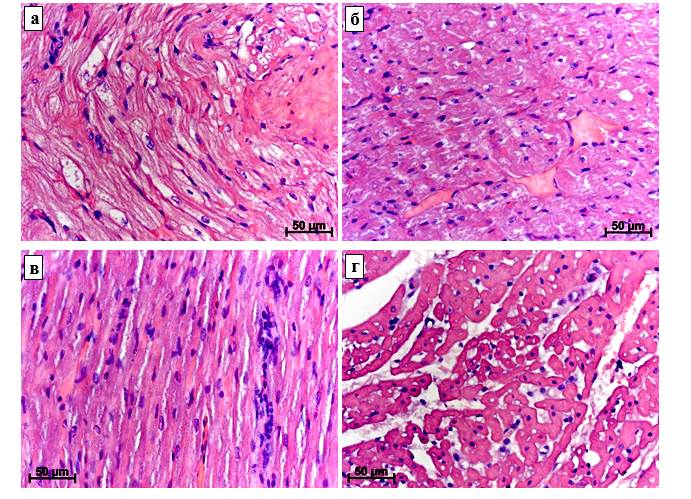
Рисунок 2 – Миокард кроликов после повреждения ПМБК и введения ЭМСК.
Окраска гематоксилином и эозином. а – выраженные дистрофические изменения кардиомиоцитов через 7 суток после повреждения; б – гиперемия и диффузная мононуклеарная инфильтрация через 7 суток после повреждения и введения ЭМСК; в – умеренные дистрофические изменения кардиомиоцитов, усиление диффузной мононуклеарной инфильтрации через 10 суток после повреждения; г – выраженный межпучковый и межволоконный отек и лимфостаз, мононуклеарная инфильтрация через 10 суток после повреждения и введения ЭМСК
Сходные изменения миокарда описаны при экспериментальной черепно-мозговой травме у крыс [15]. В ранний посттравматический период (3–7 суток) регистрировались наиболее выраженные структурные изменения: расширение большинства сосудов микроциркуляторного русла, периваскулярный отек, диапедезные кровоизлияния, в просвете капилляров – мембранные структуры и тромбы из эритроцитов и тромбоцитов. Наблюдались контрактурные и литические изменения части кардиомиоцитов. К 12-м суткам характер изменений сохранялся, но они были менее выраженными.
Через 10 суток после создания дефекта ПМБК и использования ЭМСК в кардиомиоцитах сохранялись в основном околоядерные «опустошения»; наблюдались также кардиомиоциты с кариорексисом и кариопикнозом. Отмечалось неравномерное расширение межпучковых интерстициальных пространств (рис. 2г), обусловленное отеком, интенсивность которого в левом желудочке была выше, чем в правом. Также сохранялись облитерация отдельных сосудов и умеренный периваскулярный склероз.
По данным стереологического анализа миокарда левого и правого желудочков сердца кроликов, повреждение ПМБК сопровождалось уменьшением объемной плотности кардиомиоцитов во все сроки эксперимента в обоих желудочках, но наиболее выраженные изменения происходили через 7 суток (уменьшение соответственно на 19,6% и 21,8%) (табл. 1, 2). К 10-м суткам отмечалась тенденция к увеличению объемной плотности кардиомиоцитов в миокарде обоих желудочков, но эти показатели оставались уменьшенными соответственно на 11% и 5% по сравнению с интактным контролем. При повреждении ПМБК и введении ЭМСК в дефект кости выявлен такой же характер изменений объемной плотности кардиомиоцитов в миокарде левого и правого желудочков – наиболее выраженное уменьшение через 7 суток (соответственно на 20% и 22%) и тенденция к увеличению этого показателя через 10 суток (но при этом объемная плотность кардиомиоцитов оставалась уменьшенной соответственно на 15% и 17,5%).
Таблица 1
Стереологический анализ миокарда левого желудочка сердца кроликов в различные сроки после повреждения ПМБК (S±σ)
|
Показатель |
Интактный контроль |
Время после имплантации |
||
|
3 суток |
7 суток |
10 суток |
||
|
|
Без введения ЭМСК |
|||
|
Объемная плотность (в %): |
|
|
|
|
|
кардиомиоцитов |
93,70±2,18 |
82,40±2,74# |
75,30±1,66#$ |
83,30±2,83#& |
|
капилляров |
3,63±0,81 |
4,89±1,13# |
10,34±1,08#$ |
3,89±1,06& |
|
соединительной ткани |
2,67±0,81 |
12,71±1,39# |
14,36±1,11# |
12,81±0,90 |
|
Объемное отношение (число): капилляров к кардиомиоцитам соединительной ткани к кардиомиоцитам |
0,039±0,014
0,028±0,015 |
0,059±0,012
0,154±0,020 |
0,137±0,014#$
0,191±0,013#$ |
0,047±0,019
0,154±0,018 |
|
|
С введением ЭМСК |
|||
|
Объемная плотность (в %): |
|
|
|
|
|
кардиомиоцитов |
93,70±2,18 |
80,10±1,31# |
74,9±1,27#$ |
80,01±2,18#& |
|
капилляров |
3,63±0,81 |
11,00±0,86# |
7,91±0,72# |
2,92±1,02$& |
|
соединительной ткани |
2,67±0,81 |
8,90±0,84# |
17,19±1,30#$ |
17,07±1,15#$ |
|
Объемное отношение (число): капилляров к кардиомиоцитам соединительной ткани к кардиомиоцитам |
0,039±0,014
0,028±0,015 |
0,137±0,011
0,111±0,011 |
0,105±0,09
0,229±0,013 |
0,036±0,016
0,213±0,017 |
Примечание: # – достоверные отличия от интактного контроля (р≤0,05); $ – достоверные отличия от 3-х суток после операции (р≤0,05); & – достоверные отличия от 7-х суток после операции (р≤0,05).
Таблица 2
Стереологический анализ миокарда правого желудочка сердца кроликов в различные сроки после повреждения ПМБК (S±σ)
|
Показатель |
Интактный контроль |
Время после имплантации |
||
|
3 суток |
7 суток |
10 суток |
||
|
|
Без введения ЭМСК |
|||
|
Объемная плотность (в %): |
|
|
|
|
|
кардиомиоцитов |
96,20±2,05 |
82,10±2,37# |
75,21±1,99#$ |
91,66±2,29$& |
|
капилляров |
1,23±0,79 |
5,59±0,92# |
10,90±0,94#$ |
4,56±0,74& |
|
соединительной ткани |
2,55±0,85 |
12,31±1,55# |
13,89±1,09# |
3,78±0,96$& |
|
Объемное отношение (число): капилляров к кардиомиоцитам соединительной ткани к кардиомиоцитам |
0,013±0,014
0,027±0,014 |
0,068±0,016
0,150±0,019 |
0,145±0,015
0,185±0,015, |
0,049±0,015
0,041±0,016 |
|
|
С введением ЭМСК |
|||
|
Объемная плотность (в %): |
|
|
|
|
|
кардиомиоцитов |
96,20±2,05 |
80,40±2,23# |
75,00±1,50#$ |
79,30±3,35# |
|
капилляров |
1,23±0,79 |
12,00±0,82#* |
8,34±0,91# |
3,97±0,72#& |
|
соединительной ткани |
2,55±0,85 |
7,60±1,08 |
16,66±0,75#$* |
16,73±1,62 |
|
Объемное отношение (число): капилляров к кардиомиоцитам соединительной ткани к кардиомиоцитам |
0,013±0,014
0,027±0,014 |
0,149±0,015
0,095±0,020 |
0,111±0,012
0,222±0,011 |
0,050±0,020
0,211±0,025 |
Примечание: # – достоверные отличия от интактного контроля (р≤0,05); $ – достоверные отличия от 3-х суток после операции (р≤0,05); & – достоверные отличия от 7-х суток после операции (р≤0,05).
Изменения объемной плотности капилляров в миокарде левого и правого желудочков при повреждении ПМБК носили волнообразный характер. При этом в левом желудочке данный показатель возрастал в 2,8 раза через 7 суток эксперимента и к 10-м суткам возвращался до значений интактного контроля (табл. 1), в то время как в правом желудочке существенное увеличение объемной плотности капилляров (в 4,5 раза) происходило уже через 3 суток; через 7 суток отмечено максимальное увеличение данного показателя (в 8,9 раза), к 10-м суткам он снижался, но оставался увеличенным (в 3,7 раза) по сравнению с интактным контролем (табл. 2). Использование ЭМСК при повреждении ПМБК сопровождалось более значительным увеличением объемной плотности капилляров в миокарде обоих желудочков уже через 3 суток эксперимента (соответственно в 4 и 9,8 раза по сравнению с интактным контролем). Этот показатель оставался увеличенным до 7-х суток эксперимента (соответственно в 2,2 и 6,8 раза), а к 10-м суткам в левом желудочке он снижался до уровня интактного контроля, а в правом – оставался увеличенным в 3,2 раза.
Наиболее значительные изменения объемной плотности после повреждения ПМБК выявлены для компонентов соединительной ткани (суммарно клетки, волокна и основное вещество) миокарда как в левом, так и в правом желудочках (табл. 1, 2). В левом желудочке этот показатель был увеличен через 3 и 10 суток в 4,8 раза, через 7 суток – в 5,4 раза; в правом желудочке через 3 и 7 суток – соответственно в 4,8 и 5,4 раза, через 10 суток этот показатель возвращался к уровню интактного контроля. При использовании ЭМСК этот показатель возрастал в левом желудочке через 3 суток в 3 раза, через 7 и 10 суток – в 6,4 раза. В правом желудочке объемная плотность соединительной ткани возрастала через 3 суток в 3 раза, через 7 и 10 суток – в 6,5 раза.
Разнонаправленные изменения объемной плотности кардиомиоцитов и соединительной ткани обусловили значительное увеличение объемного отношения соединительнотканных компонентов к кардиомиоцитам в обоих желудочках сердца при повреждении ПМБК, в том числе при использовании ЭМСК. Следует отметить, что в обоих желудочках этот показатель в первые 7 суток возрастал в одинаковой степени (соответственно в 5,5 и 6,8 раза без использования ЭМСК и в 3,9 и 8,2 раза при их применении). Через 10 суток при отсутствии введения ЭМСК в левом желудочке данный показатель оставался увеличенным в 5,5 раза, в то время как в правом – в 1,5 раза. При использовании ЭМСК объемное отношение соединительнотканных компонентов к кардиомиоцитам оставалось увеличенным через 10 суток в обоих желудочках в 7,6–7,8 раза. Такое значительное увеличение объемного отношения соединительнотканных компонентов к кардиомиоцитам в обоих желудочках сердца обусловлено преимущественно развитием выраженного отека миокарда в результате нарушений кровообращения, возникающих в ответ на отдаленное повреждение костной ткани и опосредованных медиаторами воспаления.
Заключение
Повреждение ПМБК у кроликов сопровождается развитием дистрофических (литических) изменений кардиомиоцитов, отеком миокарда, полнокровием, лейкоцитарной инфильтрацией с преобладанием лимфоцитов. В процессе обширных операций на трубчатых костях конечностей возможно попадание структур красного костного мозга в правые полости сердца с формированием тромбов. Применение ЭМСК способствует более выраженной дилатации кровеносных сосудов с формированием обширных геморрагий (особенно в начальные сроки эксперимента), формированию тромбов как в полостях сердца, так и в его сосудах, пролонгации явлений отека, но снижению выраженности литических изменений кардиомиоцитов.
Наиболее выраженные изменения структурной организации миокарда правого и левого желудочков сердца кроликов после повреждения ПМБК, в том числе и при введении ЭМСК, происходят через 7 суток эксперимента: уменьшение объемной плотности кардиомиоцитов на 20–22%, увеличение объемной плотности кровеносных капилляров (более выраженное в правом желудочке – до 8,9 раза без использования ЭМСК и до 9,8 раза – с их введением) и суммарной объемной плотности клеток, волокон и основного вещества соединительной ткани в 5–7 раз.
Результаты проведенного исследования свидетельствуют о том, что в миокарде правого и левого желудочков развиваются одинаковые про направленности структурно-функциональные изменения в ответ на дистантное повреждение костной ткани, которые сохраняются в течение не менее 10 суток. Выявленные изменения составляют структурную основу сердечной недостаточности в посттравматический период. Применение ЭМСК сопровождается снижением литических изменений кардиомиоцитов, но более выраженными нарушениями гемодинамики с формированием обширных геморрагий.
Работа выполнена при финансовой поддержке ПФНИ ГАН темы (VI.62.2.1, 0309-2016-0006) «Разработка технологий получения материалов для регенеративной медицины и развитие методов восстановления репродуктивного здоровья» и темы (0535-2019-0028) «Клеточные и молекулярные механизмы повреждения и ремоделирования тканей и органов при метаболических нарушениях и токсических воздействиях, разработка технологий стимуляции цитопротекторных реакций и тканеспецифической репаративной регенерации».



