Антисинтетазный синдром (АСС) – это редкий аутоиммунный синдром, характеризующийся воспалительной миопатией, артритом, интерстициальным заболеванием легких (ИЗЛ), лихорадкой, феноменом Рейно и рукой механика. АСС тесно связан с присутствием антисинтетазных антител, которые участвуют в патогенезе мышечного и легочного повреждения и напрямую коррелируют с активностью заболевания. У 86% пациентов с АСС обнаруживаются миозит-специфические антитела Jo-1 [1].
Эпидемиология. Аутоиммунные заболевания являются актуальной проблемой современной медицины, являясь факторами риска развития нетрудоспособности и тяжелых сопутствующих хронических состояний [2]. Поскольку АСС редкое заболевание, точных данных о его распространенности нет. Однако известно, что у 30% пациентов с идиопатическими воспалительными миопатиями можно диагностировать АСС по наличию специфических антител. Заболеваемость идиопатической воспалительной миопатией (ИВМ) составляет примерно 2 случая на 100 000 человек в общей популяции, поэтому ежегодную заболеваемость АСС можно считать примерно 0,6 на 100 000 человек. АСС поражает женщин и мужчин примерно в соотношении 2:1 в возрасте от 22 до 74 лет, а средний возраст постановки диагноза составляет 50 лет [1].
Патогенез и антисинтетазные аутоантитела. Каждая из аминоацил-тРНК-синтетаз принадлежит к семейству цитоплазматических ферментов, которые катализируют связывание аминокислот с соответствующей тРНК во время фазы трансляции синтеза белка. В каждой клетке присутствует двадцать различных синтетаз, соответствующих одной аминокислоте [1]. Антитела против восьми синтетаз обнаруживаются в крови 16-26% пациентов с ИВМ. Распространенность анти-Jo-1 составляет 15–25% у пациентов с полимиозитом (ПМ) и дерматомиозитом (ДМ). Анти-PL-7 и анти-EJ выявляются только в 5–10% случаев, а другие – еще реже. Хотя антисинтетазы обычно нацелены на ферментный компонент тРНК-синтетаз, только анти-PL-12 распознает тРНК напрямую. Перекрестной реактивности между антисинтетазными антителами, видимо, не существует [3]. Пока неизвестно, как внутриклеточные компоненты трансляции белков запускают аутоиммунную реакцию и поддерживают воспалительный ответ. Внутренние фрагменты аминоацил-тРНК-синтетаз, высвобождаемые из поврежденных мышечных клеток после вирусного или другого типа повреждения, обладают цитокиноподобными эффектами. Кроме того, аминоацил-тРНК-синтетазы действуют как сигнальные молекулы, увеличивая продукцию фактора некроза опухоли макрофагами. Видимо, в патогенезе АСС задействованы механизмы как врожденного, так и адаптивного иммунного ответа [1; 3]. Патогенная роль антител Jo-1 в этом управляемом антигеном иммунологическом механизме подтверждается переключением классов антител, созреванием аффинности и отсутствием перекрестной реактивности [4]. Более того, Jo-1 непосредственно активирует главный комплекс гистосовместимости и индуцирует воспаление мышц и легких [3; 4]. Jo-1–реактивные Т-клетки могут быть обнаружены в периферической крови пациентов с АСС и могут способствовать клеточному цитолизу мышечных клеток. Сывороточные уровни интерферон-индуцируемых хемокинов, таких как CXCL9 и CXCL10, участвующих в процессе рекрутирования активированных Т-клеток, значительно выше у Jo-1-позитивных пациентов с ИЗЛ [4]. Интересно, что экспрессия Jo-1 выше в здоровых легких по сравнению с другими органами, что может объяснять более высокую частоту поражения легких у пациентов с анти-Jo-1-позитивными ИВМ [4].
Клинические проявления АСС. Клинические симптомы АСС значительно различаются, хотя они частично зависят от задействованной антисинтетазы. Пациенты с АСС могут иметь миозит, ИЗЛ, артралгии, артрит, феномен Рейно, руку механика, лихорадку (таблица 1) [5].
Таблица 1
Клинические проявления АСС
|
Клинические проявления |
Частота (%) |
Комментарии |
|
Интерстициальное заболевание легких |
90 |
Может предшествовать миозиту |
|
Миозит |
78-91 |
Jo-1+: ПМ>ДМ OJ+: ДМ>ПМ KS+: ДМ>ПМ PL-7+: амиопатическая форма PL-12+: амиопатическая форма |
|
Феномен Рейно |
62 |
Обычно не тяжелое течение |
|
Артропатия |
64-83 |
|
|
Лихорадка |
20 |
Частота во время обострений 87% |
|
Рука механика |
17-71 |
|
Хотя пациенты с миозитом, ассоциированным с АСС, демонстрируют клинические признаки, сходные с таковыми у пациентов с ИВМ [4], существуют различные гистопатологические особенности, включая фрагментацию и воспаление перимизиальной соединительной ткани и периферифасцикулярную атрофию. Обычно это не первый симптом АСС: он может проявляться спустя годы после дебюта заболевания. Миозит чаще ассоциирован с Jo-1 с зарегистрированной частотой 78–91% [5]. Интересно, что анти-Jo-1 могут быть обнаружены в сыворотке крови до начала клинически значимого миозита [6] (таблица 1) [6].
Классически описываемое кожное проявление АСС – гиперкератотическая эритема на боковой и ладонной поверхностях руки пальцев (рука механика) (рисунок) [6]. Эритема может напоминать экзему кистей или контактный профессиональный дерматит (отсюда и название). Хотя наличие «руки механика» тесно связано с АСС, это состояние неспецифично и также может наблюдаться при ДМ, связанном с другими аутоантителами [5; 6].
Артрит чаще наблюдается у серологически позитивных пациентов с АСС (64–83%) по сравнению с пациентами с отрицательной серологией (18%). Артрит, связанный с АСС, может имитировать более распространенные воспалительные артриты. При наличии отрицательных или слабоположительных антител к циклическому цитруллинированному пептиду или при наличии феномена Рейно, склеродактилии и изменений капилляров ногтевого ложа следует рассматривать возможность АСС.
ИЗЛ – это гетерогенная группа заболеваний, которая характеризуется воспалением и фиброзом лёгочного интерстиция. Причиной ИЗЛ могут быть гранулематозные заболевания, воздействия профессиональных факторов, заболевания соединительной ткани [7]. Распространённость ИЗЛ у пациентов с ИВМ составляет 23,1-65% [8]. ИЗЛ – основная причина смерти этих пациентов. Наличие антисинтетаз – фактор риска ИЗЛ у пациентов с ИВМ [8]. Известно, что 86% пациентов с АСС имеют ИЗЛ. Диагноз ИЗЛ, связанного с АСС, может быть поставлен на любом этапе заболевания и может предшествовать или следовать за миозитом (если таковой имеется). При АСС антисинтетазные антитела чаще обнаруживаются у пациентов с предшествующим ИЗЛ, чем с предшествующим миозитом. Миозит может отсутствовать у пациентов с ИЗЛ, ассоциированным с АСС. Амиопатическое АСС-ассоциированное ИЗЛ чаще всего наблюдается в сочетании с присутствием анти-PL-12, анти-Jo-1 и анти-OJ. Наличие антисинтетазных антител является предиктором рецидивирующего течения и позднего начала миопатии. Хотя в 50% случаев симптомы появляются постепенно, нередко ИЗЛ, ассоциированное с АСС, может проявляться как острый респираторный дистресс-синдром с рефрактерной дыхательной недостаточностью. При обследовании пациентов с подозрением на ИЗЛ часто используются рентгенография грудной клетки и функциональные легочные тесты. Однако обычная рентгенография грудной клетки может быть недостаточной для оценки [7; 8]. Компьютерная томография высокого разрешения грудной клетки (КТВР) предлагает дополнительные возможности для подтверждения ИЗЛ. В многоцентровом ретроспективном исследовании Jo-1-позитивные пациенты с АСС и с постепенным началом ИЗЛ имели более частое поражение нижних отделов легких [7]. У пациентов с острым началом заболевания было обнаружено три различных паттерна заболевания: диффузное, пятнистое поражение в виде «матового стекла»; неправильные линейные помутнения в базальных отделах; и очаги консолидации в базальных отделах. Такой признак, как «сотовое легкое», обнаруживаются нечасто. Помутнения по типу «матового стекла», наблюдаемые на КТВР, обычно связаны с прогрессирующим течением заболевания [9]. Патогистологические паттерны не являются специфическими для ассоциированных с АСС ИЗЛ. Неспецифическая интерстициальная пневмония, обычная интерстициальная пневмония, криптогенная организующаяся пневмония, диффузное альвеолярное повреждение были описаны при АСС. Клинически каждый подтип демонстрирует тонкие различия. При ДМ неспецифическая интерстициальная пневмония наблюдается чаще [7; 9]. Ответ на лечение частично зависит от характера появления симптомов. Можно предположить, что воспалительные заболевания, такие как неспецифическая интерстициальная пневмония, обычная интерстициальная пневмония, криптогенная организующаяся пневмония, диффузное альвеолярное повреждение, приведут к острому процессу, который поддается лечению кортикостероидами. Фиброзные изменения в легких со скудным воспалительным инфильтратом с большей вероятностью будут иметь постепенное начало, прогрессирующее течение и плохой ответ на кортикостероиды без других иммунодепрессантов [6]. Паттерн КТВР является диагностическим и прогностическим маркером ИЗЛ. Серологическое профилирование и клинические проявления у пациентов с ИЗЛ могут дополнительно помочь в прогнозировании исхода. Повышенная смертность от ИЗЛ была связана с серопозитивностью к анти-SSA/Ro и анти-Jo-1 антителам [8]. Обычная интерстициальная пневмония ассоциирована с наличием положительным SSA/Ro, в то время как неспецифическая интерстициальная пневмония чаще обнаруживается у SSA/Ro-отрицательных пациентов [6; 8]. Кроме того, был замечен более устойчивый ответ на терапию у пациентов с АСС без антител к SSA/Ro. Ретроспективно, плохая выживаемость пациентов с ИЗЛ была связана с поражением сердца, гипоальбуминемией, амиопатическим ДМ, ассоциированным с ИЗЛ [9]. Позитивность по отношению к Jo-1 дает небольшое кумулятивное преимущество в выживаемости по сравнению с позитивностью к другим антисинтетазным антителам: 90% против 70% через 5 лет (P<0,01) [10]. Текущие исследования сосредоточены на обнаружении биомаркеров активности заболевания, которые помогут определить прогноз и выживаемость у пациентов с воспалительной миопатией и ИЗЛ. Достаточно часто на фоне ИЗЛ наблюдается легочная гипертензия. Существует диссоциация между тяжестью легочной гипертензии и степенью фиброзирования легких при ИЗЛ [10], что указывает на то, что легочная гипертензия – это отдельный патологический процесс, не связанный с заболеванием легких. Другие сердечно-легочные проявления АСС включают кардит, кардиомиопатию, перикардит и плеврит [6; 10].
Цель исследования. Анализ клинического случая поздней диагностики антисинтетазного синдрома. Данное наблюдение демонстрирует сложность ранней диагностики этого редкого синдрома.
Материалы и методы исследования. В качестве примера приводится клинический случай поздней диагностики антисинтетазного синдрома.
Пациентка М., 1960 г.р., наблюдается у ревматолога с 2015 г. В 2009 г. отметила появление одышки, дыхательного дискомфорта; в 2011 г. появились лихорадка до 39°С, усилилась одышка. С 2012 г. наблюдалась у пульмонолога с диагнозами «Экзогенный аллергический альвеолит», «Идиопатический фиброзирующий альвеолит», по поводу чего постоянного принимала преднизолон 10 мг в сутки и азатиоприн 100 мг в сутки. Несмотря на лечение, состояние пациентки ухудшалось: фебрильная лихорадка, наросла одышка, уменьшилась толерантность к физическим нагрузкам, появились боли в суставах кистей, очаги гиперкератоза на кистях. В феврале 2015 г. пациентка отметила появление слабости проксимальных мышц верхних и нижних конечностей, был зафиксирован высокий уровень креатинфосфокиназы (>4000 ед/л), что явилось причиной коррекции терапии: проведена пульс-терапия с последующим приемом преднизолона в дозе 12 таблеток в сутки. Однако снижение дозы привело к появлению мышечной слабости и повышению креатинфосфокиназы (2641 ед/л). Весной 2015 г. впервые консультирована ревматологом: ревматическое заболевание было отвергнуто. Летом 2015 г. пациентка проконсультирована в НИИ ревматологии им. В.А. Насоновой, где был диагностирован антисинтетазный синдром. В качестве терапии были рекомендованы метилпреднизолон (12 мг в сутки per os) и циклофосфан (1000 мг в месяц внутримышечно). На фоне терапии наросла мышечная сила, нормализовался уровень креатинфосфокиназы, однако по данным КТВР интерстициальные изменения в легких прогрессировали. Кроме того, отмечено прогрессивное снижение ЖЕЛ: с 3,14 л в 2013 г. до 2,33 л в 2019 г. Это явилось причиной коррекции лечения: в марте 2019 г. циклофосфан был заменен микофенолатоммофетилом (1,5 г в сутки). Выбранную схему терапии принимает по настоящее время, находясь под наблюдением ревматолога.
Данные лабораторных и инструментальных методов исследования на момент постановки диагноза
Общий анализ крови: эритроциты – 4,0*1012/л, гемоглобин – 117 г/л, тромбоциты – 389*109/л, лейкоциты – 10,7*109/л, эозинофилы – 1%, палочкоядерные – 2%, сегментоядерные – 72%, лимфоциты – 20%, моноциты – 3%, СОЭ – 15 мм/час.
Биохимическое исследование крови: аланиновая аминотрансфераза – 240 МЕ/л; аспарагиновая аминотрансфераза – 162 МЕ/л; лактатдегидрогеназа – 1242 ед/л, креатинфосфокиназа – 2641 ед/л; креатинфосфокиназа МВ – 116,8 ед/л; C-реактивный белок – 8,9 мг/л, глюкоза – 5,4 ммоль/л; общий билирубин – 10,7 мкмоль/л; мочевина – 5,9 ммоль/л; креатинин – 73 ммоль/л; общий белок – 48 г/л.
Иммунологическое исследование: антинуклеарный фактор (HEp 2) 1:160; антитела к Jo-1 ++; антитела к SSA/Ro-52 ++; антитела к SSB/La ++; АЦЦП <0,5 ед/мл; ревматоидный фактор < 8 МЕ/мл.
Общий анализ мочи: без патологических изменений.
Биоптат кожно-мышечного лоскута: воспалительный инфильтрат с дегенерацией и некрозом скелетных мышц.
Электромиография: данные свидетельствуют о воспалительной миопатии.
Компьютерная томография органов грудной клетки: неспецифическая интерстициальная пневмония.
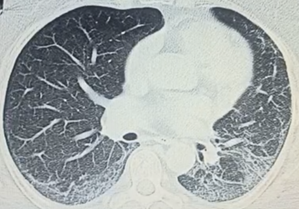
Неспецифическая интерстициальная пневмония (бронхоэктазы на фоне зон матового стекла)
Диагноз. Антисинтетазный синдром: неспецифическая интерстициальная пневмония, «рука механика», артралгия, миозит, лихорадка, дистальная сенсорная полинейропатия, иммунные нарушения (антинуклеарный фактор, антитела к Jo-1, антитела к SSA/Ro-52, антитела к SSB/La).
Критерии Соломона и критерии Коннора для АСС приведены в таблице 2 [3].
Таблица 2
Классификационные критерии АСС
|
Критерии |
Критерии Соломона |
Критерия Коннора |
|
Иммунологические |
Любое антисинтетазное антитело |
Любое антисинтетазное антитело |
|
Клинические |
Большие критерии: ИЗЛ ПМ/ДМ по Питеру и Бохану Малые критерии: Артрит Феномен Рейно Рука механика |
ИЗЛ ПМ/ДМ по Питеру и Бохану Артрит Феномен Рейно Рука механика Персистирующая, необъяснимая лихорадка |
|
Критерии для подтверждения диагноза |
Антисинтетазное антитело+ 2 больших критерия ИЛИ антисинтетазное антитело + по крайней мере 1 большой критерий или 2 малых критерия |
Антисинтетазное антитело + по крайней мере 1 клинический критерий |
Анализ показал, что представленный случай соответствует всем классификационным критериям антисинтетазного синдрома Соломона и Коннора. Анализируя представленное наблюдение, можно заметить, что первыми проявлениями АСС у пациентки явились ИЗЛ и лихорадка, затем по прошествии нескольких лет последовательно появлялись другие симптомы АСС: миозит, рука механика, артралгия. Иммунологические маркеры, выявленные у пациентки (Jo-1, SSA/Ro-52), позволяют предполагать неблагоприятный прогноз и дальнейшее прогрессирование интерстициального поражения легких).
Результаты исследования и их обсуждение. Клинические проявления АСС могут быть достаточно разнообразными, особенно в дебюте заболевания. Практикующие врачи должны знать о случаях АСС, которые начинаются только с изолированного поражения мышц, суставов или легких [11-13]. Примерно в 27% случаев АСС изолированный полиартрит может быть единственным симптомом, что приводит к запаздыванию постановки диагноза в среднем на 27 месяцев, в отличие от 18 месяцев задержки у пациентов, которые дебютируют с полиартритом, ИЗЛ и/или миозитом [11]. При симметричном полиартрите следует исследовать анти-Jo-1, даже если ревматоидный фактор и антитела к циклическому цитруллинированному пептиду положительны, особенно при наличии системных проявлений [11; 14-16]. Кроме того, возможно, случаи ревматоидного артрита, леченного анти-ФНО-α препаратами, с последующим развитием миозита, на самом деле могут быть примерами естественной эволюции АСС [11; 15; 16]. Аналогичным образом, пациенты с ИЗЛ должны обязательно тестироваться на наличие Jo-1 и других миозит-специфических антител. Это связано с тем, что ИЗЛ, ассоциированные с различными специфическими для миозита антителами, имеют разные варианты течения и прогноз. При обнаружении антител, специфичных к миозиту, следует регулярно проводить КТВР и функциональные легочные тесты для исключения ИЗЛ [11]. Пациенты с АСС и негативные по Jo-1 аутоантителам имеют худший прогноз. Существует важная ассоциация SSA/Ro-52 с анти-Jo-1, которую можно первоначально спутать с синдромом Шегрена. Биопсия малой слюнной железы помогает дифференцировать синдром Шегрена от других ревматических заболеваний с аналогичными симптомами, а наличие анти-Jo-1 указывает на то, что это АСС. В случаях, невосприимчивых к кортикостероидам и иммунодепрессантам, ритуксимаб может быть полезным, но установленной продолжительности лечения нет [17-19]. Это оптимальный вариант для АСС с отсутствием Jo-1 [20] и в случае АСС, ассоциированного с АЦЦП позитивным ревматоидным артритом [18; 19].
Выводы. Клинические проявления АСС могут иметь разные дебюты и сочетания симптомов. Симптомы могут возникнуть последовательно в течение длительного периода времени, даже если лечение уже начато. Миозит, артрит (воспалительная артралгия), ИЗЛ – клинические проявления АСС, которые встречаются с наибольшей частотой. Естественное течение и прогноз АСС индивидуален в каждом конкретном случае. Подобный характер течения заболевания достаточно часто вызывает затруднения с постановкой диагноза у врачей разных специальностей (ревматологи, пульмонологи). С этой целью в план обследования у пациентов с вышеперечисленными нозологиями (особенно если они резистентны к обычной терапии) следует включать специфические аутоантитела, связанные с АСС.



