Одной из важнейших проблем здравоохранения были и остаются ревматические заболевания (РЗ). Их развитие является результатом сложного взаимодействия экологических, иммунных, половых факторов, факторов индивидуального генетического риска и случайных событий. Ревматоидный артрит (РА) – воспалительное ревматическое гетерогенное заболевание с полиорганной патологией. При этом все большее значение в патогенезе РЗ приобретает признание роли нарушений микробиома, аномальная структура которого выявляется при ряде аутоиммунных заболеваний, в частности при ревматоидном артрите [1, 2]. Микробиота и ее коллективные метаболические продукты оказывают глубокое влияние на иммунную систему хозяина и способствуют развитию РА на генетическом, функциональном и фенотипическом уровнях [3]. Микробные сообщества организма, изменение колонизационных свойств основных представителей микробиома с повышением представительства редких таксонов могут определять прогностический профиль и прогрессирование заболевания [4]. Изменение биоценоза в одном биотопе может сопровождаться изменением колонизационной резистентности всей микроэкологической системы организма. В этом процессе может иметь значение транслокация микроорганизмов в нетипичные биотопы. В настоящее время появляется все больше доказательств, подтверждающих роль транслокации комменсальных бактерий через нарушенный кишечный барьер к внекишечным участкам в патогенезе аутоиммунных и других хронических неинфекционных заболеваний [5]. Практическое значение приобретает изучение роли кишечных оппортунистических микроорганизмов в формировании микробиома организма больных при ревматоидном артрите. Всестороннее изучение особенностей микробиома расширяет представление о ревматоидном артрите как мультифакторном аутоиммунном заболевании и может явиться основой для разработки новых стратегий лечения ревматоидного артрита, нацеленных на микробные процессы организма больного.
Цель исследования
Выявить распространение микробиологических нарушений микрофлоры кишечника и установить характерные особенности изменений микробиома при РА.
Материал и методы исследования
Обследованы 60 больных ревматоидным артритом и 40 условно здоровых лиц, составивших группу сравнения. При диагностике заболевания использовали критерии Американской ревматологической ассоциации для РА (1991). Обследование пациентов включало клинико-лабораторные и микробиологические методы. В соответствии с поставленной целью в исследование включены больные РА женщины в возрасте 56,74±11,06 года. Пациенты обследовались при поступлении в стационар или на амбулаторном приеме до начала активной терапии. Пациенты имели умеренную/низкую активность заболевания (DAS28: 3,67±0,94). На момент обследования больные получали базисную терапию (метотрексат 7,5–15 мг в неделю), симптоматическую терапию (НПВП в средних терапевтических дозах). В течение 6 месяцев до момента исследования пациенты не применяли антибактериальных и микробных биологических препаратов (про- и пребиотиков). Группу сравнения составили лица в возрасте 53,25±8,36 года, у которых отсутствовали клинические проявления дисбиоза, качественные и количественные показатели состава микрофлоры кишечника соответствовали показателям здоровых людей (ОСТ 91500.11.0004-2003). Изучение микрофлоры толстого кишечника проводили в соответствии с приказом Минздрава РФ № 231 «Об утверждении отраслевого стандарта “Протокол ведения больных, Дисбактериоз кишечника”» (2003). Определялась качественная и количественная характеристика просветной микрофлоры кишечника на основании изучения частоты выделения отдельных видов микроорганизмов и их титров в КОЕ/г испражнений. Анализировались наличие и степень микробиологических нарушений микробиоценоза кишечника: отсутствие нарушений, I, II, III степени нарушений. Характер микрофлоры слизистых оболочек носа и мочи изучали, руководствуясь приказом № 535 «Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений». Из материала открытых биотопов проводились выделение и идентификация чистых культур микроорганизмов в соответствии с их биологическими свойствами. Статистический анализ данных выполнен с помощью программы STATISTICA 10.0. Использовали параметрические и непараметрические методы статистики. При проверке на нормальность распределения совокупности количественных данных использовали критерий Колмогорова–Смирнова с поправкой Лиллиефорса и Шапиро–Уилка. Результаты оценки количественных признаков с нормальным распределением представлены в виде средней ± стандартное отклонение (М±SD). Определение статистической значимости различий средних величин с нормальным распределением проводили с помощью t-критерия Стьюдента. Статистическую значимость различий дискретных величин определяли, используя критерий χ2 Пирсона с поправкой на непрерывность по Йейтсу. Различия между группами при р<0,05 были статистически значимыми.
Результаты исследования и их обсуждение
Результаты изучения кишечного микробиома у больных РА представлены в таблице 1. При исследовании представительства основных видов микроорганизмов в составе кишечной микрофлоры установлено существенное изменение их количественного состава.
Таблица 1
Микробиом кишечника у больных РА
|
Микроорганизмы |
Количество микроорганизмов lg КОЕ/г |
||
|
У больных РА, n=60 |
У здоровых, n=40 |
||
|
М±SD |
М±SD |
р |
|
|
Bifidobacterium |
6,82±0,92 |
9,11±0,93 |
<0,01 |
|
Lactobacillus |
6,92±1,73 |
7,15±1,09 |
>0,05 |
|
Bacteroides |
7,63±1,43 |
9,45±0,82 |
>0,05 |
|
Enterococcus |
7,20±1,81 |
3,20± 0,84 |
<0,01 |
|
Clostridium |
4,80±0,42 |
5,37±1,01 |
>0,05 |
|
Escherichia |
5,36±1,33 |
7,37±0,08 |
<0,05 |
|
Escherichia со сниженной ферментативной активностью |
6,78±1,84 |
3,89±0,60 |
<0,01 |
|
Условно-патогенные бактерии семейства Enterobacteriaceae |
5,33±1,87 |
0 |
<0,01 |
|
Staphylococcus |
5,17±1,27 |
2,88±0,93 |
<0,01 |
|
Staphylococcus aureus |
2,67±0,50 |
0 |
<0,01 |
Количественные изменения характера кишечной микрофлоры проявлялись статистически значимым снижением представительства бактерий рода Bifidobacterium до lg 6,82±0,92 КОЕ/г, данные микроорганизмы у здоровых лиц высевались в титре 9,11±0,93 КОЕ/г (p<0,01). У больных РА значительно возрастал титр микроорганизмов рода Enterococcus – до 7,20±1,81 КОЕ/г (р<0,01). Установлено статистически значимое снижение количества типичных лактозопозитивных Escherichia coli до 5,36±1,33КОЕ/г, а Escherichia coli со сниженной ферментативной активностью, напротив, высевались в большем количестве, равном 6,78±1,84 КОЕ/г. У лиц группы сравнения кишечные палочки были представлены типичными лактозопозитивными бактериями в титре 7,37±0,08 КОЕ/г (p<0,05) и статистически значимым меньшим количеством Escherichia coli со сниженной ферментативной активностью (p<0,01). Особенностью кишечного микробиома было наличие условно-патогенных бактерий семейства Enterobacteriaceae в титре lg5,33±1,87 КОЕ/г и рода Staphylococcus, включая коагулазоположительные стафилококки вида Staphylococcus aureus в титре lg2,67±0,50 КОЕ/г, в то время как у лиц группы сравнения данные микроорганизмы не высевались (р<0,01).
Установленные изменения представительства отдельных видов микроорганизмов у больных РА позволили определить наличие микробиологических нарушений микрофлоры кишечника (рис. 1). У 91,7% больных РА выявлялись различные степени микробиологических нарушений кишечной микрофлоры. Микробиологические нарушения кишечной микрофлоры I степени были установлены в 11,7% случаев, IIстепени — в 33,3% и III степени — в 46,7% случаев. У 8,3% больных и лиц группы сравнения микробиологических нарушений микрофлоры кишечника не установлено. Степени микробиологических нарушений кишечной микрофлоры определены в соответствии с их характеристикой (ОСТ 91500.11.0004-2003). Характерной особенностью этих изменений было наличие в составе кишечного микробиома условно-патогенных бактерий. При I степени микробиологических нарушений кишечной микрофлоры наблюдалось снижение числа типичных лактозопозитивных эшерихий до 106–105 КОЕ/г; при II степени отмечено обнаружение ассоциаций условно-патогенных микроорганизмов в концентрации 104–105 КОЕ/г; при III степени ассоциации условно-патогенных микроорганизмов выявлены в концентрации 106–107 КОЕ/г.
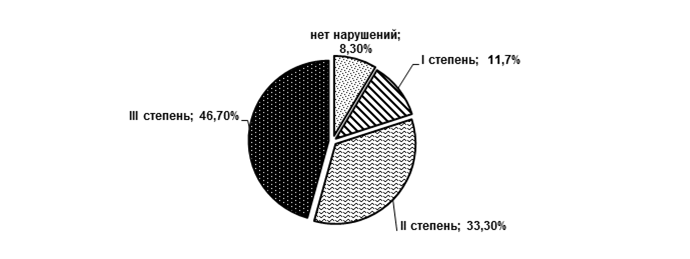
Рис. 1. Относительная частота микробиологических нарушений кишечной микрофлоры убольных РА
Наряду с этим у больных РА существенно изменялась колонизация открытых биотопов оппортунистическими микроорганизмами семейства Enterobacteriaceae (рис. 2). Изучение микробиоценоза кишечника, слизистых оболочек верхних дыхательных путей (ВДП) и мочи показало, что оппортунистические микроорганизмы не только обнаруживались в кишечнике больных, но и распространялись в нетипичные биотопы. В кишечнике были обнаружены условно-патогенные бактерии семейства Enterobacteriaceae, представленные родами Escherichia (у 100% больных), Proteus (20%), Klebsiella (10%), Enterobacter (23,3%), Morganella (5%). Данные микроорганизмы были выделены и со слизистой оболочки верхних дыхательных путей: бактерии рода Escherichia – у 10% больных, Proteus – у 1,7%, Klebsiella – у 13,3%, Enterobacter – у 5% и Morganella – у 6,7% пациентов. При бактериурии, которая установлена у 85% больных, были изолированы штаммы бактерий рода Escherichia – у 54,9%, Proteus – у 23,5%, Klebsiella – у 5,9%, Enterobacter – у 13,7% и Morganella – у 11,8% больных.
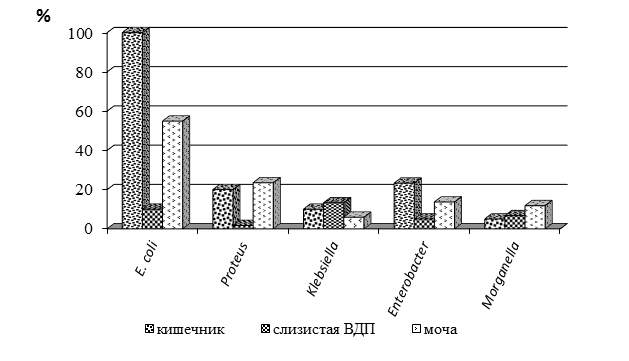
Рис. 2. Относительная частота колонизации открытых биотопов условно-патогенными бактериями семейства Enterobacteriaceae
Изучение особенностей микробиома при ревматоидном артрите свидетельствует о значительном количественном и качественном изменении колонизационных свойств микроорганизмов, заселяющих открытые биотопы организма больных. При исследовании представительства основных микроорганизмов кишечной микрофлоры установлено статистически значимое повышение количества патобионтов (оппортунистических бактерий семейства Enterobacteriaceae, стафилококков, включая коагулазоположительные кокки вида Staphylococcus aureus, энтерококки и кишечные палочки с измененными ферментативными свойствами). Значительное увеличение количества бактерий рода Enterococcus может индуцировать аутоиммунитет и играть роль провокатора хронизации патологического процесса [5]. Данные количественные изменения кишечной микробиоты могут изменять иммунный ответ, снижать проницаемость эпителия, дестабилизировать кишечный барьер и способствовать развитию инфекционных осложнений [6]. Распространение условно-патогенных энтеробактерий, обладающих природной резистентностью и способностью к формированию вторичной резистентности к антибиотикам, может затруднять профилактику и лечение коморбидных инфекций у пациентов с РА. Количественные и качественные изменения микробиома характеризуют развитие микробиологических нарушений кишечной микрофлоры у 91,7% больных. С высокой частотой регистрировались микробиологические нарушения кишечной микрофлоры II–III степени, что проявлялось обнаружением в кишечнике ассоциации условно-патогенных микроорганизмов. В составе микробных ассоциаций определялись условно-патогенные бактерии семейства Enterobacteriaceae родов Escherichia, Proteus, Klebsiella, Enterobacter и Morganella. Данные микроорганизмы колонизировали не только кишечник, но были выделены и со слизистых оболочек верхних дыхательных путей, обнаруживались в моче при бактериурии. Распространение энтеробактерий из кишечника в нетипичные биотопы может быть результатом нарушения барьерной функции слизистой кишечника, способствующей транслокации микроорганизмов. Установленная транслокация кишечного патобионта может стимулировать аутоиммунитет у генетически предрасположенных хозяев и играть роль в прогрессировании ревматоидного артрита [5, 7]. Наряду с этим чрезмерный рост патобионтов, транслокация грамотрицательных бактерий облегчают попадание эндотоксинов в кровь [6, 8]. Эндотоксин – ЛПС условно-патогенных энтеробактерий способствует поддержанию хронического иммунного воспаления за счет взаимодействия и активации рецепторов кишечной стенки (Toll-подобных, CD-14), при этом индуцируется каскад синтеза провоспалительных цитокинов (ИЛ-6, ФНО-α, ингибитора активатора плазминогена-1) [9, 10]. Сведения о колонизации организма условно-патогенными микроорганизмами, потенциальной возможности транслоцированных инфекционных агентов стимулировать аутоиммунитет у генетически предрасположенных людей, дестабилизировать кишечный барьер и поддерживать системное воспаление позволяют рассматривать кишечный микробиом как новую терапевтическую мишень в лечении ревматоидного артрита.
Выводы
1. При ревматоидном артрите нарушается количественный и качественный состав кишечного микробиома, в 91,7% случаев регистрируются микробиологические нарушения кишечной микрофлоры, преимущественно II–III степени, с выявлением ассоциации оппортунистических бактерий семейства Enterobacteriaceae.
2. Оппортунистические бактерии семейства Enterobacteriaceae обнаружены в кишечном микробиоме, на слизистых оболочках верхних дыхательных и мочевыводящих путей, что свидетельствует о процессах транслокации микроорганизмов в нетипичные биотопы.



