Острый перитонит (ОП) до сих пор остается одной из тяжелых ургентных болезней живота [1]. Он приводит к достаточно большой летальности. При этом сохраняется высокая его распространенность [2]. Несомненно, одной из причин сравнительно невысокой эффективности схем лечения острого перитонита является недостаточная изученность его патогенетических звеньев. Между тем этому вопросу в настоящее время уделяется особое внимание. Получение новых сведений о течении болезни позволило разработать новые схемы лечения. Однако весомого прорыва в разработке эффективных схем лечения заболевания не отмечается. Научные поиски продолжаются [3].
Безусловно, значимость состояния органов детоксикационной системы, которые во многом определяют выраженность синдрома эндогенной интоксикации – основной причины развития полиорганной недостаточности и танатогенеза, обусловливает определение возможного вектора углубленного исследования патогенеза болезни [4].
Цель исследования. Изучить состояния некоторых органов детоксикационной системы и эффекты влияния на их функциональный статус лазерной и метаболической терапии при остром перитоните.
Материал и методы исследования
Хронические опыты поставлены на беспородных собаках возраста 2,0–5,5 года, обоего пола, массой от 5,2 до 13,5 кг. Получено одобрение этического комитета от 17.07.2010 г. на проведение такого рода исследований.
Экспериментально воспроизводился каловый перитонит. Животным под наркозом в брюшную полость вводился 20%-ный раствор каловой взвеси (1,0 мл/кг). Через 1 сутки под наркозом выполнялась санация живота. Шов лапаротомной раны (способ А.П. Власова (1999)).
В первой группе (контрольной, n=15) животным в раннем послеоперационном периоде выполнялась антибактериальная и инфузионная терапия.
Во второй группе (первой опытной, n=15) схему лечения после санации брюшной полости дополняли лазерной терапией и введением реамберина.
В третьей группе (второй опытной, n=15) схема лечения соответствовала таковой второй группы с той лишь разницей, что включение в комплексную терапию указанных лечебных агентов производилось со 2-х суток.
В контрольные этапы (1-е, 3-и, 5-е сутки) периода наблюдения животным выполнялись забор крови, биопсия печени, почек и кишечника.
Экспериментальным животным после операции назначена антибактериальная, дезинтоксикационная терапия. Животным второй (с 1-х суток) и третьей (со 2-х суток) групп дополнительно назначены квантовое облучение (ежедневные сеансы внутрисосудистого лазерного облучения крови гелий-неоновым лазером в дозе 0,1 Дж/см2) и введение реамберина (15 мл/кг).
После завершения эксперимента продолжали лечение живых животных, а неспособных передвигаться и/или с серьезными повреждениями подвергали эвтаназии.
Для сравнения изучаемых параметров с референсным показателем обследованы 15 условно здоровых собак обоего пола, возраста 2–4 года.
Выраженность эндогенной интоксикации оценена по уровню гидрофильных (ЭКА (эффективной концентрации альбумина), ОКА (общей концентрации альбумина), РС (резерв связывания альбумина), ИТ (индекса токсичности)) и гидрофобных метаболитов (молекул средней массы (МСМ 254 и 280 нм)) (Ю.А. Грызунов, Г.Е. Добрецов, 1994).
По ряду показателей оценивалось функциональное состояние печени (ОБ (общего билирубина) и активности АЛТ (аланиновой) и АСТ (аспарагиновой) аминотрансфераз, МЕ/л), почек (мочевины и креатинина) и кишечника (по тесту МСМ/активности кишечной перистальтики (АКП)) (О. И. Пикуза, Л.З. Шакирова, 1994).
Применены методы вариационной статистики с использованием критерия Стьюдента. Вычисления производили на CPU «Intel Core 2 Duo» E4800 с помощью пакета программ Microsoft Office 2013.
Результаты исследования и их обсуждение
Многочисленными исследованиями выявлено, что основным фактором изменения системы гомеостаза при остром перитоните является эндоинтоксикация, при которой происходит аккумуляция промежуточных и конечных токсических метаболитов в биологических жидкостях, тканях и важных органах (печени, почках, головном мозге и др.) организма, что приводит к их функциональным нарушениям [5].
При изучении системы гомеостаза животных острым каловым перитонитом установлено, что ранний период заболевания характеризуется формированием эндотоксикоза.
Выявлено, что в предоперационные сутки показатели эндогенной интоксикации (МСМ 254, МСМ 280, ИТ) независимо от вида терапии были сопоставимо повышены: в первой группе – на 89,7%, 120,0% и 171,1% (р<0,05); во второй – на 102,5%, 110,1%, 165,7% (р<0,05); в третьей – на 79,4%, 130,1%, 173,6% (р<0,05) соответственно. В то же время наблюдалось снижение ЭКА, ОКА и РС в контрольной группе на 43,2%, 17,0%, 30,9% (р<0,05), в первой опытной – на 44,1%, 17,7% и 29,5% (р<0,05), во второй опытной – на 42,8%, 16,0%, 28,1% (р<0,05).
По ходу исследования животных первой группы, которые получили после операции стандартизированную терапию, отмечено сохранение признаков эндотоксикоза на всех этапах. Значение гидрофобных токсинов (эффективной, общей и резервной концентрации альбумина) было ниже нормы на 59,8–63,1%, 21,8–24,3%, 49,2–50,7% (р<0,05) соответственно. Кроме того, уровень гидрофильных (МСМ 254 и 280) метаболитов и индекса токсичности превышал исходный параметр на 125,6–115,3%, 146,7–152,3%, 342,1–315,7% (р<0,05).
Таблица 1
Гидрофобные показатели токсемии при остром моделированном перитоните
|
Показатель |
Г |
ЭКА (г/л) |
ОКА (г/л) |
ИТ |
РС |
|
|
РП |
30,14±0,53 |
41,15±0,78 |
0,38±0,03 |
0,71±0,03 |
||
|
ДО |
I (n=15) |
17,09±0,67 |
34,17±0,58 |
1,03±0,06 |
0,49±0,04 |
|
|
II (n=15) |
16,87±0,72 |
33,85±0,63 |
1,01±0,07 |
0,50±0,03 |
||
|
III (n=15) |
17,27±0,58 |
34,06±0,55 |
1,04±0,06 |
0,51±0,04 |
||
|
Сроки наблюдения, сут. |
1-е |
I (n=15) |
12,12±0,59 |
32,11±0,43 |
1,68±0,06 |
0,36±0,03 |
|
II (n=15) |
14,72±0,6112 |
32,09±0,51 |
1,18±0,071 |
0,45±0,0412 |
||
|
III (n=15) |
12,34±0,68 |
32,35±0,681 |
1,63±0,062 |
0,38±0,03 |
||
|
3-и |
I (n=15) |
11,14±0,62 |
32,14±0,47 |
1,86±0,08 |
0,34±0,02 |
|
|
II (n=15) |
16,31±0,5712 |
33,09±0,602 |
1,04±0,061 |
0,49±0,0312 |
||
|
III (n=15) |
12,55±0,721 |
33,09±0,71 |
1,79±0,08 |
0,37±0,04 |
||
|
5-е |
I (n=15) |
12,22±0,47 |
31,18±0,67 |
1,58±0,07 |
0,35±0,03 |
|
|
II (n=15) |
18,37±0,5412 |
35,64±0,551 |
0,95±0,0512 |
0,51±0,0412 |
||
|
III (n=15) |
13,74±0,611 |
32,08±0,49 |
1,46±0,07 |
0,39±0,031 |
||
Примечание здесь и далее: Г – группа; РП – референсный показатель; жирный шрифт – данные, имеющие статистически значимые отличия при сопоставлении с данными, принятыми за норму при p<0,05; 1 – статистически значимые при сравнении с данными контрольной группы при p<0,05; 2 – статистически значимые при сравнении с данными первой опытной группы при p<0,05
Таблица 2
Гидрофильные показатели токсемии при остром моделированном перитоните
|
Показатель |
Г |
МСМ, усл. ед. (254 нм) |
МСМ, усл. ед. (280 нм) |
|
|
РП |
0,39±0,02 |
0,30±0,02 |
||
|
ДО |
I (n=15) |
0,74±0,04 |
0,66±0,03 |
|
|
II (n=15) |
0,79±0,05 |
0,63±0,04 |
||
|
III (n=15) |
0,70±0,03 |
0,69±0,04 |
||
|
Сроки наблюдения, сут. |
1-е |
I (n=15) |
0,88±0,05 |
0,74±0,04 |
|
II (n=15) |
0,79±0,061 |
0,70±0,0512 |
||
|
III (n=15) |
0,83±0,04 |
0,78±0,05 |
||
|
3-и |
I (n=15) |
0,92±0,07 |
0,81±0,06 |
|
|
II (n=15) |
0,74±0,0612 |
0,65±0,0412 |
||
|
III (n=15) |
0,90±0,06 |
0,80±0,05 |
||
|
5-е |
I (n=15) |
0,84±0,06 |
0,76±0,05 |
|
|
II (n=15) |
0,70±0,0412 |
0,62±0,0412 |
||
|
III (n=15) |
0,81±0,04 |
0,73±0,05 |
||
При анализе данных показателей в группе собак на фоне включения лазерной терапии и реамберина с 1-го послеоперационного дня регистрировалось, что терапевтическая эффективность комплексного лечения существенно снижает признаки токсемии с ранних сроков после хирургического вмешательства.
Так, у собак второй группы наблюдалось повышение показателей (молекул средней массы 254 и 280 нм, а также индекса токсичности) эндогенной интоксикации на 1-е сутки на 100,5%, 133,2% и 210,5% соответственно (р<0,05), на 3-е сутки – на 89,4%, 116,7%, 331,6% соответственно (р<0,05), на 5-е сутки – на 79,4%, 106,5% и 150,1% соответственно (р<0,05) .
Концентрация альбумина (эффективного, общего, связанного) была ниже нормы на всех контрольных точках: 51,1–39,2%, 21,9–13,3% и 36,4–28,1% соответственно (р<0,05).
Позднее использование квантового облучения и метаболического препарата реамберин дополнительно к традиционной терапии сопровождалось снижением фармакологической активности схемы лечения.
Оказалось, что в раннем периоде после оперативной терапии у моделированных собак третьей группы показатели эндогенной интоксикации были значимо повышены на всех этапах наблюдения: МСМ 254 нм – на 112,8–107,5% (р<0,05), МСМ 280 нм – на 160,0–143,2% (р<0,05), ИТ – на 328,9–284,1% (р<0,05). В то же время отмечено существенное снижение альбуминовой фракции ЭКА – на 59,1–54,3% (р<0,05), ОКА – на 11,5–21,8% (р<0,05), РС – на 46,3–45,0% (р<0,05).
При изучении гепаторенального состояния в условиях моделированного острого перитонита выявлено, что начальные сроки ОП характеризуются депрессией функции печени и почек. По данным литературы, гепаторенальная система – уникальные органы, которые обладают длительной компенсацией функции. Однако в условиях острого перитонита отмечается сброс крови в общий круг кровообращения портоковальными анастомозами через печень, что приводит к возрастанию эндотоксикоза, ускорению формирования полиорганной недостаточности, в частности печени и почек [6].
Моделирование ОП у экспериментальных собак вело к существенному дисбалансу функций печени. Об этом свидетельствует изменение содержания общего билирубина и активности аланиновой и аспарагиновой аминотрансфераз (рис. 1).
Установлено, что уровень ОБ, активность АЛТ и АСТ при ОП со стандартизированным видом лечения превышали исходный показатель на 1-е сутки на 396,2%, 61,5% и 82,7% (р<0,05), на 3-и – на 587,1%, 84,5% и 99,3% (р<0,05), на 5-е сутки – на 712,9%, 97,4% и 105,8% (р<0,05).
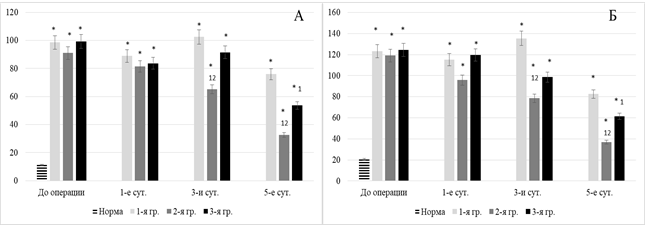
Рис. 1. Динамика показателей функционального состояния печени (ОБ – а, АЛТ – б)
Примечание здесь и далее: * – статистически значимые при сравнении с данными нормы при p<0,05; 1 – статистически значимые при сравнении с данными контрольной группы при p<0,05; 2 – статистически значимые при сравнении с данными второй опытной группы при p<0,05
Результаты комбинированной терапии (базисная терапия + лазерное излучение + реамберин) показали существенное улучшение функционального состояния печени. При этом печеночные параметры (ОБ, АЛТ и АСТ) были повышены на первом этапе на 345,7%, 52,7% и 76,1% соответственно. На 2–3-м и конечном этапах исследования наблюдалось значительное снижение данных показателей, но с сохранением увлеченного уровня относительно нормы на 251,3% и 31,2%, 42,7% и 105,9%, 19,8% и 26,4% соответственно (р<0,05) (рис. 1).
У животной второй опытной группы показатели печеночной депрессии были увеличены на всех сутках наблюдения: ОБ – на 368,4–231,7% (р<0,05), АЛТ – на 55,9–34,2% (р<0,05), АСТ – на 80,2–42,1% (р<0,05).
Очевидным признаком ренальной дисфункции при моделированном остром перитоните являлось повышение уровня мочевины и креатинина в плазме крови. На фоне стандартной (контрольной группы) и поздней комбинированной (второй опытной группы) количество данных метаболитов было повышено на всех этапах наблюдения: мочевина на 21,5–43,5% и 19,6–32,8% (р<0,05) соответственно, креатинин – на 86,5–95,8% и 79,3–56,8% (р<0,05) соответственно (рис. 2).
Раннее включение квантово-реамберинотерапии сопровождалось быстрой мобилизацией ренальной активности. В первой опытной группе содержание мочевины и креатинина в плазме крови превосходило референсный параметр на 1-е и 3-и послеоперационные сутки на 19,7% и 15,3%, 74,4% и 39,5% соответственно (р<0,05) (рис. 2).
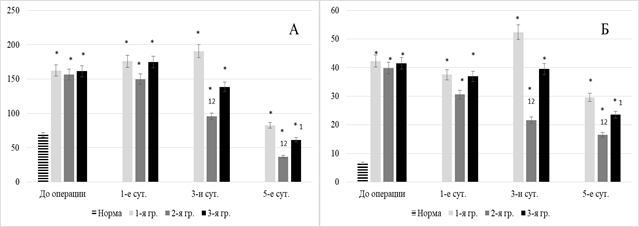
Рис. 2. Динамика некоторых функциональных показателей почек (мочевина – а, креатинин – б)
По ходу исследования моторно-эвакуаторной функции кишечника при остром перитоните отмечено, что в раннем периоде формирования данной патологии наблюдается развитие энтерального дистресс-синдрома [7]. Значение показателя АКП в первой группе было повышено на 1-е сутки на 198,6% (р<0,05), на 2-е – на 242,7% (р<0,05), на 3-и – на 169,2% (р<0,05) (рис. 3).
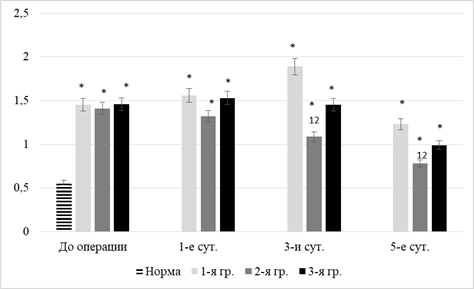
Рис. 3. Динамика показателей функционального статуса кишечника
Быстрая коррекция энтерального дистресс-синдрома при остром моделированном перитоните отмечена только во второй группе после раннего использования лазерно-реамберинотерапии. Величина МСМ/активности кишечной перистальтики превышала норму на 1-е сутки послеоперационного периода на 164,3%, на 3-и сутки – на 85,1%. К конечному этапу исследования значение АКП вплотную приближалось к референсному уровню.
Несвоевременное использование комбинированной терапии (со 2-х суток) сопровождалось стойким нарушением функциональных процессов в кишечнике. Об этом свидетельствовало увеличение параметра МСМ/активности кишечной перистальтики на 181,6–153,7% (р<0,05).
Выводы
В раннем периоде развития острого калово-моделированного перитонита наблюдаются формирование синдрома эндогенной интоксикации (повышение МСМ 254 на 89,7% и ИТ – на 171,1% и снижение ЭКА на 4,2% и РС – на 30,9% при р<0,05) и нарушение функционального статуса печени (возрастание ОБ на 369,2%, АЛТ – на 61,5% и АСТ – на 82,7% при р<0,05), почек (повышение уровня мочевины и креатинина на 21,5% и 86,5% при р<0,05) и кишечника (увлечение значения АКП на 198,5% при р<0,05).
2. Включение в комплексное лечение острого перитонита лазерной терапии и препарата метаболического типа действия повышает эффективность лечения, что проявляется существенным уменьшением функциональных расстройств исследованных органов на фоне уменьшения эндогенной интоксикации.
3. Результативность такого рода терапии по коррекции функционального состояния органов детоксикации была сопряжена с ее отсроченным применением. Выраженность гомеостатических изменений была значительно меньше при раннем включении комплексной терапии относительно группы с поздним (ЭКА была выше на 19,6–34,1%, ИТ и МСМ были ниже на 2,1–32,4% и 17,5–14,1%, ОБ – ниже на 15,6–23,9%, мочевина – меньше на 22,1–26,3%, АКП – ниже на 20,8–32,7% при р<0,05).



