Атеросклеротическое поражение сонных артерий является распространенной патологией, сопровождающейся частой инвалидизацией человека и высоким процентом летальных исходов вследствие развития грозных осложнений. Наиболее серьезным осложнением атеросклероза сонных артерий является инсульт, который в последнее десятилетие в России вышел на второе место среди других причин смерти пациентов, уступая только ишемической болезни сердца [1, 2]. Доказано, что 80% от общего числа инсультов являются ишемическими (атеротромботическими), и примерно 20% из них вызваны атеросклерозом крупных артерий с преимущественной локализацией бляшки на внутренней сонной артерии. В настоящее время нет доказательств использования конкретного плазменного биомаркера в качестве предиктора уязвимости каротидных бляшек или предиктора рецидива инсульта у пациентов с атеросклерозом сонных артерий [3, 4]. Востребованными патогенетическими маркерами высокого сердечно-сосудистого риска являются лабораторные показатели дислипидемии и системного воспаления (С-реактивный белок, содержание интерлейкина-6 в сыворотке, миелоид-зависимый протеин) [5–7]. Последний показал эффективность в прогнозировании клинических осложнений у лиц как с ишемической болезнью сердца, так и с доклиническими формами атеросклероза.
Прогнозирование осложнений атеросклероза, вызывающих цереброваскулярные заболевания, до настоящего времени остается недостаточно разработанной проблемой. Большинство научных работ посвящено ранней диагностике и оценке степени стеноза и окклюзий сонных артерий [8]. Дуплексонография используется для скрининга пациентов с группой риска и является общедоступным методом исследования сонных артерий, позволяющим на ранних стадиях установить развитие заболевания [9–11]. Так, главным симптомом раннего поражения сонных артерий служит утолщение комплекса «интима – медиа» [12, 13], а «стабильность» бляшки определяет возможность ее осложнения тромбозом или окклюзией [14, 15].
С нашей точки зрения, повышение эффективности прогнозирования осложнений атеросклероза артериальных сосудов возможно при условии расширения знаний о патогенезе атеросклероза. Причиной развития атеросклероз-ассоциированных цереброваскулярных заболеваний является формирование нестабильных (осложненных) бляшек, когда в их толще преобладает распад липидно-белковых комплексов, образуется атероматозный детрит, имеет место деструкция покрышки с кровоизлияниями, образуются пристеночные тромбы, перекрывается просвет артерии с последующим развитием инфаркта, эмболии. Кальцификация атеросклеротической бляшки может приводить к ее нестабильности на границе с мягкими тканями [16]. В связи с этим разработка диагностических показателей, позволяющих дифференцировать стабильные и нестабильные варианты атеросклеротических бляшек, является актуальной проблемой сосудистой хирургии и профилактики возникновения атеросклероз-ассоциированных цереброваскулярных заболеваний.
Цель работы – сопоставить морфологические особенности различных по данным ультразвукового исследования типов атеросклеротических бляшек сонных артерий с уровнем паратиреоидного гормона и ионизированного кальция в крови.
Материал и методы исследования. Нами проанализированы результаты лечения 138 пациентов (мужчин, средний возраст 51±8 лет) с метаболическим атеросклерозом, сопровождающимся поражением сонных артерий, которые были прооперированы в отделении сосудистой хирургии Института неотложной и восстановительной хирургии им. В.К. Гусака (ДНР) в период 2014–2020 гг. Критерии исключения: остеопороз, сахарный диабет, ожирение, узелковый периартериит, гипервитаминоз D, артериальная гипертония, хроническая почечная недостаточность. Всем больным, помимо общепринятых общеклинических и физикальных методов обследования, выполняли ультразвуковое исследование атеросклеротических бляшек и степени стеноза каротид, а также морфологическое исследование интраоперационного материала.
При выполнении триплексного сканирования сонных артерий изучали:
– спектральные и линейные характеристики кровотока в зоне стеноза и в постстенотических отделах;
– свойства атеросклеротической бляшки, ее эмболоопасность (форму бляшки, ее структуру, характер поверхности);
– протяженность поражения и выявление тандемных стенозов в сонной артерии;
– наличие у больного извитости, ее кровеносную динамическую значимость.
Для характеристики состояния атеросклеротических бляшек использовалась классификация, разработанная C.M. Stefen и соавторами (1989) и дополненная G. Geroulakos и соавторами (1993) [17, 18]:
– I тип (гомогенные) – полностью гипоэхогенная бляшка с тонкой эхогенной покрышкой;
– II тип (гетерогенная) – преимущественно гипоэхогенная бляшка с наличием гиперэхогенных зон;
– III тип (гетерогенная) – преимущественно гиперэхогенная бляшка с наличием гипоэхогенных зон;
– IV тип (гомогенная) – полностью гиперэхогенная бляшка;
– V тип – бляшка, не поддающаяся идентификации из-за выраженного кальциноза, вызывающего акустическую тень.
По распространенности бляшки подразделялись на локальные (протяженностью 1–1,5 см) и пролонгированные (более 1,5 см); по локализации – на локальные (занимают одну стенку сосуда), эксцентрические и концентрические; по форме поверхности – на гладкие и с неровной поверхностью.
До оперативного лечения у пациентов определяли уровень паратиреоидного гормона с помощью твердофазного хемилюминесцентного иммуноферментного анализа («сэндвич»-метод) и ионизированного кальция (ион-селективным электродом).
Удаленные во время операции атеросклеротические бляшки подвергались патоморфологическому исследованию с последующим сопоставлением гистологического описания и ультразвуковой картины. Подготовка материала для световой микроскопии включала фиксацию полученного материала в 10%-ном растворе формалина на 0,1%-ном фосфатном буфере (рН=7,4), обезвоживание в спиртах возрастающей концентрации, просветление в ксилоле и заливку в парафин. Из парафиновых блоков готовили срезы толщиной 5±1 мкм, которые окрашивали гематоксилином и эозином. Для выявления коллагеновых волокон использовали окрашивание пикрофуксином по Ван Гизону. Гистологические препараты изучали в светооптическом микроскопе Olympus ВХ-40, микрофотографии готовили с помощью цифровой фотокамеры Olympus U-TV1X с программным обеспечением Olympus DP-Soft.
Морфометрические показатели тканей стенки артерий (толщина фиброзной покрышки, удельные площади лейкоцитов, кровеносных сосудов микроциркуляторного русла, межклеточного матрикса и пенистых клеток) измеряли с помощью точечных тестовых систем [19] на микрофотографиях 10 полей зрения оптического микроскопа при конечном увеличении ×400, отобранных случайным методом на пяти срезах каждого клинического случая. Полученные количественные значения показателей обрабатывали статистически на персональном компьютере Pentium-III в среде Windows-XP с использованием стандартного пакета прикладных лицензионных программ (Exсel, MedStаt, Microsoft Office 2010 и STATISTICA 10.0). При обработке результатов оценивали характер распределения признака и рассчитывали следующие статистические показатели: среднюю арифметическую, стандартную ошибку, среднеквадратическое отклонение. Различия оценивали как статистически значимые при p<0,05.
Результаты исследования и их обсуждение. Согласно данным литературы гипоэхогенные атеросклеротические бляшки представляют собой классические «молодые» бляшки, соответствующие I типу [20]. Бляшки II и III типов – классические «зрелые» бляшки, имеют среднюю эхогенность и в большинстве случаев однородны, не имеют каких-либо вторичных изменений. Бляшки IV и V типов являются разновидностью «зрелых», но отличаются повышенной плотностью (гиперэхогенностью), обусловленной наличием участков минерализации в тканях стенки артерии.
При проведении параллелей между гистологическим заключением и ультразвуковой картиной нами было установлено, что суммарный процент пациентов с гетерогенными бляшками (II и III тип) составил 47%, при этом чаще встречались полностью гиперэхогенные бляшки (35%).
Морфометрическое исследование структурных элементов бляшек в гистологических препаратах у обследованных пациентов продемонстрировало существование значимых различий (табл. 1). Стабильными считают бляшки с хорошо выраженной плотной фиброзной покрышкой, толщиной более 65 мкм, без ее истончения на всем протяжении бляшки [21]. Истончение фиброзной капсулы и наличие лейкоцитарной инфильтрации бляшки служили основанием рассматривать ее как нестабильную.
Таблица 1
Морфометрические показатели атеросклеротических бляшек сонных артерий, M±m
|
Типы бляшек |
Толщина покрышки, мкм |
Удельная S лейкоцитов, % |
Удельная S межклеточного матрикса, % |
Удельная S кровеносных сосудов, % |
Удельная площадь пенистых клеток, % |
|
Стабильные |
92,4±8,8 |
0,9±0,3 |
51,3±3,1 |
1,9±0,5 |
45,8±3,7 |
|
Нестабильные: – липидный тип |
73,1±3,6 |
1,2±0,4 |
10,8±3,5 |
3,5±0,7 |
27,5±4,1 |
|
– дистрофически-некротический тип |
58,2±1,9 |
1,1±0,5 |
24,2±1,6 |
2,4±0,3 |
21,3±1,1 |
|
– воспалительно-эрозивный тип |
44,7±2,1 |
30,3±2,7 |
30,4±4,2 |
26,7±2,0 |
2,6±0,3 |
У пациентов стабильные бляшки характеризовались наличием упорядоченных пучков коллагеновых волокон, формирующих покрышку, скоплений пенистых клеток в виде липидных пятен или тонких полос (рис. 1). Средняя толщина фиброзной покрышки бляшки составила 92,4±8,8 мкм. При этом наименьшими были удельная площадь кровеносных сосудов и лейкоцитов и высокий удельный вес межклеточного матрикса и пенистых клеток.
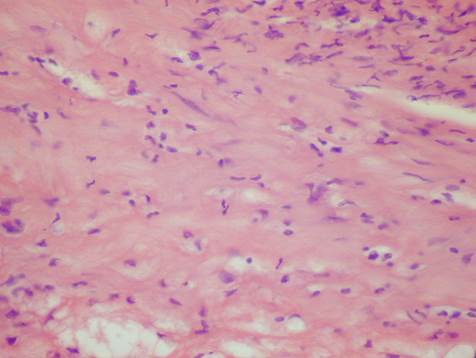
Рис. 1. Скопления пенистых клеток на границе внутренней и средней оболочек сонной артерии. Окраска гематоксилином и эозином. ×400
Иную морфологическую картину наблюдали в структуре нестабильных бляшек стенки сонных артерий у пациентов с атеросклерозом сонных артерий. Для липидного типа нестабильных бляшек было характерно разрастание соединительной ткани вокруг пенистых клеток и участков атероматозного пропитывания интимы сосуда (липидное ядро) (рис. 2).
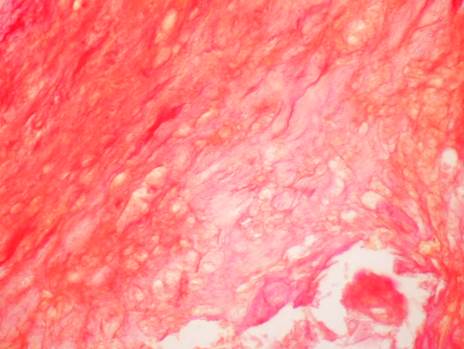
Рис. 2. Скопление пенистых клеток вокруг атероматозного ядра, толстая фиброзная покрышка бляшки в стенке сонной артерии. Окраска по Ван Гизону, ×400
Формирование атероматозного ядра привело к смещению соотношения удS пенистых клеток/удS межклеточного матрикса. Так, в стабильной бляшке данное соотношение составило 0,89 за счет незначительного преобладания межклеточного матрикса, а в нестабильной бляшке липидного типа возросло до 2,54 в результате уменьшения удельной площади межклеточного матрикса, что явилось следствием формирования липидного ядра. Удельный вес лейкоцитарных клеток в строме недостоверно превысил таковой в стабильной бляшке и составил 1,2±0,4% (против 0,9±0,3%). Среди лейкоцитов выявлялись преимущественно моноциты/макрофаги, лимфоциты.
При исследовании нестабильных бляшек дистрофически-некротического типа у обследованных пациентов выявили атероматозные (липидные) массы, расположенные в центральной части бляшки. Коллагеновые волокна в толще покрышки бляшки располагались неравномерно, истончались и фрагментировались. В фиброзной покрышке располагались отдельные пенистые клетки, имела место внеклеточная липидная инфильтрация, что и послужило причиной нарушения компактного расположения коллагеновых волокон, их истончения. Последнее является фактором риска разрыва данного типа бляшек. Однако толщина покрышки бляшки была самой максимальной по сравнению с другими типами бляшек, что можно трактовать как компенсаторную реакцию, направленную на увеличение прочности сосудистой стенки в связи с наличием очагов дистрофических и некротических изменений межклеточного матрикса.
Удельная площадь неизмененного межклеточного матрикса составила 24,2±1,6%, а пенистых клеток – сопоставима с таковой в бляшках липидного типа (21,3±1,1%). Удельный вес лейкоцитов был сходен с таковым в нестабильных липидных бляшках, а удельная площадь кровеносных сосудов составила 2,4±0,3%, что свидетельствует о сопоставимой минимальной степени воспалительной тканевой реакции.
В нестабильных бляшках дистрофически-некротического типа часто определялись участки пятнистой микрокальцификации (рис. 3) и крупноочаговой кальцификации (рис. 4), которые могут повреждать фиброзную покрышку независимо от ее толщины. Обращал на себя внимание факт появления очагов микрокальцификации в отсутствие кровеносных сосудов как в структуре бляшки, так и в составе покрышки и окружающих тканях. Судя по архитектонике ядер минерализации, атеросклеротическая кальцификация в данном случае обусловлена. Хотя в литературе доминирует мнение, что кальцифицирующая васкулопатия является результатом индукции остеогенной дифференцировки в субпопуляциях сосудистых клеток воспалительными факторами – модифицированными липопротеинами и цитокинами, обнаруженными в атероматозных компонентах бляшек, в клинических исследованиях имеются сведения о связи дислипидемии с наличием, тяжестью и прогрессированием сосудистой кальцификации [22]. Известно, что гиперлипидемия способствует кальцификации у мышей, а 52 ингибиторы HMG-CoA редуктазы in vitro снижают кальцификацию сосудистых клеток посредством передачи сигналов Gas-6/Axl [23].
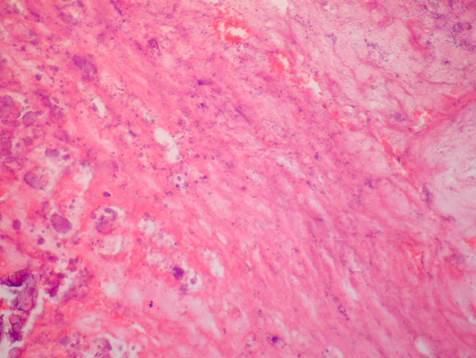
Рис. 3. Пятнистая кальцификация нестабильной бляшки дистрофически-некротического типа. Окраска гематоксилином и эозином, ×400
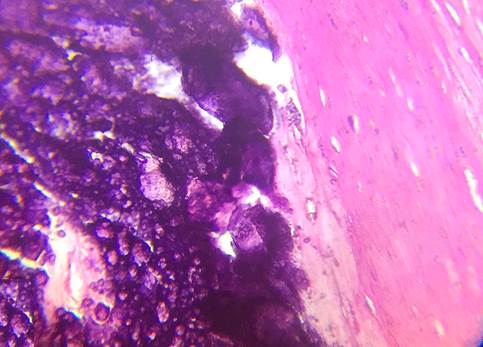
Рис. 4. Крупный очаг кальцификации нестабильной бляшки дистрофически-некротического типа. Окраска гематоксилином и эозином, ×400
Воспалительно-эрозивный тип нестабильных бляшек характеризовался малой толщиной фиброзной покрышки (44,7±2,1мкм), высоким удельным весом лейкоцитов (30,3±2,7%), межклеточного матрикса (30,4±4,2%) и кровеносных сосудов (26,7±2,0%) против незначительного количества пенистых клеток (2,6±0,3%). Следует отметить, что у части пациентов (34%) под фиброзной покрышкой бляшки имели место проявления неоваскуляризации и клеточной инфильтрации, сходные с формированием грануляционной ткани. Последняя, как известно, формируется на этапе завершения воспалительно-репаративного процесса. При этом в составе бляшки выявлялись одиночные пенистые клетки, а в окружающих бляшку тканях – различной площади внутри- и околобляшечные кровоизлияния. У остальных пациентов (66%) воспалительно-эрозивный характер изменений интимы сосудов проявлялся выраженной лейкоцитарной инфильтрацией как покрышки, так и самой бляшки, расширенными просветами кровеносных сосудов, а также формированием очагов кальцификации на границе со средней оболочкой артерии. В средней оболочке в проекции интимальной бляшки выявлены очаги апоптозно измененных гладких миоцитов.
Выявленные факты согласуются с известным в литературе мнением, что микрокальцификаты и пятнистые кальцификаты могут представлять собой активную стадию кальцификации сосудов, коррелирующую с воспалением [5], а степень кальцификации обратно пропорциональна инфильтрации макрофагов [22]. Данная гипотеза правомерна, поскольку при этом возрастает тканевое содержание неколлагеновых белков (эластина, остеопонтина базальных мембран, апоптотических телец гладкомышечных клеток), являющихся основой для создания первичных кристаллов апатитов. В нескольких работах показано, что метаболиты эластина могут служить ядрами отложения кальция [24, 25]. Матриксная металлопротеиназа 9, эластаза, экспрессируемая стенкой поврежденного сосуда, по-видимому, способствуют отложению кальция, циркулирующего в артериальной крови, в моделях медиальной кальцификации варфарином/витамином К [26]. В работе Y. Dautova и соавт. [27] показано, что кальцификации способствует также апоптоз, поскольку апоптотические тельца, полученные из сосудистых гладкомышечных клеток, могут служить центрами «зародышеобразования» для формирования кристаллов гидроксиапатита. Однако, несмотря на обилие кровеносных сосудов и признаков кальцификации, в стенке артерий наших пациентов на границе с участками минерализации не обнаружены ни коллагеновый матрикс (остеоид), ни хондро/остеобластные клетки, что опровергает известную гипотезу о фенотипической трансформации сосудистых гладких миоцитов в хондро/остеогенные клетки, обладающие способностью модулировать процесс минерализации [28]. Эти разногласия можно объяснить тем, что механизмы кальцификации сосудов в основном изучались в исследованиях in vitro [22], а также выявленной экспрессией белков костного матрикса и регуляторных факторов (костный морфогенетический белок-2, остеопонтин, костный сиалопротеин, остеонектин, коллаген I и остеокальцин), которые, однако, присущи большинству клеток мезенхимного происхождения.
Учитывая современные данные о патогенезе формирования атеросклеротических бляшек, мы исследовали уровень паратиреоидного гормона (ПТГ) и ионизированного кальция (iCa2+) у пациентов с различными типами (I–V) бляшек (табл. 2). Как известно, основное действие ПТГ направлено на повышение уровня ионизированного кальция в крови.
Таблица 2
Уровень паратиреоидного гормона и ионизированного кальция в крови пациентов с различными типами атеросклеротических бляшек, M±m
|
Типы бляшек |
Паратиреоидный гормон, |
Ионизированный кальций, |
|
|
пг/мл |
ммоль/л |
|
I |
147±31 |
1,38±0,4 |
|
II и III |
210±28 |
1,42±0,4 |
|
IV и V |
279±45 |
1,50±0,7 |
Исходя из референсных значений уровня ПТГ в крови здоровых людей (15–65 пг/мл) очевидным видится значимый прирост содержания гормона в крови пациентов. Характерно, что концентрация ПТГ возрастает по мере увеличения типа бляшек – с I по V. Аналогичную тенденцию проявлял уровень iCa2+ (референсные значения у взрослых людей репродуктивного возраста 1,15–1,32 ммоль/л).
Однако более важным видится сравнение данных показателей у пациентов с различными морфологическими типами атеросклеротических бляшек. Данный интерес обоснован новейшими данными об участии кальция в сосудистом позитивном ремоделировании, которое впервые было описано как компенсаторное увеличение минерализации матрикса, способное задерживать прогрессирование сужения просвета кровеносного сосуда на ранней стадии атеросклероза [29]. Чаще данный процесс встречается в бляшках воспалительно-эрозивного типа, которые характеризуются кровоизлиянием, крупными липидными ядрами, инфильтратами макрофагов и отложениями кальция [30]. Данные о содержании ПТГ и iCa2+ у пациентов с различными морфологическими типами атеросклеротических бляшек представлены в таблице 3.
Таблица 3
Уровень паратиреоидного гормона и ионизированного кальция в крови пациентов с различными морфологическими типами атеросклеротических бляшек, M±m
|
Типы бляшек |
Паратиреоидный гормон, |
Ионизированный кальций, |
|
|
пг/мл |
ммоль/л |
|
Стабильные |
162±11 |
1,41±0,5 |
|
Нестабильные: – липидный тип |
226±17 |
1,33±0,9 |
|
– дистрофически-некротический тип |
333±25 |
1,62±0,7 |
|
– воспалительно-эрозивный тип |
106±12 |
1,03±0,2 |
Так, пациенты со стабильными и нестабильными (липидными, дистрофически-некротическими) бляшками отличались умеренно выраженным гиперпаратиреозом и гиперкальциемией. По степени прироста показателей пациенты распределились следующим образом: дистрофически-некротический тип > липидный тип > стабильный тип. Обращал на себя внимание дисбаланс гиперпродукции ПТГ и сниженного уровня iCa2+ у пациентов с воспалительно-эрозивным типом бляшек, что, по мнению S. Tedesco и соавт. [31], способствует переключению фенотипа макрофагов на противовоспалительный M2-тип. Уменьшение воспалительного компонента подтверждает выявленная в стенке артерий низкая удельная площадь лейкоцитов и кровеносных сосудов. При этом следует ожидать восстановления тканевого рН и роста кристаллов на неколлагеновых белках межклеточного матрикса, которые образовались на предшествующих стадиях воспалительного процесса.
В остальных случаях поддержание гиперпаратиреоза и гиперкальциемии создавало предпосылки к сохранению макрофагов провоспалительного фенотипа М1 и повышению их фагоцитарной активности [32], изменению содержания протеолитических ферментов, прочностных свойств стенки сосуда, появлению очагов кровоизлияния и тромбоза. Как результат – формирование нестабильной (осложненной) формы атеросклеторических бляшек.
В подтверждение нашей концепции об отсутствии признаков остеобластической трансформации гладкомышечных клеток стенки артерий у обследованных пациентов Т.В. Талаева и В.В. Братусь [16] установили физиологическое угнетающее действие ПТГ на популяцию остеобластов/остеоцитов и формирование костной ткани, а также меньший прирост уровня ионизированного кальция при высоком уровне гормона. Расшифровка патогенетических механизмов данного феномена требует проведения дополнительных исследований функциональной системы кальциевой регуляции.
Выводы
1. Сформированные в стенке артерий стабильные и липидного типа нестабильные бляшки характеризуются наибольшей толщиной фиброзной покрышки, накоплением пенистых клеток при минимальных морфологических признаках воспалительного процесса в окружающих тканях и сохранением баланса ПТГ-Са2+, в связи с чем могут трактоваться как неосложненные формы атеросклеротического поражения сосудов.
2. Липидное ядро в дистрофически-некротическом типе бляшек на фоне повышенного уровня ПТГ и Са2+ служит матриксом для мелко- и крупноочаговой минерализации, реализуемой, вероятно, путем образования кальциевых солей жирных кислот при отсутствии признаков хондро/остеогенной трансдифференцировки гладкомышечных клеток стенки артерии.
3. Воспалительно-эрозивный тип нестабильных бляшек отличается полиморфизмом структурных изменений во внутренней и средней оболочке артерий; в одних случаях очаги грануляционной ткани, очаговые кровоизлияния на фоне лейкоцитарной инфильтрации интимы формировались на фоне наименьшего уровня ПТГ и Са2+ по сравнению с другими типами бляшек; в иных случаях проявления воспалительного процесса сочетались с признаками кальцификации и апоптоза гладкомышечных клеток средней оболочки сосуда.
4. Комплексное исследование ультразвуковой и морфологической картины атеросклеротических бляшек, а также изменения баланса ПТГ и Са2+ позволяют дифференцировать стабильные и нестабильные варианты атеросклероз-ассоциированного сосудистого поражения для прогнозирования осложнений заболевания.



