Комбинированная спинально-эпидуральная анестезия (КСЭА) при операциях высокого риска массивной акушерской кровопотери (МАК) имеет достаточно высокий удельный вес при оперативных вмешательствах (ОВ) [1, 2]. Данная концепция обезболивания позволяет объединить достоинства спинальной анестезии (СА) и эпидуральной анестезии (ЭА) в виде относительной быстроты ее выполнения (особенно при использовании современных наборов для КСЭА, позволяющих осуществлять ее в варианте «одно место пункции – два пространства»), сопоставимой при достаточном уровне навыков врача-анестезиолога-реаниматолога с индукцией в наркоз и интубацией трахеи при проведении общего обезболивания. Немаловажны и быстрота развития эффекта местного анестетика (МА), введенного в субарахноидальное пространство, выраженность миоплегии и сенсорной блокады (в сравнении с ЭА), возможность пролонгирования эффекта МА за счет введения его в эпидуральное пространство при расширении объема ОВ и, соответственно, увеличения времени его выполнения. Кроме того, при выполнении КСЭА решается проблема послеоперационного обезболивания, особенно при выполнении ОВ расширенного объема, а также создания контролируемой вазодилатации, что особенно актуально в послеоперационном периоде при наличии у пациенток гипертензивных расстройств. Как и при других методах нейроаксиального обезболивания, особое внимание уделяется недопущению и своевременному купированию возможных осложнений, а также возможному переходу на резервную концепцию анестезии. Независимо от выбранного метода анестезии рабочее место врача-анестезиолога-реаниматолога должно быть оборудовано для ситуаций, требующих изменения плана анестезии, оказания внеплановой неотложной помощи и коррекции возможных осложнений [3–5].
Цель исследования. Оценить эффективность комбинированной спинально-эпидуральной анестезии в раннем периоперационном периоде у пациентки с высоким риском массивной акушерской кровопотери.
Материалы и методы исследования. В качестве примера приводится клинический случай хирургического обезболивания оперативного родоразрешения (ОР) в концепции КСЭА с оказанием комплексной трансфузиологической поддержки (ТП) у пациентки с МАК, причиной которой послужило центральное предлежание плаценты (ЦПП) с ее врастанием, оперированной в плановом порядке при сроке беременности 37 недель 2 дня, находившейся на лечении в государственном учреждении здравоохранения «Клинический перинатальный центр Саратовской области» с 12.02.2018 г. по 21.02.2018 г.
Пациентка Р., 36 лет, имевшая массу тела 107 кг при росте 167 см, поступила в акушерское отделение патологии беременности в плановом порядке из района Саратовской области. По результатам осмотра и обследования в течение первых суток установлен диагноз: Основное заболевание: «Беременность 37 недель. Поперечное положение плода. ЦПП. Рубец на матке». Осложнения основного заболевания: «Хроническая гипоксия плода в стадии компенсации. Вызванные беременностью отеки. Анемия беременных легкой степени». Сопутствующие заболевания: «Отягощенный акушерско-гинекологический анамнез. Варикозная болезнь вен нижних конечностей. Вегетососудистая дистония по гипертоническому типу».
В анамнезе – двое самопроизвольных неосложненных родов (2002 и 2008 гг.), замершая беременность при сроке 5 недель (2002 г.), два артифициальных аборта (2004 и 2006 гг.), кесарево сечение (КС) при доношенной беременности по поводу ЦПП в 2012 г. Гинекологический анамнез отягощен эрозией шейки матки, по поводу которой выполнена электрокоагуляция в 2013 г. С настоящей беременностью встала на учет в женскую консультацию по месту жительства при сроке беременности 13–14 недель, наблюдение регулярное. При постановке на учет был выявлен трихомониаз, пролечен амбулаторно. Центральное предлежание плаценты диагностировано при сроке гестации 30 недель. При поступлении пациентки составлен оперативный план ведения родов, отмечены высокий риск МАК, возможное расширение объема операции. При ультразвуковом исследовании, выполненном при поступлении в стационар, подтверждено ЦПП без признаков врастания плаценты и нарушения гемодинамики у плода. Назначено лечение в виде перорального приема капсул токоферола ацетата 400 мг в сутки, таблеток «Феррум-лек» 100 мг в сутки и таблеток метронидазола по 250 мг каждые 12 ч. С 12.02.2018 г. по 15.02.2018 г. пациентка наблюдалась в условиях акушерского отделения патологии беременности. Исходные показатели системы гемостаза – в пределах нормы (фибриноген 2,42 г/л; активированное частичное тромбопластиновое время (АЧТВ) = 28 с; международное нормализованное отношение (МНО) = 0,98; равно как и данные биохимического анализа крови. В общем анализе крови (ОАК) – анемия легкой степени (эритроциты = 4,06×1012/л; гемоглобин = 102 г/л; гематокрит = 42,0%; количество тромбоцитов 204×109/л). В плановом порядке за сутки до операции осмотрена врачом-анестезиологом-реаниматологом, концепцией хирургического обезболивания избрана КСЭА, предусмотрен резервный вариант обезболивания в виде тотальной внутривенной анестезии с миоплегией и искусственной вентиляцией легких, проведением интраоперационной аппаратной аутореинфузии (ИААР) (учитывая наличие ЦПП и высокого риска расширения объема ОВ), а также заместительной терапии.
Результаты исследования и их обсуждение. Пациентка Р. 15.02.2018 г. в 10 ч 25 мин. была переведена в операционную для планового родоразрешения. На момент перевода отмечалась артериальная гипертензия – артериальное давление (АД) = 140 и 100 мм рт. ст., пульс = числу сердечных сокращений (ЧСС) = 77 в минуту, аксиллярная температура = 36,7оС. В течение 5 мин катетеризированы две периферические вены катетерами 16G, начата инфузия растворов кристаллоидов (р-р хлорида натрия 0,9%-ный) и коллоидов (р-р гидроксиэтилкрахмала (ГЭК) 6%-ный). Выполнена премедикация (атропин сульфат 1 мг в/в, феназепам 1 мг в/в), а также начата антибактериальная терапия (АБТ) введением цефтриаксона 2,0 в/в. Комбинированная спинально-эпидуральная анестезия выполнена в варианте «два места пункции – два пространства», эпидуральный катетер установлен на уровне LI–LII, после чего введена тест-доза ропивакаина 0,75%-ного – 3 мл, пункция субарахноидального пространства осуществлена на уровне LII–LIII, с последующим введением 4 мл 0,5%-ного раствора бупивакаина в 11 ч 00 мин. Начало операции – через 24 мин от момента поступления пациентки в операционную. Интраоперационная аппаратная аутореинфузия аппаратом «Haemonetics Cell-Saver 5+» (США) осуществлялась от момента кожного разреза. Учитывая высокий риск МАК, перед началом операции введено 1000 мг транексамовой кислоты (10 мг/кг) с продолжением инфузии транексамовой кислоты в дозе 5 мг/кг/час [6]. В течение всего интра- и послеоперационного периода осуществлялись неинвазивный мониторинг гемодинамики (АД и ЧСС), пульсоксиметрия, термометрия, контроль темпа диуреза.
В условиях КСЭА выполнены нижнесрединная лапаротомия, корпоральное КС. После извлечения ребенка массой 2930 г, состояние которого оценено врачом-неонатологом на 7–7–8 баллов по шкале В. Апгар, произведено отделение плаценты, после чего обнаружен дефект последней размером 4×5 см и диагностирован участок врастания плаценты с диффузным кровотечением в указанной зоне. Принято решение о расширении объема ОВ до экстирпации матки без придатков. С учетом темпов и объема МАК было произведено размораживание свежезамороженной плазмы (СЗП) (2 ед. по 600 мл), взята кровь на ОАК, в котором гемоглобин = 86 г/л; эритроциты = 2,4×1012/л; гематокрит = 23%, при этом уровень тромбоцитов = 201×109/л, и выполнена тромбоэластография (ТЭГ). Результат ТЭГ, взятой на пике кровопотери, отразил декомпенсацию системы гемостаза с наличием выраженного фибринолиза (рис. 1).
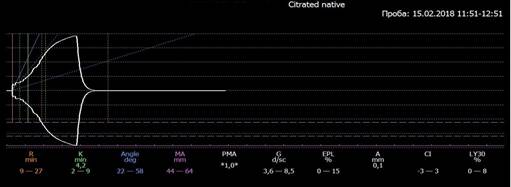
Рис. 1. Декомпенсация системы гемостаза с активацией фибринолиза при МАК
*Примечание: R – продолжительность реакции до образования нитей фибрина, К – скорость образования кровяного сгустка, Angle – скорость роста сгустка и увеличение его прочности, характеризует активность фибриногена, МА – показатель максимальной плотности сгустка, G – плотность сгустка, EPL – лизис сгустка, А – последняя измеренная амплитуда, CI – интегральный показатель состояния системы гемостаза, LY30 – индекс лизиса через 30 мин.
При развитии кровотечения продолжена инфузия транексамовой кислоты в указанной дозе (суммарно за время операции введено 2000 мг) [6], что наряду с последующей плазмотрансфузией в количестве 1200 мл позволило сохранить коагуляционный потенциал крови, что подтверждено последующей ТЭГ и формированием плотного сгустка в ране (рис. 2).
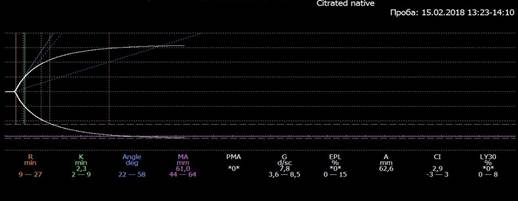
Рис. 2. Компенсация гемостаза на фоне трансфузии СЗП и введения ингибиторов фибринолиза
*Примечание: R – продолжительность реакции до образования нитей фибрина, К – скорость образования кровяного сгустка, Angle – скорость роста сгустка и увеличение его прочности, характеризует активность фибриногена, МА – показатель максимальной плотности сгустка, G – плотность сгустка, EPL – лизис сгустка, А – последняя измеренная амплитуда, CI – интегральный показатель состояния системы гемостаза, LY30 – индекс лизиса через 30 мин.
Впоследствии произведена ИААР в объеме 492 мл аутоэритроцитов. Гемодинамика оставалась стабильной в течение всего времени анестезиологического пособия и ОВ, пульс удовлетворительных качеств, с частотой 72–88 мин-1; АД = 105–125 и 60–65 мм рт. ст.; аксиллярная температура = 36,3оС; насыщение гемоглобина артериальной крови кислородом (SatаО2) оценивалось неинвазивно, путем пульсоксиметрии, и составляло 97–99% на фоне ингаляции увлажненного кислорода через лицевую маску.
На фоне проводимых мероприятий анестезиолого-реаниматологического и хирургического характера отмечена положительная динамика – кровотечение остановлено. Состояние больной расценено как тяжелое за счет МАК, стабильное. Сознание активное. Кожный покров обычной окраски, сухой, теплый на ощупь. Видимые слизистые розовые. После завершения заместительной терапии и ИААР гемодинамика устойчивая, пульс удовлетворительных качеств с частотой 72–76 мин-1; АД = 110 и 65 мм рт. ст.; аксиллярная температура = 36,8оС. По мочевому катетеру в хорошем темпе выделяется прозрачная желтая моча (300 мл за время операции). Длительность операции составила 1 ч 41 мин.
Общий объем кровопотери оценен в 1476 мл. Инфузионно-трансфузионная программа составила 3692 мл, из которых кристаллоиды – 1500 мл, коллоиды (производные ГЭК) – 500 мл, СЗП – 1200 мл, аутореинфузия – 492 мл.
К моменту окончания операции и реинфузии имели место следующие показатели эритроцитарного ростка: гемоглобин = 105 г/л; эритроциты = 2,9×1012/л; гематокрит = 28%; уровень тромбоцитов 178×109/л.
Через 5 мин после окончания ОВ пациентка переведена в палату реанимации и интенсивной терапии. В течение первых суток после ОВ проводились АБТ цефтриаксоном 4 г в сутки, обезболивание ропивакаином 0,2%-ным 6–8 мл/ч эпидурально; профилактика венозных тромбоэмболических осложнений осуществлялась далтепарином натрия 5000 МЕ/сут с началом через 12 ч после катетеризации эпидурального пространства, инфузионная терапия – растворами кристаллоидов (1700 мл). Состояние пациентки за указанный период оценивалось как стабильно тяжелое. Сознание активное, пациентка ориентирована в собственной личности, пространстве и времени, неврологического дефицита не отмечалось. Жизненно важные функции систем внешнего дыхания и кровообращения устойчивы. Колебания показателей гемодинамики: АД = 115–125 и 60–65 мм рт. ст.; пульс = ЧСС = 60–76 мин-1; аксиллярная температура = 37,0оС; SataО2 = 97–99% без дополнительной оксигенотерапии. Диурез за первые сутки наблюдения составил 4200 мл. К концу указанного периода времени имела место следующая динамика лабораторных показателей: АЧТВ = 31,1 с; фибриноген 3,0 г/л; в ОАК: гемоглобин = 98 г/л; гематокрит = 26%; эритроциты = 2,7×1012/л; тромбоциты = 186×109/л. Уровень общего белка 52,9 г/л.
Пациентка переведена в акушерское послеродовое отделение на вторые сутки после операции в относительно удовлетворительном состоянии с рекомендациями продолжать указанную выше АБТ цефтриаксоном в прежней дозе, антикоагулянтную терапию далтепарином натрия 5000 МЕ/сут до 6 недель после родоразрешения, обезболивание ненаркотическими анальгетиками, а также проводить антианемическую терапию препаратами железа («Феррум-лек» 100 мг/сут). Выписана из стационара на седьмые сутки после ОР в удовлетворительном состоянии со следующими лабораторными показателями ОАК: гемоглобин = 111 г/л; гематокрит = 29%; эритроциты = 3,1×1012/л; тромбоциты = 242×109/л.
Представленное клиническое наблюдение свидетельствует о высокой эффективности применения ингибиторов фибринолиза (транексамовой кислоты) в сочетании с заместительной терапией СЗП в комплексе ТП для коррекции нарушений системы гемостаза, возникающих при МАК, обусловленной патологией расположения плаценты, в том числе возникающей за счет нарушений коагуляционного потенциала при массивном поступлении тканевого тромбопластина, обусловливающего дальнейшую активацию фибринолиза. Для успешного проведения комплексной интенсивной терапии МАК необходим динамический контроль системы гемостаза с применением метода ТЭГ или ротационной тромбоэластометрии со своевременной интерпретацией полученных результатов и коррекцией ТП.
Проведение КСЭА в указанной ситуации позволило купировать исходную артериальную гипертензию у пациентки, обусловленную наличием сопутствующей патологии, обеспечить поддержание уровня среднего АД во время операции, способствующего сохранению ламинарности кровотока, облегчавшей тромбообразование в зоне операции, и вместе с тем обеспечить адекватную перфузию всех жизненно важных органов (несмотря на объем кровопотери, гемодинамика оставалась стабильной в течение всего интраоперационного периода, в том числе и при высоком темпе кровопотери после отделения плаценты и диагностике врастания участка последней с развитием МАК), что свидетельствует о возможности применения данного метода хирургического обезболивания при операциях высокого риска МАК, в том числе и с расширением объема.
Заключение. Применение концепции хирургического обезболивания в варианте КСЭА при операциях высокого риска МАК возможно и эффективно при проведении последних как в плановом, так и в экстренном порядке. Осуществление подобного метода обезболивания возможно в акушерском стационаре III уровня. Несмотря на среднюю кровопотерю, не превышающую физиологическую при ОР в условиях применения данного метода обезболивания, необходима готовность персонала к применению всех доступных в данном стационаре вариантов ТП. Достаточный темп инфузионно-трансфузионной терапии, своевременное применение сред заместительной терапии, начало ИААР одновременно с ОВ позволяют минимизировать нежелательные гемодинамические эффекты, развитие которых возможно при применении данной концепции хирургического обезболивания, а также пролонгировать обезболивание при расширении объема операции с обеспечением оптимального метода анальгезии в послеоперационном периоде, решить проблему «полного желудка» и связанной с ней высокой вероятности аспирационных осложнений при проведении ОР, в том числе и по экстренным показаниям. Нейроаксиальные методы обезболивания могут рассматриваться в виде технологий кровесбережения, и их применение при ОР пациенток группы высокого риска МАК должно быть расширено в условиях соответствующей квалификации медицинского персонала и материально-технического обеспечения лечебно-профилактического учреждения родовспоможения.



