Инфекционные осложнения первичного эндопротезирования (ЭП) тазобедренного сустава (ТБС) развиваются в 0,51-2% наблюдений и 4% ревизионных эндопротезирований (реЭП) [1-3]. При этом доля хирургических вмешательств по поводу перипротезной инфекции (ППИ) в специализированном ортопедическом центре значительно выше. Согласно данным локального регистра ФГУ «НМИЦ ТО им. Р.Р. Вредена» ППИ ТБС служит показанием к 44,76% реЭП, среди которых доля осложнений первичного ЭП составляет 27,63%, а ревизионных операций 69,0% [4].
Как правило, при обсуждении плана лечения хронической ППИ ортопедам необходимо сделать выбор между двумя ревизионными стратегиями: одно- или двухэтапным реЭП. В настоящее время обе методики стабильно демонстрируют сопоставимые, высокие результаты эрадикации инфекции. Согласно данным, приведённым в обзоре Kunutsor S.K. et al. (2018), частота рецидивов ППИ через 3,7 года после одно- и двухэтапного реЭП составила 16,8 (95% CI 13,6–20,7) и 32,3 (95% CI 27,3–38,3) соответственно [5].
Обязательным этапом всех хирургических техник лечения хронической ППИ является тотальное удаление имплантатов в области инфекционного воспаления, как единственный способ удаления зрелых микробных биоплёнок [6; 7]. Необходимость следовать данному требованию порождает другую, не менее серьёзную проблему – формирование дефектов кости на месте удалённого эндопротеза [8]. В настоящее время разработаны и доступны наборы инструментов для удаления имплантатов с минимальной потерей костной массы. Однако даже хорошо оснащённая, опытная хирургическая бригада не всегда способна избежать выполнения остеотомии или других технических приёмов разрушения кости для мобилизации прочно фиксированных конструкций [6; 7; 9].
Одной из первых работ, посвящённых предупреждению формирования дефектов, была публикация Morley J.R. et al. (2012), в которой обоснована хирургическая тактика сохранения стабильной цементной мантии при удалении конструкций эндопротеза в ходе двухэтапного реЭП [10]. Эрадикация ППИ была достигнута у 14 из 15 пациентов при сроке наблюдения 82 (60-192) месяца.
В дальнейшем несколько исследований были посвящены возможности сохранения хорошо фиксированных компонентов эндопротеза при двухэтапном реЭП [11; 12]. Нестабильные конструкции подлежали удалению, а дефекты кости замещали временным антибактериальным спейсером. Во время операции первого этапа выполняли радикальную хирургическую обработку, заменяли модульные компоненты эндопротеза. В большинстве случаев удаляли вертлужный компонент и сохраняли бедренный. Исходы операции оценивали в течение 2-4 лет, частота купирования инфекционного воспаления составляла 89%.
Логичным продолжением опубликованных работ стало исследование El-Husseiny M. et al. (2016) о результатах парциального одноэтапного реЭП [8]. Авторы подчёркивали необходимость тщательного отбора пациентов в когорту исследования на основании всестороннего анализа дизайна, стабильности компонентов эндопротеза, степени компенсации хронических заболеваний пациента, наличия иммуносупрессии, характера микробных возбудителей и их чувствительности к антибиотикам. При длительности наблюдения 7,1 года (5-9,9 года) из 18 больных, включённых в исследование, рецидив ППИ развился в 3 (17%) наблюдениях.
Таким образом, сегодня имеются немногочисленные работы, посвящённые преимуществам и недостаткам субтотального реЭП у пациентов с ППИ. Необходимо отметить, что данная хирургическая техника всё ещё находится в стадии разработки, и это объясняет осторожное отношение к ней [8]. До настоящего времени критерии отбора пациентов, показания к одно- или двухэтапному частичному реЭП, а также эффективность методик остаются недостаточно изученными [11].
Целью нашего исследования было оценить эффективность субтотального (частичного) реЭП у больных хронической ППИ ТБС.
Материалы и методы исследования
В проспективное когортное исследование были включены больные хронической ППИ ТБС, получавшие лечение в отделении гнойной хирургии в 2017-2020 гг.
Решение о включении пациента в исследование принималось коллегиально мультидисциплинарной группой врачей (ортопеды, терапевты, микробиологи, клинические фармакологи, рентгенологи, сосудистые и пластические хирурги). Обсуждение продолжалось в течение предоперационного периода обследования и во время операции, до завершения радикальной хирургической обработки (РХО).
Критерии включения в исследование были следующие: 1) один из компонентов эндопротеза стабилен рентгенологически и клинически; 2) наличие хронической ППИ в области тазобедренного сустава вне зависимости от пола и возраста пациента; 3) выделен штамм возбудителя, чувствительный к антибиотикам с пероральной формой препаратов; 4) дефект кости позволяет имплантировать стандартные или ревизионные конструкции эндопротеза (дефект вертлужной впадины 1-3А (Paprosky), бедра 1-3В (Mallory)); 5) мягких тканей достаточно для укрытия раны; 6) инфекционное воспаление мягких тканей ограниченное (свищ, абсцесс); 7) отсутствуют другие не санированные очаги хронической инфекции; 8) имплантат-ассоциированный остеомиелит I (медуллярный) или II (поверхностный) анатомического типа, физиологический класс больного А, В (l,s) (Cierny-Mader, 1985).
Критерием невключения считали нестабильность обоих компонентов эндопротеза, синдром системной воспалительной реакции (ССВР), сепсис.
Критерии исключения применяли в ходе обследования пациентов и в процессе самой операции: 1) инфекционное воспаление мягких тканей неограниченной формы (флегмоны) или обширные гнойные затёки к сосудисто-нервным пучкам; 2) дефект мягких тканей, не позволяющий ушить рану; 3) дефекты вертлужной впадины 3В (Paprosky) и бедренной кости 4 (Mallory) и более, которые были выявлены до операции или сформировались в результате РХО; 4) имплантат-ассоциированный остеомиелит III (локализованный) или IV (диффузный) анатомического типа, физиологический класс пациента C (Cierny-Mader, 1985).
При выявлении до или во время операции критериев исключения тактику лечения больных изменяли на тотальное двухэтапное реЭП. В результате отбора из 85 больных, которых при первичном осмотре считали кандидатами на субтотальное реЭП, критериям включения соответствовали только 23 (27,1%). В 62 (72,9%) наблюдениях на последующих этапах предоперационной подготовки, а также в ходе операции были выявлены критерии исключения, пациентам выполнено тотальное двухэтапное реЭП. Всем пациентам, отвечавшим критериям включения, выполняли субтотальное (частичное) реЭП ТБС. В исследование включили 23 пациента (рис. 1).
В зависимости от степени инфекционного поражения кости и компенсации сопутствующих заболеваний были сформированы две группы больных. В первую группу вошли 11 (47,8%) пациентов с остеомиелитом бедренной кости I (медуллярный) анатомического типа и физиологическим классом больного А, которым выполнили одноэтапное субтотальное (частичное) реЭП (IэтЧЭП). Во вторую группу были включены 12 (52,2%) пациентов с остеомиелитом бедренной кости II (поверхностный) анатомического типа и физиологическим классом В (l), которым выполнили субтотальное (частичное) двухэтапное реЭП (IIэтЧЭП).
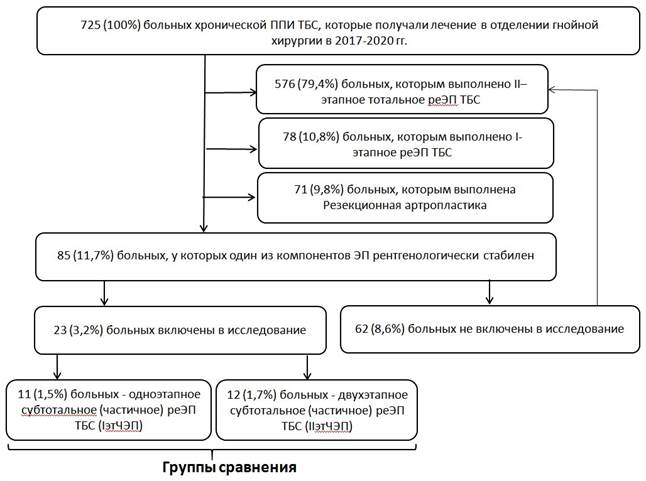
Рис. 1. Дизайн исследования
Диагностику ППИ выполняли в соответствии с критериями ICM (2013) [13]. В данной редакции международной согласительной конференции свищевой ход, наряду с двукратным положительным результатом микробиологического посева, является одним из двух «больших» признаков ППИ, достаточных для подтверждения диагноза. При отсутствии данных критериев, для диагностики ППИ считали достаточным наличие трёх из пяти «малых» признаков. Оценку характера ППИ (острая или хроническая) выполняли на основании современного представления о патогенезе имплантат-ассоциированной инфекции и классификации ППИ, предложенной Zimmerli W. (2014) [14].
Хирургическая техника. Частичное реЭП выполняли по протоколу одно- или двухэтапного реЭП. Парентеральную антибактериальную терапию (АБТ) начинали после взятия из операционной раны образцов тканей для микробиологического исследования. В положении больного на операционном столе на здоровом боку делали разрез по старому операционному рубцу с иссечением последнего и РХО раны на всю глубину. Хорошо фиксированные конструкции эндопротеза после клинической пробы на стабильность сохраняли. После оценки степени инфекционного поражения мягких тканей и кости, а также условий для стабильной имплантации спейсера принимали окончательное решение о возможности выполнения частичного реЭП и выборе одно- или двухэтапной методики. Послеоперационная рана была ушита первично во всех случаях, так как это было одним из критериев включения пациентов в группу исследования. Лабораторный контроль выполняли дважды в неделю, оценивая динамику восстановления основных показателей гомеостаза. Мобилизацию больных начинали на следующий день после удаления дренажей или на 3-4-е сутки после операции. Полную нагрузку разрешали через 3-8 недель после операции в зависимости от фиксации эндопротеза (спейсера).
Антибактериальная терапия. Стартовая АБТ была широкого спектра, но с обязательным учетом выделенных до операции возбудителей. Выбор антимикробных средств для добавления в костный цемент также осуществляли на основании данных предоперационного микробиологического исследования. При необходимости АБТ корректировали после получения результатов исследования интраоперационного биологического материала. Контроль безопасности АБТ включал оценку активности печёночных трансаминаз и уровня креатинина.
Этическая экспертиза. Все манипуляции, выполненные в исследовании с участием людей, соответствовали этическим стандартам институционального и/или национального исследовательского комитета, а также Хельсинкской декларации 1964 г. и более поздним поправкам к ней или сопоставимым этическим стандартам. Для этого типа исследования формального согласия не требуется.
Результат эрадикации ППИ ТБС изучали не менее чем через 12 месяцев после операции частичного реЭП. Появление симптомов инфекции в течение одного года после операции считали рецидивом ППИ, после – инфекционным осложнением, возникшим по причинам, не связанным с предыдущим клиническим случаем ППИ.
Оценку функциональных результатов реЭП выполняли с помощью шкалы Harris (HHS), предполагающей оценку четырех категорий: боль, функция, деформация, амплитуда движений. Качество жизни больных изучали с помощью опросника EQ-5D-5L, описывающего профиль здоровья тремя уровнями выраженности проблем в пяти компонентах (подвижность, уход за собой, обычная деятельность, боль/дискомфорт, тревога/депрессия) и балльной оценки, полученной с помощью визуальной аналоговой шкалы (ВАШ).
Статистический анализ
Регистрацию, систематизацию первичных данных и визуализацию полученных результатов выполняли в электронных таблицах Microsoft Office Excel 365. Статистический анализ проводили средствами программной системы Statistica 10.
Для описания количественных показателей выполняли проверку на нормальность распределения по критерию Колмогорова - Смирнова. При нормальном распределении для описания признака использовали его среднее значение и среднее квадратичное отклонение; при распределении, отличном от нормального - медиану (Ме), а в качестве мер рассеяния нижний (Q1) и верхний (Q3) квартили (25–75% МКИ). Сравнение количественных параметров (возраст, длительность стационарного лечения, длительность операции и объем кровопотери) в исследуемых группах осуществляли с использованием критериев Манна – Уитни.
Номинальные данные (пол, тип ППИ, коморбидность, тип спейсера и исход) описывали условными кодами не измеряемых категорий, не подлежащих упорядочиванию. В связи с малым количеством наблюдений сравнение номинальных данных проводилось при помощи критерия хи-квадрат Пирсона с поправкой на непрерывность Йейтса. Различия между группами считали статистически значимыми при p<0,05.
С целью количественной оценки зависимости вероятности исхода от наличия фактора риска был рассчитан показатель отношения шансов (Odds retio, OR) с 95% доверительным интервалом (95% Confidence interval, CI).
Результаты исследования и их обсуждение
При анализе распределения больных по половому признаку установлено, что группу IэтЧЭП составляли только лица женского пола (11 (100%) случаев), а гендерное распределение пациентов в группе IIэтЧЭП было сопоставимым (5 (41,7%) женщин и 7 (58,3%) мужчин) (p=0,002) (табл. 1).
Таблица 1
Распределение больных в группах сравнения по демографическим показателям, анамнезу и сопутствующим заболеваниям
|
№ |
Показатели |
IэтЧЭП, n=11 |
IIэтЧЭП, n=12 |
p |
||
|
1 |
Пол (n, %) |
Женщины |
11 (100%) |
5 (41,7%) |
0,002 |
|
|
Мужчины |
0 |
7 (58,3%) |
||||
|
2 |
Возраст (Ме, МКИ) |
60 (52-81) |
45,5 (39,5-65,5) |
>0,05 |
||
|
3 |
Хроническая гематогенная (n, %) |
8 (72,7) |
8 (66,6) |
>0,05 |
||
|
4 |
Санирующие операции до частичного реЭП (Ме, МКИ) |
2 (1-4) |
1 (1-1) |
>0,05 |
||
|
5 |
Интервал времени: манифестация ППИ – частичное реЭП (дней, Ме, МКИ) |
402 (151-820) |
508 (136-1069) |
>0,05 |
||
|
6 |
ИМТ* (кг/м, Ме, МКИ) |
26,3 (22-32) |
25,2 (24-30) |
>0,05 |
||
|
7 |
Патология ССС*(Ме, МКИ) |
6 (66,7) |
8 (66,7) |
>0,05 |
||
|
8 |
ЖКТ*(Ме, МКИ) |
8 (88,9) |
10 (83,3) |
>0,05 |
||
|
9 |
Анемия (Ме, МКИ) |
6 (66,7) |
5 (41,7) |
>0,05 |
||
|
10 |
ASA* (Ме, МКИ) |
1 |
2 (18,2) |
0 |
>0,05 |
|
|
2 |
8 (72,7) |
11 (91,7) |
>0,05 |
|||
|
3 |
1 (9,1) |
1 (8,3) |
>0,05 |
|||
*ИМТ – индекс массы тела, ССС – сердечно-сосудистая система, ЖКТ – желудочно-кишечный тракт, ASA - физический статус пациентов по классификации ASA (Американского общества анестезиологов).
Значение медианы возраста пациентов в группе IэтЧЭП на момент операции составило 60 (52-81) лет, в группе IIэтЧЭП 45,5 (39,5-65,5) лет и не имело статистически значимых различий (p=0,119).
Во время лечения заболевания ТБС, осложнений ЭП и ППИ на этапах до специализированной ортопедической помощи (субтотального реЭП) 36,4% больных группы IэтЧЭП и 25,0% пациентов группы IIэтЧЭП перенесли различные оперативные вмешательства на суставе. После манифестации симптомов инфекционного осложнения больные в обеих группах около 1,5 лет не получали специализированной ортопедической помощи.
Среди сопутствующих заболеваний чаще других отмечали патологию сердечно-сосудистой системы (ХСН, ИБС, артериальная гипертензия), ЖКТ и анемию. Физический статус больных преимущественно определяли как «Легкие заболевания без существенных функциональных ограничений», что отвечало критериям 2-го класса по системе ASA.
Несмотря на то что медиана ИМТ в группах исследования превышала норму, нормальную массу тела имели в группе IэтЧЭП - 4 (36,4%) пациента, в группе IIэтЧЭП - 6 (50,0%) больных.
Существенных различий в большинстве показателей санирующей операции и послеоперационного периода обнаружено не было (табл. 2).
Таблица 2
Характеристика санирующего этапа реЭП в группах исследования
|
№ |
Показатели |
IэтЧЭП (Ме, МКИ) |
IIэтЧЭП (Ме, МКИ) |
p |
|||
|
1 |
Время операции (мин.) |
180 (120-210) |
193(183-225) |
0,165 |
|||
|
2 |
Объем кровопотери интраоперационной (мл) |
800 (550-1150) |
500 (200-800) |
0,068 |
|||
|
3 |
Дренажи |
Количество (шт.) |
1 (0-1) |
1 (1-2) |
0,007 |
||
|
4 |
Пункции |
Количество |
5 (2-5) |
2 (1,5-3) |
0,064 |
||
|
Объем аспирата (мл) |
45 (45-110) |
53 (50-85) |
0,993 |
||||
|
5 |
Трансфузия эр. массы |
1,5 (1-2) |
2 (1,5-3,5) |
0,145 |
|||
|
6 |
Трансфузия СЗП (мл) |
590 (440-610) |
820 (560-1090) |
0,113 |
|||
|
7 |
Длительность госпитализации (дней) |
27 (18-31) |
27 (22-37) |
0,871 |
|||
|
8 |
Стоимость лечения, тыс. руб. |
Этап санации |
246 (165-341) |
189 (162-216) |
0,071 |
||
|
Этап реимплантации |
0 |
217 (197-231) |
0,000 |
||||
Общее количество перенесенных операций за всё время лечения ППИ ТБС в изученной когорте больных не имело статистически значимых различий: в группе IэтЧЭП - 2 (2-3), в группе IIэтЧЭП - 1 (1-2), p=0,094.
В группе IэтЧЭП после санирующего этапа выполняли повторные хирургические вмешательства по поводу рецидива ППИ (один (9,1%) случай) и гематомы послеоперационной раны в раннем послеоперационном периоде (4 (36,4%) наблюдения).
У 4 (33,3%) больных группы IIэтЧЭП после санирующего этапа реЭП и развития рецидива ППИ выполняли повторную РХО и переустановку антибактериального спейсера. Пациентам без симптомов рецидива ППИ (8 (66,7%) наблюдений) выполняли реимплантацию эндопротеза. Интервал между этапами составил 2,5 (1-4) месяца.
Данные лабораторных исследований до операции субтотального реЭП в изученной когорте были сопоставимы. Вместе с тем в группе IIэтЧЭП значения СОЭ (61 (33-83,5) мм/час), СРБ (20,5 (16,5-56) мг/л) были выше показателей группы IэтЧЭП: СОЭ 37 (14-61) мм/час, СРБ 14,8 (6,5-21,3) мг/л.
Статистически значимых различий в структуре дефектов костей, формирующих тазобедренный сустав, у больных изученной когорты выявлено не было.
Анализ инфекционного поражения мягких тканей и кости не выявил существенной разницы в группах исследования. В то же время частота воспаления мягких тканей в группе IIэтЧЭП преобладала по всем изученным параметрам (p>0,05), что обусловлено критериями выбора метода хирургического лечения (рис. 2).
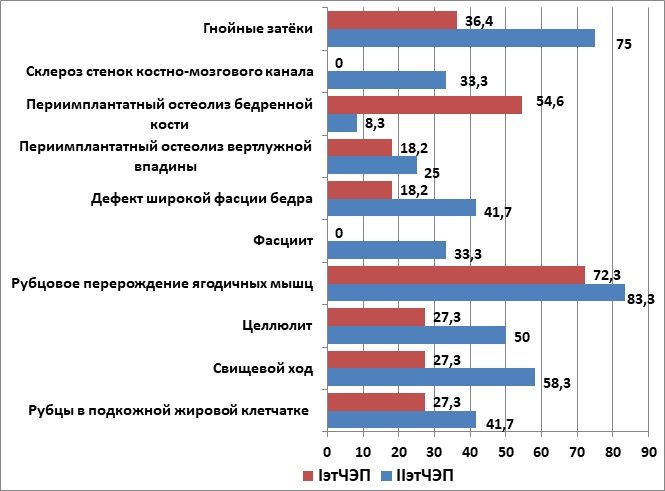
Рис. 2. Инфекционное поражение мягких тканей и кости в группах сравнения (p>0,05)
В связи с малым количеством наблюдений микробный пейзаж изучали в общей когорте. Установлено, что среди патогенных микроорганизмов преобладали Staphylococcus: в 40% случаев выделяли S. aureus, а в 25% - S. epidermidis (рис. 3).
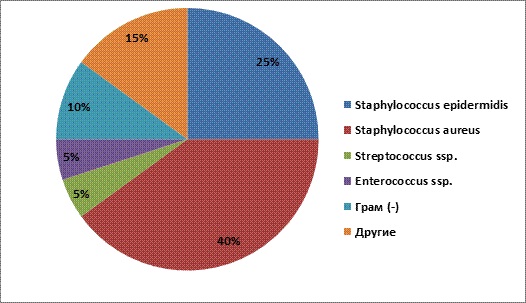
Рис. 3. Распределение частоты встречаемости патогенных микроорганизмов в когорте исследования
Информация об исходах лечения была доступна во всех наблюдениях. Длительность наблюдения в обеих группах больных была сопоставима и составила 19 (14-38) и 19 (13-32) месяцев соответственно в группах IэтЧЭП и IIэтЧЭП (p=0,742). Установлено, что эрадикация инфекции была достигнута у 90,9% (n=10) пациентов группы IэтЧЭП и 83,3% (n=10) – в группе IIэтЧЭП (p>0,05) (рис. 4).
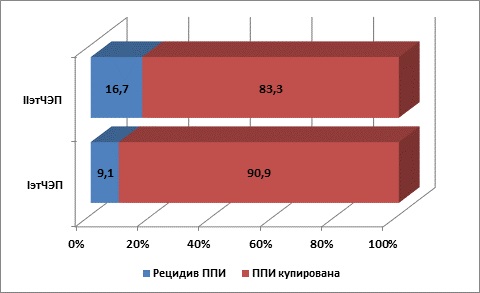
Рис. 4. Результаты субтотального (частичного) реЭП в группах сравнения
В течение года после индексной (санирующей) операции рецидив ППИ развился в группе IэтЧЭП в одном случае через 1,6 мес., в группе IIэтЧЭП – в двух случаях через 0,5 и 4,1 мес. Кроме того, ещё у двух больных группы IIэтЧЭП симптомы инфекционного воспаления манифестировали более чем через один год после санации (15 и 18,6 месяца соответственно).
Летальных исходов среди больных, перенёсших IIэтЧЭП, не было. В группе IэтЧЭП смерть 2 (18,2%) пациентов, наступившая через 6 месяцев и 1,6 года после операции в возрасте 81 и 84 года соответственно, не была связана с рецидивом ППИ.
До операции больные в группе IIэтЧЭП чувствовали себя достоверно лучше пациентов из группы IэтЧЭП, что подтверждают результаты опроса по шкалам HHS, EQ-5D-5L и ВАШ (табл. 3).
Таблица 3
Результаты опроса больных хронической ППИ ТБС при контрольном осмотре в группах сравнения
|
№ |
Критерии оценки |
IэтЧЭП, (Ме, МКИ) |
IIэтЧЭП, (Ме, МКИ) |
p |
|
|
1 |
Сроки наблюдения (мес.) |
19 (12-38) |
19 (12-32) |
0,742 |
|
|
2 |
Шкала Harris (HHS) |
До операции |
35 (21-54) |
60 (46-69) |
0,016 |
|
После операции |
87 (53-93) |
86 (69-93) |
0,450 |
||
|
3 |
EQ-5D-5L |
До операции |
0,32 (0,36-0,59) |
0,59 (0,54-0,65) |
0,018 |
|
После операции |
0,71 (0,58-0,89) |
0,75 (0,59-0,85) |
0,343 |
||
|
4 |
ВАШ |
До операции |
40 (25-45) |
63 (53-78) |
0,003 |
|
После операции |
75 (50-95) |
73 (53-95) |
0,712 |
||
Необходимо отметить низкую оценку исходного состояния больных в группе IэтЧЭП по всем трём шкалам: HHS 35 (21-54) баллов, EQ-5D-5L 0,32 (0,36-0,59), ВАШ - 40 (25-45).
При контрольных осмотрах (опросах) через 19 месяцев после индексной операции итоговая оценка функциональных возможностей больных в группах сравнения по шкале HHS (87 и 86 баллов, p=0,45) и социальной адаптации по шкале EQ-5D-5L (0,71 и 0,75 балла, p=0,34) была сопоставима.
В современной ортопедии субтотальное (частичное) реЭП является одной из наиболее противоречивых методик выбора хирургического лечения хронической ППИ ТБС. С одной стороны, по данным научных публикаций, субтотальное (частичное) реЭП с сохранением стабильных имплантатов, выполненное в отдельных, тщательно изученных случаях, не уступает тотальному реЭП в частоте эрадикации ППИ (81-100%) [8]. При этом исследователи считают, что операция имеет очевидные преимущества, так как снижает риск значительного увеличения дефектов кости, дополнительного повреждения мягких тканей и нарушения кровоснабжения проксимального отдела бедренной кости с последующим возможным развитием остеомиелита.
С другой стороны, в условиях хронической ППИ всегда сохраняется значительный риск неполного удаления инфицированных тканей или микробных биопленок с поверхности оставленных имплантатов. В этом случае неизбежен рецидив ППИ с необходимостью выполнения тотального этапного реЭП и, вероятно, катастрофическими последствиями для больного [8].
Условием, определяющим успех субтотального реЭП, считают строгое соблюдение жестких требований к отбору пациентов [11; 12]. Shi X. et al. (2020) подчёркивает, что именно ограничение показаний к данному типу операции позволило добиться эрадикации ППИ у 100% больных при среднем сроке наблюдения 67,4 мес. [6]. Степень «сужения» показания характеризует количество представленных наблюдений (3,3% от общей популяции за период исследования) и отсутствие летальных исходов. Противопоказаниями к сохранению хорошо фиксированных компонентов эндопротеза авторы считали: 1) остеолиз вертлужной впадины и бедренной кости, несмотря на хорошую фиксацию имплантатов; 2) выделение патогенных микроорганизмов с высокой вирулентностью и антибактериальной резистентностью (MRSA, Mycobacterium tuberculosis); 3) полимикробная инфекций и свищевой ход, как возможная причина ее возникновения; 4) рецидивы ППИ в анамнезе больного.
Crawford D. at al. (2019) несколько расширяли показания к субтотальному (частичному) реЭП [9]. Среди наблюдений описаны случаи, имевшие историю рецидивов ППИ, другие очаги хронической инфекции, отрицательные результаты бактериологического исследования накануне операции или патогены с высокой резистентностью. Следствием такого подхода явилась наиболее многочисленная из опубликованных в литературе когорта (n=53) двухэтапного частичного реЭП, которая составляла 13% от общего количества больных в изученный период. Исходы наблюдали до 5,5 лет, купирование ППИ было достигнуто у 81% пациентов.
В нашем исследовании критерии включения ближе к требованиям Crawford D. et al. (2019). Вероятно, поэтому при сроке наблюдения в среднем 19 мес. в когорте, составлявшей 3,2% от общего числа больных хронической ППИ ТБС в изученный период, результаты купирования ППИ в группах сравнения были достаточно низкие: в группе IэтЧЭП - 90,9%, в группе IIэтЧЭП - 83,3%.
Для определения возможных причин неудач был выполнен поиск независимых факторов риска. Принятие решения о выполнении пациентам IIэтЧЭП оказалось статистически значимым фактором риска рецидива ППИ (OR 3,9 CI 95% 1,1-14,2). Вероятно, такое отношение шансов связано с более ответственным соблюдением критериев отбора в группу IэтЧЭП. Кроме того, наличие дренажей в группе IIэтЧЭП было достоверным фактором риска рецидива ППИ (OR 7,0 CI 95% 1,04-46,9).
В отличие от группы IэтЧЭП, которая состояла целиком из пациентов женского пола, среди которых зарегистрирован только один рецидив ППИ, в группе IIэтЧЭП мужчин было 58,3%, женщин 41,7%. Однако статистически значимых различий отношения шансов развития рецидива ППИ в зависимости от пола больных в группе IIэтЧЭП выявлено не было: у женщин - OR 1,4 CI 95% 0,27-7,51, у мужчин – OR 2,8 CI 95% 0,53-14,73.
Эрадикация ППИ у меньшей доли пациентов в группе IIэтЧЭП (83,3%) свидетельствует о необходимости строгого отбора пациентов для выполнения субтотального реЭП. Во всех случаях рецидива ППИ в группе IIэтЧЭП имело место расширение показаний к субтотальному реЭП. Rahman W. et al. (2017) и другие авторы среди критериев исключения указывают наличие свищевого хода как возможную причину полимикробной инфекции [15]. В то же время в нашем исследовании у 7 (58,3%) больных группы IIэтЧЭП имелся свищ. Более того, при анализе лабораторных данных больных группы IIэтЧЭП, у которых в дальнейшем регистрировали повторное развитие инфекционных осложнений, исходно был более высокий уровень маркеров воспаления. Уровень СРБ перед санирующим этапом составил 59 (49,5-68,25) мг/л в сравнении с 19 (14,8-20,3) мг/л в наблюдениях, где рецидивов не было (OR 6,2 CI 95% 1,7-22,9). Аналогичные различия наблюдали и для СОЭ: 85,5 (77,-91) мм/час и 45,5 (26,3-61,75) мм/час соответственно (OR 3,7 CI 95% 1,1-13,1). Вероятно, своевременный отказ от выполнения субтотального (частичного) реЭП у больных с симптомами подострого инфекционного воспаления позволил бы уменьшить количество рецидивов ППИ.
Согласно актуальной редакции СанПиН 2.1.3.2630-10, инфекцию, развившуюся в течение года после установки имплантата, считают осложнением выполненной операции. В группе IIэтЧЭП из четырёх случаев повторного развития ППИ два (16,7%) развились через 0,5 и 4,1 месяца после индексной операции, что расценили как неэффективность лечения и рецидив инфекции. В двух других наблюдениях симптомы инфекционного воспаления манифестировали через 15 и 18,6 месяца после индексной операции и были определены как реинфекция области. Подтвердить это предположение могли бы данные бактериологического исследования, однако установить патогенную микрофлору не удалось, так как больные выбыли из дальнейшего исследования.
Мы не нашли в доступной медицинской литературе оценки финансовой эффективности частичного реЭП. Согласно данным нашего исследования, на этапе купирования ППИ средние затраты на один случай IIэтЧЭП (189 (162-216) руб.) меньше, чем при выполнении IэтЧЭП (246 (165-341) руб., p=0,071)). Однако, с учётом стоимости второго этапа – реимплантации эндопротеза (217 (197-231) тыс. руб.), суммарные затраты на двухэтапное лечение превысили затраты на одноэтапную методику в 1,7 раза: 406 и 246 тыс. руб. соответственно.
Наше исследование имело ограничения. Во-первых, в группах сравнения было малое число наблюдений. Несмотря на то что за период исследования в ФГУ «НМИЦ ТО им. Р.Р. Вредена» выполнено 735 реЭП по поводу ППИ ТБС, мы отобрали только 23 (3,2%) пациента, отвечавших критериям включения. В то же время количество наших наблюдений было сопоставимо с результатами, опубликованными другими исследователями [8; 11; 12]. Во-вторых, маленький размер выборки не позволил выявить статистически значимых различий среди пациентов по факторам риска, а также выполнить мультифакторный анализ в группах исследования. В-третьих, отсутствие информации о возбудителях в случаях неудовлетворительных результатов не позволяет четко установить причину манифестации инфекционно-воспалительных симптомов после индексной операции – рецидив ППИ или реинфекция.
Заключение
Размер проанализированной выборки слишком мал и не позволяет сделать окончательные выводы об эффективности и безопасности субтотального реЭП. Первые результаты частичного реЭП у больных хронической ППИ ТБС не уступают исходам тотального реЭП. В то же время, при соблюдении строгих критериев отбора пациентов и выполнении агрессивной хирургической обработки, субтотальное реЭП позволяет избежать деваскуляризации тканей, значительных дефектов кости и уменьшить вероятность развития осложнений в дальнейшем. Сегодня субтотальное реЭП остаётся операцией выбора для крупных ортопедических центров, накопивших значительный опыт лечения ППИ, где решение о выполнении операции принимают на основании обсуждения специализированной мультидисциплинарной группой врачей. Перед широким использованием частичного реЭП в ортопедической практике необходимы многоцентровые рандомизированные контролируемые исследования, которые определят место операции среди других хирургических методов лечения больных хронической ППИ ТБС.



