Тяжелая ожоговая травма по-прежнему характеризуется высокими показателями летальности, которые в первые сутки после термического воздействия связаны с развитием ожогового шока [1–4]. Ожоговый шок принято относить к одному из самых тяжелых видов шока [5]. Это обусловлено тем, что ожоговый шок сопровождается интенсивной болевой импульсацией из пораженных в результате термического воздействия раневых поверхностей, выраженной плазмапотерей за счет сгущения крови, а также тяжелейшей интоксикацией [6, 7]. Одновременно в ответ на термическую травму с развитием ожогового шока отмечаются выраженная активация симпатоадреналовой системы, а также системный воспалительный ответ [6, 8].
У пациентов с тяжелым ожоговым шоком клинически отмечают очень быстрое развитие гемодинамических расстройств, что проявляется с первых минут после термической травмы выраженной тахикардией, которая прогрессирует по мере развития шока, при этом частота сердечных сокращений может превышать 120–140 ударов в 1 минуту [9]. Одновременно у пациентов с тяжелым ожоговым шоком отмечают снижение артериального и центрального венозного давления, обусловленное прогрессированием шока и сопровождающееся значительным снижением перфузии внутренних органов, а также нарастающей гипоксией и выраженными электролитными расстройствами. По мере перехода ожогового шока в стадию необратимого шока – рефрактерного – первоначально развивается систолическая, а затем и диастолическая сердечная недостаточность. Нередко отмечают нарушения сердечной деятельности за счет появившихся аритмогенных расстройств.
С целью обоснования механизмов развития сократительной недостаточности миокарда левого желудочка при ожоговом шоке целесообразно проведение исследования, предполагающего осуществление морфометрического анализа изменений ультраструктуры кардиомиоцитов.
Цель исследования: изучить характер ультраструктурных изменений кардиомиоцитов, лежащих в основе механизмов развития острой сократительной недостаточности миокарда при тяжелом ожоговом шоке.
Материал и методы исследования
Для проведения ультраструктурного анализа миокарда осуществляли забор образцов миокарда левого желудочка сердца при проведении раннего секционного исследования умерших пациентов с тяжелой ожоговой травмой в областном комбустиологическом центре.
Секционный материал для электронно-микроскопического исследования – миокард левого желудочка – забирался в морге при проведении ранних вскрытий, через 2 ч после констатации биологической смерти, у погибших (N=5) от тяжелого ожогового шока (3 мужчин и 2 женщин; возрастная категория 32–44 года). Все погибшие имели термические ожоги 2–4-й степени площадью от 50% до 80%, полученные на пожарах, т.е. от действия пламени. Смерть всех пациентов наступила в первые двое суток с момента получения ожоговой травмы. В качестве контроля использовали аутопсийный материал, который был забран при проведении раннего вскрытия, через 2 ч после констатации биологической смерти, у доставленных «Скорой помощью» скоропостижно умерших мужчин (N=3) от «острой коронарной смерти» (возрастная категория 35–45 лет). Все аутопсии проводились в танатологическом отделе ГБУЗ НСО «Новосибирское областное клиническое бюро судебно-медицинской экспертизы», куда были доставлены тела умерших.
Для исследования ультраструктурной организации кардиомиоцитов фрагменты миокарда левого желудочка фиксировали в 4%-ном растворе параформальдегида, приготовленном на среде Хенкса, дофиксировали в 1%-ном растворе ОsO4 на фосфатном буфере (pH=7,4), дегидратировали в этиловом спирте возрастающей концентрации и заключали в эпон. Полутонкие срезы толщиной 1 мкм окрашивали толуидиновым синим и изучали под световым микроскопом «LEICA DM» (Германия). Ультратонкие срезы толщиной 70–100 нм контрастировали насыщенным водным раствором ацетат уранила и цитратом свинца и изучали в электронном микроскопе JEM 1400 (Япония). При увеличении х8000 получали цифровые микрофотографии фрагментов цитоплазмы кардиомиоцитов. Кардиомиоциты морфометрировали с помощью компьютерной программы Image J. Определяли объемные плотности митохондрий, миофибрилл, цитоплазмы с эндоплазматической сетью и гликогеном, лизосом при использовании закрытой тестовой системы с 323 точками. Статистическую обработку полученных результатов производили с использованием пакета программ STATISTICA v. 6 (StatSoftInc., США). Значимость различий оценивали, используя U-критерий Манна–Уитни, при уровне достоверности 95% (p<0,05).
Результаты исследования и их обсуждение
При ультраструктурном анализе миокарда левого желудочка умерших в стадии ожогового шока были выявлены деструктивные изменения ультраструктуры кардиомиоцитов. В кардиомиоцитах левого желудочка наблюдали структурные изменения (табл.), связанные с достоверно значимым увеличением (на 63%) объемной плотности цитоплазмы клеток в сравнении с контролем за счет выраженного отека (p<0,05) (рис. 1). Наряду с отеком кардиомиоцитов значительно увеличились размеры межфибриллярных пространств – также за счет развивающегося отека вследствие острых расстройств кровообращения (рис. 2). При этом следует отметить, что объемная плотность миофибрилл снижалась на 36%. Кроме того, отмечено нарушение структурной целостности миофибрилл в виде их разволокнения. Выявлено нарушение структуры кардиомиоцитов в области вставочных дисков (рис. 3).
Результаты морфометрии кардиомиоцитов при ожоговом шоке (М±SD)
|
Группа |
Митохондрии Vv |
Цитоплазма Vv |
Миофибриллы Vv |
Лизосомы Vv |
|
Контроль
|
36,57±3,28 |
11,61±2,47 |
50,77±2,52 |
0,84±1,23 |
|
Ожоговый шок
|
33,72±3,77 |
31,69±3,48*
|
32,49±4,16*
|
6,61±1,78*
|
Примечание: Vv – плотность структур * – отличия от соответствующих значений в контроле p≤0,05.

Рис. 1. Ультраструктура кардиомиоцита при ожоговом шоке.
Возрастание объемной доли цитоплазмы

Рис. 2. Ультраструктура кардимиоцита при ожоговом шоке.
Возрастание межфибриллярных пространств (стрелки)
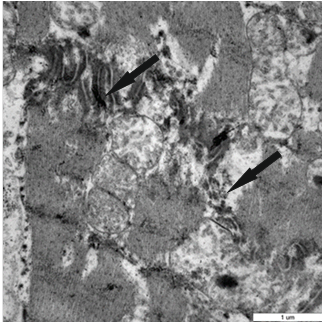
Рис. 3. Нарушение структуры вставочного диска (стрелки) при ожоговом шоке
При ожоговом шоке в кардиомиоцитах левого желудочка обращал на себя внимание полиморфизм митохондрий, проявляющийся в значительной разнице их размеров в пределах одной клетки. В митохондриях отчетливо была видна очаговая деструкция крист этих органелл (рис. 4). При этом объемная плотность митохондрий достоверно не изменялась.
Описанные изменения кардиомиоцитов левого желудочка сердца связаны со снижением энергообразующей, сократительной и белок-синтетической функцией при их альтерации в результате развития ожогового шока. Это является закономерным и обусловлено повышенными метаболическими затратами миокарда левого желудочка сердца в связи с выраженными расстройствами гемодинамики, вызванными ожоговым шоком.
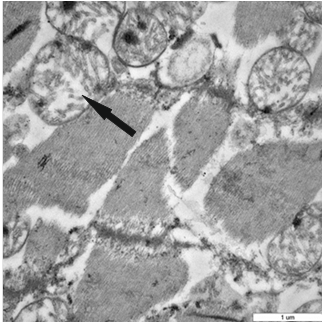
Рис. 4. Очаговая деструкция крист митохондрий в кардиомиоците при ожоговом шоке (стрелка)
При ожоговом шоке проведение ультраструктурного анализа кардиомиоцитов позволило выявить увеличение на 27% объемной плотности лизосом (рис. 5). Лизосомы при этом имели достаточно крупные размеры и часто содержали липофусцин (табл.).

Рис. 5. Крупные лизосомы с липофусцином в межфибриллярном пространстве кардиомиоцита при ожоговом шоке (стрелки)
С учетом выявленных ультраструктурных изменений кардиомиоцитов при ожоговом шоке можно рассуждать об активации аутофагии как важного процесса деградации посредством участия лизосом. Процесс аутофагии в миокарде при ожоговом шоке, вероятно, следует рассматривать как важный клеточный процесс, направленный на поддержание клеточного и энергетического гомеостаза в связи с деструктивными изменениями миофибриллярного аппарата кардиомиоцитов. Об этом свидетельствуют полученные при ультраструктурном анализе данные об увеличении содержания в клетках лизосом и одновременно наблюдаемом снижении объемной плотности миофибрилл, что может свидетельствовать о деградации поврежденных миофибрилл в лизосомах.
Наряду с описанными изменениями хочется подчеркнуть важность аутофагии с участием лизосом как компенсаторного процесса, направленного на поддержание структурно-функционального состояния кардиомиоцитов, в связи с процессом повреждения клеточных органелл при ожоговом шоке. Об этом свидетельствуют образование и накопление липофусцина, что связано с процессом повреждения мембран органелл, при этом повышение его содержания часто наблюдается в митотически неактивных клетках, какими являются кардиомиоциты [10, 11].
При трансмиссионной электронной микроскопии срезов миокарда в случаях тяжелой термической травмы, осложнившейся ожоговым шоком, обращало на себя внимание наличие в просвете большого количества капилляров – клеток крови, занимающих весь просвет сосудов. Это было связано с острыми расстройствами кровообращения, обусловленными выраженным сгущением крови в результате плазмопотери в области распространенных глубоких ожоговых ран. Следует отметить, что это были не только деформированные эритроциты, но и клетки лейкоцитарного ряда, например нейтрофильные лейкоциты или плазмоциты (рис. 6).
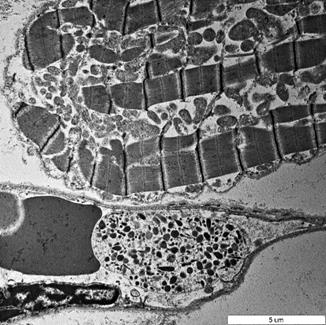
Рис. 6. Нейтрофил и эритроцит в просвете кровеносного капилляра
миокарда при ожоговом шоке
Ультраструктура миокарда контроля характеризовалась плотным расположением миофибрилл, вокруг которых были видны митохондрии с большим содержанием крист. Между тяжами митохондрий и миофибрилл располагались цистерны эндоплазматической сети, полисомальные рибосомы и гликоген.
Заключение
При развитии ожогового шока были выявлены изменения ультраструктуры кардиомиоцитов в виде отека клеток, увеличения межфибриллярных пространств, снижения объемной плотности миофибрилл и их внутренней дезорганизации, а также полиморфизм митохондрий с очаговыми повреждениями крист и повышение объемной плотности лизосом. Кроме того, отмечены снижение объемной плотности миофибрилл в сочетании с увеличением объемной плотности лизосом, а также накопление липидных включений и развитие аутофагии, что связано с процессом повреждения клеточных органелл кардиомиоцитов при ожоговом шоке. Внутриклеточная деградация кардиомиоцитов миокарда левого желудочка развивается в результате гипоксических, микроциркуляторных и токсических воздействий при ожоговом шоке.



